
|
|
|
OBEZITATEA
1. Introducere
Obezitatea este cea mai frecventa boala metabolica, prin natura sa fiind usor de pus in evidenta. Obezitatea "se vede", fiind o caracteristica "publica" a pacientului, in timp ce alte tulburari metabolice se diagnosticheaza pe baza unor determinari biochimice (26). Importanta acestei boli deriva din prevalenta sa crescuta si din asocierea cu comorbiditati severe, cum ar fi bolile cardiovasculare, diabetul zaharat, apneea de somn etc.
In acest capitol incercam sa prezentam date esentiale cu privire la etiopatogenia, complicatiile si tratamentul obezitatii.
2. Definitie, criterii de diagnostic
Obezitatea (in latina: ob = din cauza, esum = a manca) este o conditie complexa, multifactoriala, caracterizata printr-un exces de tesut adipos. In mod normal barbatii au tesut adipos in proportie de 15-20%, iar femeile de 25-30%. Aprecierea greutatii corporale in raport cu inaltimea sub forma indexului de greutate corporala (BMI - body mass index sau indicele masei corpului (IMC) - Quetelet) este cea mai obisnuita metoda intalnita in practica medicala pentru estimarea proportiei de tesut gras. Masa de tesut adipos poate fi apreciata si prin ecuatia Deurenberg, 1,2 x IMC + 0,23 x varsta (ani) - 10,8 x sex (femeile fiind codificate cu 0 si barbatii cu 1)-5,4, care are o eroare de 4% si explica 80% din variatiile greutatii corporale (60). Alta formula de calcul ce permite diagnosticarea obezitatii este formula MLI (Metropolitan Life Insurance), pentru barbati greutatea ideala (kg) = 50 + 0,75 x (inaltimea(cm)-150) + (varsta(ani)-20)/ 4; la femei valoarea ecuatiei se inmulteste cu 0,9 (26).
Organizatia mondiala a sanatatii (O.M.S.)a definit si clasificat arbitrar gradele obezitatii pe baza IMC, calculat prin raportul greutate / inaltime2. Clasificarea a avut ca punct de plecare frecventa ridicata a unor comorbiditati, boli cardiovasculare, diabet zaharat tip 2, cancere etc., la persoanele cu IMC peste 25 Kg/m2. Conform criteriului IMC obezitatea poate fi: gradul 1 cu IMC 30-34,9 Kg/m2, gradul 2 cu IMC 35-39,9 Kg/m2, gradul 3 cu IMC egal sau peste 40 Kg/m2. Pacientii cu IMC 25-29,9 Kg/m2 au fost definiti ca supraponderali. Alti indicatori folositi pentru definirea obezitatii sunt grosimea pliului cutanat (la nivel subscapular, tricepsului, bicepsului, suprailiac etc.), circumferinta taliei (normal sub 80 cm. la femei si sub 94 cm. la barbati), raportul circumferinta taliei / circumferinta soldului (WHR-waist to hip ratio, valori normale ≤ 0,85 la femei si ≤ 0,95 la barbati). Toti acesti parametrii antropometrici permit stabilirea claselor de risc clinic prin ajustarea valorilor IMC-ului.
3. Prevalenta
Primele date extinse cu privire la prevalenta obezitatii in Europa au fost furnizate de studiul WHO MONICA in 1989, care a cuprins subiecti din 39 tari europene cu varste cuprinse intre 35-64 ani (50). S-a raportat o prevalenta a obezitatii de 10-20% pentru barbati si 15-20% pentru femei. Pe de alta parte, supraponderalii au fost mai mult in randul barbatilor. Datele au aratat un procent de peste 50% a persoanelor obeze si supraponderale in Europa. In majoritatea tarilor europene rata obezitatii variaza invers proportional cu nivelul socio-economic, in special in randul femeilor. In tara noastra incidenta obezitatii este de aproximativ 17% in mediul rural si cca. 20% in mediul urban, fiind mai frecventa la femei; la copii variaza intre 5-10% (26). Recent, in studiul Urziceni, la populatia adulta excesul ponderal s-a intalnit in 22,8 % din cazuri, iar obezitatea in 25,2%, insumand 48% din cazuri. Insa, prevalenta cea mai ridicata din lume a excesului ponderal se inregistreaza in S.U.A., cu o crestere semnificativa in ultimele decade. Astfel, in perioada 1999-2000, conform criteriilor O.M.S., s-au inregistrat 67% obezi si 27,5% supraponderali printre barbati, in timp ce femeile au fost 62% obeze si 34% supraponderale (60). Prevalenta obezitatii a crescut in unele minoritati, cea mai ridicata rata fiind la nativii americani, hispanici si afro-americani. Indienii Pima, care in trecut aveau o constitutie slaba (sub- sau normoponderali), sunt obezi in proportie de 80%, iar prevalenta diabetului zaharat tip 2 (T2DM) este de 40%, cea mai mare din lume.
4. Tipurile de obezitate si caracteristicile lor
Se cunosc doua modele de baza ale distributiei tesutului adipos la indivizii obezi: obezitatea abdominala (asa zis androida, centrala) cu cele doua componente, viscerala si subcutana, si obezitatea gluteofemurala (asa zis ginoida). Stabilirea tipului de obezitate a pacientilor are o importanta clinica majora. Astfel, obezitatea centrala este un factor determinant puternic al insulinorezistentei si se asociaza cu un risc crescut de ateroscleroza, diabet zaharat, dislipidemie, hipertensiune si cancer. Chiar si indivizii cu un IMC normal dar cu un raport crescut intre masa adipocitara centrala si periferica sunt insulinorezistenti (30). Studii numeroase au gasit o puternica corelatie intre obezitatea viscerala si scaderea insulinosensibilitatii (31, 54).
4.1. Factori determinanti ai distributiei tesutului adipos
Distributia adipozitatii corporale este consecinta unei combinatii intre factori de mediu si genetici.
4.1.1. Factori genetici
Un studiu efectuat pe familii franceze provenind din Quebec a permis estimarea procentului de variatie fenotipica a adipozitatii corporale ce poate fi atribuit factorilor genetici sau de mediu, raportat la IMC, masa de tesut adipos subcutan si visceral. Efectul genetic nu a fost mai mare de 5% asupra IMC si adipozitatea subcutana. In schimb, 25% din masa adipoasa si din procentul sau din greutatea corporala totala, precum si 56% din adipozitatea viscerala, dupa ajustare pentru varsta, sex si masa totala adipocitara, sunt determinate genetic (45). Un procent similar de determinism genetic (48%) a fost observat de acelasi grup de investigatori in alte familii studiate (47).
Dintre factorii genetici, se pare ca sexul are o amprenta puternica asupra repartitiei corporale a masei adipoase. Aproximativ 20% din tesutul adipos al barbatilor si numai 6% din cel al femeilor aflate in premenopauza este localizat visceral (59). Desi sexul masculin si postmenopauza se insotesc de cresterea grasimii abdominale, sexul singur nu modifica direct relatia obezitatii abdominale cu sensibilitatea la insulina (30).
In ceea ce priveste varsta s-a constatat o scadere a depozitului abdominal subcutan la barbatii obezi dupa 50 ani si o crestere la femeile de peste 60-70 ani (67).
4.1.2. Factorii de mediu
S-a identificat statistic o asociere intre cresterea adipozitatii centrale si unii factori de mediu ca sedentarismul, nivelul socio-economic scazut si stresul psihic asociat, nivelul scazut de educatie. Initierea fumatului este urmata de dezvoltarea obezitatii centrale, proces reversibil dupa renuntarea la fumat. Consumul moderat de alcool se coreleaza negativ cu adipozitatea centrala. Unele medicamente, cum ar fi steroizii sexuali, glucocorticoizii si unele antiretrovirale, cresc masa adipocitara viscerala concomitent cu scaderea celei subcutane. Administrarea de tiazolidindione determina un exces ponderal aparent insotit si de o redistributie a adipozitatii viscerale catre depozitele periferice (59).
4.2. Caracteristici fiziologice dependente de localizare ale adipocitelor
4.2.1. Lipoliza si catecolaminele
Lipoliza, cu eliberarea de acizi grasi (AG) si glicerol, este modulata de sistemul nervos simpatic (SNS), catecolaminele fiind cele mai puternice reglatoare ale lipolizei adipocitare. Acest proces este mediat prin stimularea receptorilor β1 si β2, si prin inhibarea α2 adrenoreceptorilor. Gena ce codifica expresia receptorilor β3 adrenergici este activa predominant in adipocitele omentale, insa este prezenta si in adipocitele din regiunea mamara si subcutana (61). La ambele sexe, independent de gradul obezitatii, adipocitele gluteo-femurale au un raspuns lipolitic scazut la catecolamine comparativ cu cele subcutane abdominale, acestea din urma avand o densitate si o sensibilitate crescuta a β1/ β2 receptorilor asociata cu o reducere a afinitatii si numarului α2 receptorilor (tabel 1) (61). Adipocitele viscerale, spre deosebire de cele localizate subcutan abdominal si femural, au o sensibilitate crescuta la lipoliza mediata de catecolamine, un raspuns scazut la efectul antilipolitic insulinic si o sensibilitate egala (sau usor scazuta) la activarea receptorilor α2 si adenozinici cu rol antilipolitic. Expresia inalt crescuta in adipocitele viscerale a exonului 11 ce codifica o isoforma a receptorului insulinic explica efectul antilipolitic insulinic redus in aceste adipocite, secundar afinitatii scazute a receptorului (59). Raspunsul scazut al IRS-1 contribuie suplimentar la insulinorezistenta si lipoliza crescuta din adipocitele viscerale (52).
La normoponderali, la nivelul depozitul adipos omental exista o relatie directa intre intensitatea lipolizei catecolaminin-mediata si cantitatea de receptori β1/ β2, cu afinitate normala a acestora si raspuns lipolitic normal la agonistii ce intervin in cascada lipolitica postreceptor (61).
La subiectii obezi s-a inregistrat o lipoliza catecolamin-indusa crescuta in regiunea abdominala comparativ cu cea gluteo-femurala. Caracteristicile specifice obezitatii viscerale, 1) actiune lipolitica crescuta a catecolaminelor si 2) raspuns antilipolitic scazut la insulina, se pastraza in obezitate (61). Fluxul crescut in sistemul venos portal de acizi grasi liberi (AGL) de origine viscerala stimuleaza gluconeogeneza si secretia de VLDL, scade clearence-ul hepatic al insulinei, conducand la dislipidemie, hiperinsulinemie si insulinorezistenta.
Tabel 1. Distributia regionala a receptorilor adipocitari catecolaminici la indivizii obezi si normoponderali (adaptat dupa 61)
Tesut adipos omental
Tesut adipos subcutan
nonobezi
obezi
nonobezi
obezi
β1: ↑
β2: ↑
β3: ↑
α2: =
β1: =
β2: =
β3: ↑↑↑
α2: ↓
β1: ↓
β2: ↓
β3: 0
α2: =
β1: =
β2: ↓
β3: 0
α2: =
4.2.2. Produsi de secretie adipocitari
1. Leptina
Expresia ARNm leptinic este mai mare in depozitul adipos subcutanat, secretia leptinica fiind direct corelata cu masa adipoasa din aceasta regiune. Avand in vedere controlul neural al statusului ponderal realizat de acest hormon, se poate spune ca activitatea la nivelul tesutul adipos visceral este mai putin supusa actiunii SNC. Efectul insulinosensibilizant al leptinei la nivel muscular si eliberarea predominent subcutanata a acesteia, in vecinatatea muschilor striati, poate contribui la insulinorezistenta din obezitatea abdominala (59).
2. Angiotensinogen
Studii genetice au identificat o expresie predominanta a ARNm angiotensinogenic in regiunea omentala (13, 59); productia viscerala crescuta de angiotensina II, rezultata din conversia adipocitara a angiotensinogenului, contribuie la hipertensiunea din sindromul dismetabolic (sindromul insulinorezistentei).
3. Glucocorticoizii
Enzima de conversie a cortizonului in cortizol, 11β-hidroxisteroid dehidrogenaza 1, are o activitate crescuta in adipocitele viscerale, hiperexpresia ei determinand obezitate viscerala la soarecii transgenici (59).
4. Proteina de stimulare a acetilarii (ASP)
Tesutul adipos visceral contine de doua ori mai mult ARNm al factorului C3a al complementului (sursa de ASP, vezi capitolul adipocit) decat cel subcutan (13). Astfel, prezenta crescuta a ASP in adipocitele viscerale stimuleaza sinteza trigliceridelor, contrabalansand capacitatea lipolitica ridicata a acestor celule.
5. Proteina de transfer a esterilor de colesterol (CETP )
Nivelul ARNm CETP este dublu in regiunea abdominala subcutana fata de cea omentala (13). Desi nivelul ARNm CETP nu se coreleaza cu secretia enzimei, cantitatea de colesterol si capacitatea de legare a HDL colesterolului este mai mare in adipocitele subcutane (12). Acest fapt sustine rolul CETP in diferentele regionale ale metabolismului colesterolului.
In tabelul 2 sunt prezentate principalele diferente depozit specifice in expresia si/sau secretia factorilor adipocitari, ce pot determina aparitia unor variatii regionale in metabolismul tesutului adipos.
Tabel 2. Diferente dependente de depozit ale concentratiilor produsilor de secretie/expresie adipocitari (adaptat dupa 61)
Produsi de secretie adipocitara
Tesut adipos visceral
Tesut adipos subcutan
Lipoprotein lipaza (LPL)
CETP
ASP
Proteina de legare a retinolului (RBP)
PAI-1
TNFα
IL-6
IGF-1
IGFBP3
Leptina
Adiponectina
Angiotensinogen
Estrogeni
Monobutirina
Produsi exprimati adipocitar:
PPARγ
UCP-1
UCP-2
+ (obezi)
Legenda: ASP= proteina de stimulare a acetilarii, CETP= proteina de transfer a esterilor de colesterol, PAI-1= inhibitorul 1 al activatorului plasminogenului, TNFα= factorul α de necroza tumorala, IL-6= interleukina 6, IGF-1= factorul 1 de crestere insulin-like, IGFBP3= proteina 3 de legare a IGF, PPARγ= receptorulul γ activat al proliferarii peroxizomale, UCP= proteine de decuplare.
4.2.3. Receptori adipocitari
1. Receptorul hormonului de crestere
Este cunoscuta implicarea hormonului de crestere (GH) in reglarea masei adipoase viscerale, acromegalia asociindu-se cu reducerea acestui depozit. Cercetarile privind terapia de substitutie cu GH recombinat au raportat o redistributie a adipozitatii din regiunea viscerala in cea subcutana, insa nu s-a putut demonstra direct o reglare a receptorilor GH in adipocitele umane (61). Se pare ca actiunea GH asupra metabolismului adipocitar necesita un sinergism cu hormonii steroizi (61, 5).
2. Receptorii glucocorticoizi
Exista o scala larga a densitatii acestor receptori la nivel adipocitar, concentratii crescute inregistrandu-se in regiunea viscerala (61). Expunerea la nivele crescute de cortizol (ex. sindromul Cushing) determina reducerea densitatii receptorilor glucocorticoizi, cu pastrarea proportiilor intre diferitele regiuni de tesut adipos; astfel, la un nivel scazut, densitatea receptorilor ramane mai mare in regiunea viscerala comparativ cu cea subcutana, potentand actiunea hormonului in prima localizare (5).
3. Receptorii hormonilor sexuali
Adipocitele au receptori specifici pentru androgeni, cu o densitate inalta la nivel visceral. Administrarea de testosteron induce cresterea numarului receptorilor, in special visceral. La sexul feminin s-a constatat o asociere intre masa adipocitara viscerala si hiperandrogenitate, desi este documentat rolul lipolitic al testosteronului. S-a constatat ca receptorii pentru androgeni din tesutul adipos al femeilor par a avea aceleasi caracteristici ca la barbati. Tratamentul cu estrogeni scade densitatea acestor receptori (down-regulation), in acest mod estrogenii protejand tesutul adipos de efectele hormonilor androgeni. La femeile aflate la menopauza, terapia de substitutie hormonala previne acumularea adipocitelor in regiunea viscerala (61).
In ceea ce priveste progesteronul, se pare ca adipocitele sunt lipsite de ARNm al receptorilor specifici. Acest fapt ce sustine ipoteza ca progesteronul actioneaza indirect prin intermediul receptorilor pentru glucocorticoizi (61).
4. Receptorul adenozinic
Adenozina fiind un puternic agent vasodilatator si lipolitic, poate fi considerata un reglator autocrin atat a lipolizei cat si a insulinosensibilitatii in tesutul adipos uman. Concentratia adenozinei este mai mare in regiunea omentala fata de cea subcutana abdominala, dar inhibitia lipolizei receptor-dependenta este mai redusa in primul depozit (61).
5. Receptorii catecolaminici (vezi lipoliza)
4.3. Metode de estimare a compozitiei corporale si a distributiei tesutului adipos
Masa totala de tesut adipos este dificil de evaluat corect prin metodele uzuale si larg accesibile. In mod obisnuit, tabelele de greutate, IMC, grosimea pliului cutanat in diferite regiuni, circumferinta taliei si raportul talie/sold sunt metode economice, eficace clinic in evaluarea statusului ponderal. Dintre cele patru metode, IMC se coreleaza cu masa adipoasa totala, dar nu indica distributia adipozitatii corporale. Circumferinta taliei se coreleaza cu cantitatea absoluta de tesut adipos visceral (12), o valoare de 103 cm la barbati si 89 cm la femei fiind un prag de la care complicatiile metabolice sunt probabile. O circumferinta a taliei ≥ 94 cm la barbati si ≥ 80 cm femei identifica pacientii cu IMC ≥ 25 Kg/m2sau pacienti cu IMC scazut dar cu raport crescut talie/sold. Valori ale circumferintei taliei ≥ 102 cm la barbati si ≥ 88 la femei se intalnesc la indivizii cu IMC ≥30 Kg/m2 sau cu IMC scazut dar cu cresterea raportului talie/sold (34). Calcularea raportului circumferintei taliei/circumferinta soldului permite o apreciere destul de buna a distributiei masei adipocitare. Pentru viitor, utilizarea mai frecventa in practica clinica a unui nou index, raportul circumferintei taliei/inaltime, se impune deoarece este un bun predictor al morbiditatii (50).
In prezent exista metode noi, unele foarte costisitoare, ce permit stabilirea cu o mare acuratete a cantitatii si distributiei regionale a tesutului adipos (tabel 3). Vom aminti pe scurt utilitatea specifica a catorva dintre acestea.
Tomografia computerizata (CT) este considerata standardul de aur nu numai pentru evaluarea masei grase, ci si pentru masurarea altor compartimente corporale. Distributia viscerala si subcutana a tesutului adipoas poate fi masurata cu o eroare de 1,2% si respectiv 0,5%.
Ultrasonografia este o tehnica imagistica ce permite aprecierea grosimii stratului de tesut adipos intraabdominal.
Impedanta bioelectrica este o metoda care apreciaza rezistenta electrica pe care o opun diferite tesuturi atunci cand sunt strabatute de un curent electric slab. Aceasta tehnica permite determinarea cantitatii totale de tesut adipos deoarece acesta prezinta o conductivitate foarte mica comparativ cu alte tesuturi.
Densitometria masoara proportia de tesut gras din organism, deoarece tesutul adipos are o densitate de numai 0,9 kg/l fata de masa slaba, care este un amestec de apa, proteine si minerale cu densitate de 1,10 kg/l.
Potasiul total al organismului este o tehnica ce permite stabilirea cantitatii de masa grasa, cunoscand ca potasiul continut in masa slaba este de 60 mmol/kg la femeie si 66 mmol/kg la barbat.
Apa totala a organismului. Se stie ca masa slaba a corpului este alcatuita din apa in proportie de 73%, in timp ce tesutul adipos are un procent mult mai mic de apa.
Tabel 3. Metode de estimare a masei totale si repartitiei regionale a tesutului adipos
Metode
Fiabilitate
Acuratete
Aprecierea distributiei regionale a tesutului adipos
Greutatea/ Inaltimea
Pliu cutanat
Circumferinte
Densitometria
-imersie
-pletismografie
Izotopi de potasiu
Impedanta bioelectrica
Gaz liposolubil
Computer tomograf
Ultrasonografia
Rezonanta magnetica
Activarea neutronica
Conductivitatea electrica a corpului
DEXA (dual-energy X-ray scanning)
da
da
da
moderata
scazuta
scazuta
da
scazuta
scazuta
moderata
scazuta
scazuta
moderata
moderata
inalta
scazuta
moderata
inalta
inalta
inalta
moderata
inalta
inalta
moderata
inalta
inalta
inalta
inalta
nu
da
da
nu
nu
nu
nu
nu
da
da
da
nu
nu
da
5. Factorii determinanti ai obezitatii
Determinismul obezitatii este complex si multifactorial, factorii de risc actionand cu intensitate diferita.
5.1. Factori genetici
Studiile familiale si cu gemeni adoptati au furnizat dovezi pentru substratul genetic al obezitatii. Cercetarile genetice epidemiologice sugereaza o variatie importanta in transmiterea obezitatii, intre 10% (studiile asupra persoanelor adoptate) si 80% (studiile pe gemeni). In plus, aceste cercetari au aratat impactul scazut al mediului familial asupra obezitatii (8, 58).
Estimarea genelor implicate in obezitatea umana este complicata deoarece acestea pot avea efecte majore, minore sau poligenice. S-a emis ipoteza ca procentajul transmiterii multifactoriale a obezitatii (genele minore) este cuprins intre 25 - 42%, insa sapte studii sustin ca aceasta variatie este datorata genelor majore (8). Descoperirea a cinci mutatii care conduc la obezitate "spontana" si diabet zaharat la soareci (Ay, db, ob, tub si fat) este o evidenta convingatoare a existentei unei baze genetice a obezitatii (19).
Prevalenta obezitatii este crescuta suplimentar in anumite grupuri etnice datorita obiceiurilor alimentare (preparate alimentare cu continut crescut caloric si scazut vitaminic) si particularitatilor climaterice (sezonul rece prelungit cu reducerea ofertei de fructe si legume) (63).
Urbanizarea, obligatoriu insotita de industrializare, este trasatura definitorie a unei societati predispuse la obezitate. In societatea moderna, excesul ponderal are o prevalenta ingrijoratoare in special in subgrupurile populationale defavorizate social, mai ales la femei. Cauzele? stresul cotidian, lipsa educatiei, alimentatia hipercalorica tip fast-food, consumul crescut de alcool. Mai importanta decat toate insa, pare a fi scaderea gradului de activitate fizica.
Unele tulburari psihologice primare ca patologia anxioasa, depresiva, tulburarile de personalitate, pot constitui factori etiopatogenici ai obezitatii prin inducere de tulburari de comportament alimentar.
5.3. Anomalii de comportament alimentar
Adesea declansate de emotii, stres, anxietate, consum de etanol etc., tulburarile de comportament alimentar cele mai frecvent intalnite sunt:
- gustari interprandiale cu un bogat continut caloric;
- ingestie crescuta si frecventa de dulciuri ("carbohydrate-craving");
- aport alimentar crescut dupa ora 19 ("night-eating");
- episoade de foame exagerata ce conduc la ingestie alimentara crescuta intr-o perioada scurta de timp;
- bulimia;
- hiperfagia;
consum crescut de alcool, care prin aportul caloric (1gram alcool = 7calorii) si stimularea apetitului, actioneaza ca factor obezogen;
5.4. Sedentarismul
Sedentarismul poate fi:
- habitual, indus de lipsa unei culturi sportive, a terenurilor de sport si de progresul tehnic, ce au condus la o diminuare a activitatii fizice, promovand excesul ponderal;
- fortat, datorat unor accidente, handicapuri fizice, imobilizarea postoperatorie etc.
5.5. Factori fiziologici
- sarcina;
- lactatie;
- menopauza.
5.6. Factori endocrini
Unele boli pot accelera castigul ponderal si conduc la dificultati in tratamentul obezitatii.
Hipotiroidismul desi scade rata metabolica si pozitiveaza balanta energetica, rar este cauza unui exces ponderal important; adesea, tratamentul specific bolii nu se insoteste de o scadere ponderala semnificativa.
Obezitatea hipotalamica, secundara unor anomalii structurale ce afecteaza apetitul sau centrii hipotalamici ai satietatii, este extrem de rara (35).
Sindromul Cushing se caracterizeaza prin obezitate centrala si hipercortisolemie. S-a presupus ca tulburari ale cailor neurale si adrenale care regleaza secretia de cortizol contribuie la dezvoltarea adipozitatii centrale (49). Studii recente au evidentiat implicarea unei retele complexe de cai neuroendocrine cuprinzand leptina, neuropeptidul Y, ACRH (hormonul de eliberare a corticotropinei) si a sistemul nervos simpatic (vezi adipocitul).
In sindromul ovarului polichistic (PCOS) si in dismorfismul sexual actiunea steroizilor sexuali endogeni si exogeni poate fi o explicatie a modului de dispunere a tesutului adipos (49). Astfel, PCOS se defineste prin cresterea testosteronului si androstendionului circulant, si scaderea proteinei de legare a hormonilor sexuali, variatii insotite de cresterea adipozitatii centrale si a insulinorezistentei.
5.7. Medicamente
Un numar de medicamente pot modifica balanta energetica favorizand castigul ponderal, fara sa determine un surplus ponderal important (cu exceptia corticoizilor) (35):
- blocanti β adrenergici;
-steroizi (estrogeni, glucocorticoizi etc.);
- unele contraceptive steroidiene;
- antidepresive triciclice (amitriptilina, imipramina etc.);
- antiepileptice (valproat, carbamazepina);
- antipsihotice (haloperidol, clorpromazina etc.);
- antagonisti serotonergici (ciproheptadina, megesterol);
- insulina, sulfonilureice administrate impropriu.
6. Reglarea greutatii corporale
6.1. Reglarea aportului alimentar
Obezitatea este rezultatul unui dezechilibru intre energia de aport (reprezentata de valoarea calorica a alimentelor) si cheltuiala energetica (energia consumata in activitatea fizica, procesele metabolice bazale, termogeneza, prelucrarea alimentelor ingerate: digestia, absortia, transportul si metabolismul lor). Factorii de mediu si genetici (vezi cauzele obezitatii) contribuie si ei la dezvoltarea surplusului ponderal.
Balanta energetica a organismului este reglata atat pe termen scurt (ex. efectele imediate si directe ale alimentelor asupra tractului digestiv) cat si pe termen lung (in scopul mentinerii unei cantitati normale de nutrienti in depozite). Centrii nervosi cu rol in reglarea balantei energetice au fost descrisi initial numai la nivelul hipotalamusului (centrul satietatii si centrul foamei, nucleii din regiunea ventro-mediana si respectiv, nucleii din regiunea laterala), insa ei se intalnesc de la nivelul trunchiului cerebral pana la cortex (ex. nucleul paraventricular, arcuat, amigdala, unele arii ale sistemului limbic) (66). Acesti centri primesc informatii de la nivelul aparatului digestiv si de la depozitele energetice ale organismului prin intermediul unor neurotransmitatori specifici si nespecifici.
6.1.1. Neurotransmitatorii
A. Neuropeptidele
Neuropeptidul Y (NPY- neuropeptide Y) este sintetizat in nucleul arcuat si transportat la nucleul paraventricular unde, prin intermediul unor receptori specifici, stimuleaza aportul alimentar si reduce cheltuielile energetice (66). NPY joaca un rol esential in reglarea pe termen scurt/ lung a balantei energetice. Pentru reglarea pe termen lung se pare ca subtipul Y5 de receptori specifici este tinta moleculara (9). Secretia de NPY este inhibata de leptina, estrogeni, insulina si glucocorticoizi (6, 66). In diabet s-a constatat o crestere a productiei hipotalamice de NPY cu 60%, cu normalizare sub insulinoterapie (6).
Hormonul de concentrare a melaninei (MCH- melanin concentrating hormone) este un peptid care, central stimuleaza aportul alimentar si periferic stimuleaza dezvoltarea celulelor melanofore. Sinteza hormonului este inhibata de leptina prin intermediul NPY si peptidul omolog al proteinei Agouti (AGRP) sau in mod direct (66).
Peptidul omolog al proteinei Agouti (AGRP- Agouti-related protein) are acelasi loc de sinteza, actiune si rol ca si NPY. Sinteza sa este inhibata de leptina, secretia hormonului fiind crescuta in conditii de hipoleptinemie si post alimentar (6). AGRP prin supresia (down-regulation) receptorilor MC4 si MC3 antagonizeaza efectul anorexigen al hormonului α-melanocortinic (α-MSH) (9, 66).
Hormonul α-melanocortinic (α-MSH- α-melanocyte stimulating hormone) este obtinut prin clivajul unui precursor numit proopiomelanocortina (POMC) , sintetizat in nucleul arcuat. Hormonul actioneaza central prin intermediul unor receptori specifici, MC3 si in special MC4. Studii farmacologice au aratat o reducere a apetitului la soareci sub tratament cu agonisti selectivi ai MC4 (9). Mutatii la nivelul genelor umane ce codifica MC4 si POMC s-au asociat cu fenotipul obez (9).
Orexinele A si B (hipocretinele) sunt doua polipeptide sintetizate dintr-un precursor comun la nivelul hipotalamusului lateral, si se leaga cu afinitate diferita de receptori specifici numiti OX1 si OX2 (9). Actioneaza central stimuland aportul alimentar.
Grelina este un peptid secretat in stomac care are ca rol principal stimularea direct hipofizar si indirect (eliberare hipotalamica de GHRH=GH releasing hormon) a secretiei hormonului de crestere (GH) (27). In plus, grelina inhiba apetitul. Pare a interactiona functional cu neuropeptidele prezentate mai sus.
Galanina, sintetizata in nucleii arcuat, paraventricular si dorso-median, exercita un efect orexigen, in special asupra ingestiei de lipide si glucide (9).
Transcriptorul reglat de cocaina si amfetamina (CART-cocaine and amfetamine regulated transcript) a fost identificat initial sub forma unui ARNm a carui expresie este modulata de agenti psihotropi. Neuropeptidul inhiba apetitul indus de NPY (9). Secretia sa este stimulata de leptina (66).
Neuromedinul U (NMU- neuromedin U) are efect anorexic central prin intermediul unor receptori specifici numiti NMU2 (9).
Peptidele opioide stimuleaza ingestia alimentara prin modularea senzatiei de placere indusa de aceasta (66).
Corticotrofina (CRH- corticotropin-releasing hormon) si urocortinul (neuropeptid CRH-like) sintetizati in nucleii paraventriculari, prin actiune la nivelul receptorilor CRF1 si respectiv CRF2 inhiba puternic apetitul (9). La pacientii diabetici exista o reducere cu 30% a CRH, cu normalizare sub insulinoterapie. Leptina stimuleaza sinteza de CRH (6).
Tireotrofina (hormonul de eliberare a tireotropinei-TRH) se pare ca inhiba apetitul si aportul de lichide.
Neurotensina este un peptid anorexigen a carui secretie este stimulata de leptina (66).
Peptidele de tip glucagon ("Glucagon Like Peptid": GLP-1, GLP-2). GLP-1 este sintetizat din proglucagon la nivel pancreatic, intestinal si in creier. Hormonul inhiba apetitul prin mecanism central si intarzie evacuarea gastrica. GLP-2 actioneaza la nivelul centrului satietatii (care exprima receptori GLP-2), inhiband apetitul (9).
Acidul gama-aminobutiric (GABA), produs in unii neuroni hipotalamici, stimuleaza apetitul posibil prin interactiune cu leptina, NPY sau derivatii de POMC (66).
Colecistokinina (CCK) este eliberata post-ingestie alimentara la nivelul tractului gastro-intestinal dar si la nivelul sistemului nervos central, actionand ca puternic stimulator al satietatii. S-a observat o intensificare de catre leptina si insulina a raspunsului anorectic indus de administrarea periferica de CCK (9).
Enterostatina este un peptid produs prin clivajul procolipazei pancreatice, un cofactor al lipazei cu rol in optimizarea digestiei lipidelor. Hormonul reduce selectiv apetitul pentru lipide (27).
B. Monoaminele
Adrenalina si noradrenalina au efect dual la nivelul nucleului paraventricular, stimuleaza si reduc apetitul prin intermediul receptorilor α2 si respectiv α1. Efectul final este dependent de raportul densitatii acestor receptori. La nivelul hipotalamusului median scade apetitul prin legare de receptorii β (66).
Serotonina determina satietate prin blocarea receptorilor 5-HT2c si α2 adrenergici, si stimularea secretiei de CRH.
Dopamina este un inhibitor puternic al aportului alimentar prin actiunea sa la nivelul centrului foamei.
Histamina inhiba apetitul prin legare de receptori specifici la nivelul hipotalamusului, in special in nucleii paraventricular si ventro-median.
6.1.2. Hormoni si citokine
Leptina sintetizata si secretata in principal la nivel adipocitar indeplineste un rol central in reglarea balantei energetice. Reglarea, mecanismele de actiune si efectele hormonului sunt descrise in extenso in subcapitolul "adipocitul".
Insulina are un efect periferic anabolic, stimuland aportul alimentar, si un rol central de inhibare a apetitului. Printre mecanismele sale de actiune au fost descrise: stimularea sintezei leptinei, inhibarea expresiei NPY si a recaptarii neuronale a noradrenalinei, potentarea efectului anorexigen al leptinei (6).
Glucocorticoizii determina reducerea expresiei receptorilor β3 adrenergici si stimuleaza sinteza de leptina la nivel adipocitar. Sinteza glucocorticoizilor este reglata de leptina via CRH (6).
Hormonii sexuali. Ingestia alimentara este stimulata de androgeni si inhibata de estrogeni. Hormonii interactioneaza cu caile de actiune ale NPY, POMC si MCH. Astfel, este posibil ca leptina si hormonii sexuali sa actioneze in acelasi mod pentru reglarea balantei energetice (6).
Citokinele (TNFα, IL-1, IL-6) stimuleaza secretia adipocitara a leptinei, fapt ce explica partial anorexia din inflamatiile cronice. Citokinele determina la nivelul sistemului nervos central inhibarea apetitului si cresterea cheltuielilor energetice (vezi adipocitul).
Factorul neurotrofic ciliar (CNTF- ciliary neurotrophic factor) si Axokina (un peptid CNTF-analog) sunt citokine sintetizate la nivelul SNC ce inhiba apetitul si determina scadere ponderala (9).
6.2. Reglarea cheltuielilor energetice
In timpurile moderne, in care gradul activitatii fizice a scazut considerabil, iar accesul la alimente este practic nelimitat, persistenta mecanismelor de depozitare energetica poate actiona in sensul castigului ponderal si ulterior, al mentinerii lui. Substratul acestui mecanism este termogeneza scazuta (26).
Cheltuiala energetica de repaus este data de: metabolismul bazal, efectul termic al alimentelor (actiunea dinamica specifica a acestora), energia necesara desfasurarii activitatii fizice, procesul de crestere si termogeneza de adaptare la cald si frig.
6.2.1 Metabolismul bazal reprezinta energia necesara mentinerii functiilor vitale si homeostaziei in conditii de repaus absolut: activitate nervoasa, cardiaca, respiratorie, musculara, osmotica, sinteza compusilor organici. Reprezinta cca. 60-75% din cheltuiala energetica zilnica si este determinata in primul rand de masa slaba a corpului. Valoarea metabolismului bazal la adultul normal este de cca. 1 kcal/kg/h , adica 1680 kcal pentru o greutate de 70 kg. O scadere minima in timp a metabolismului bazal poate determina pe termen lung un castig ponderal apreciabil. Odata cu inaintarea in varsta rata metabolismului bazal scade cu 2-3% la fiecare decada, iar necesarul caloric pentru procesul de crestere este redus la 1% din cheltuiala energetica zilnica; ambele dezechilibre favorizeaza excesul ponderal in conditiile pastrarii aceluiasi aport caloric. La persoanele obeze s-a constatat o crestere in termeni absoluti a ratei metabolismului bazal intrucat si masa musculara este mai mare (26). Baza moleculara a randamentului energetic la persoanele obeze ar putea fi legata de un cost mai mic al pompelor ionice care reprezinta principalul consumator de energie al organismului.
6.2.2. Actiunea dinamica specifica a alimentelor reprezinta cantitatea de energie necesara digestiei si absortiei alimentelor, precum si pentru activarea sistemului vegetativ in perioada actului alimentar. Reprezinta 10% din consumul energetic zilnic. In obezitate s-a observat o scadere a efectului termogenic al alimentelor, posibil datorita scaderii activitatii simpatice la nivelul tesutului adipos pe calea unei mutatii transcriptionale a receptorilor β3 adrenergici adipocitari . Acest defect se intalneste la 15% din obezi dar si la normoponderali (26).
6.2.3. Efectul termic al efortului este componenta cea mai variabila a cheltuielilor energetice. La persoanele obeze se presupune ca exista o scadere a energiei necesara desfasurarii activitatii fizice. In plus exista o diminuare a timpului acordat efortului fizic pe masura ce excesul ponderal creste (26).
6.2.4. Termogeneza de adaptare este energia necesara mentinerii constante a temperaturii corpului si este dependenta de arderile desfasurate la nivelul tesutului adipos brun. La acest nivel, proteinele de decuplare (UCP-Uncoupling Proteins), localizate la nivelul membranei interne mitocondriale, realizeaza o decuplare a sintezei de ATP de procesul de oxidare. Energia rezultata din arderea substratelor se disipeaza sub forma de caldura. Activitatea proteinelor decuplante este stimulata pe calea receptorului β3 adrenergic. Stimularea defectiva a acestei caii are implicatii in aparitia obezitatii.
Asa cum reiese din datele prezentate mai sus (sintetizate in fig.1), reglarea aportului si cheltuielilor energetice este realizata de un sistem complex, a carui intelegere completa ne-ar permite selectia unor candidati potriviti pentru tratamentul cu succes al obezitatii.
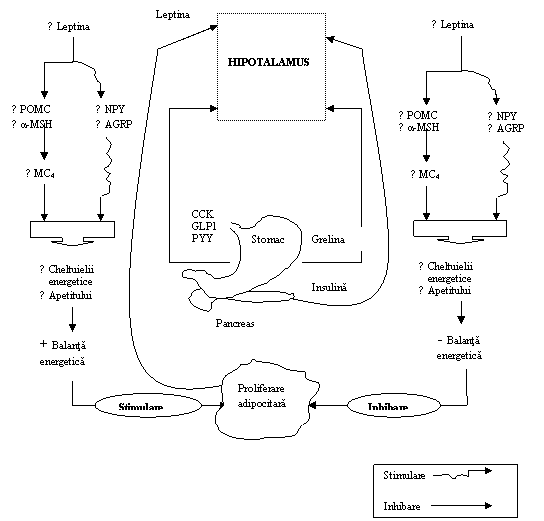
Fig.1. Reglarea neuro-hormonala a greutatii corporale-reprezentare schematica (adaptat dupa 46)
Legenda: POMC= proopiomelanocortina, α-MSH=hormonul α melanocortinic, NPY=neuropeptidul Y, AGRP=peptidul omolog proteinei Agouti, CCK=colecistokinina, GLP-1= peptidul-1 glucagon like, MC4=receptorul-4 melanocortinic, PYY=peptidul YY.
7. Complicatiile obezitatii
Complicatiile obezitatii sunt multiple, fiind afectate in diferite grade aproape toate sistemele si aparatele organismului.
Majoritatea pacientilor nu au simptome specifice excesului ponderal, fiind mimate diferite afectiuni frecvent intalnite in practica medicala. Simptomele, ce se coreleaza atat cu gradul supraponderii cat si cu varsta, se dezvolta adesea insidios alterand calitatea vietii.
Cele mai importante complicatii ale obezitatii pot fi clasificate in functie de mecanismul de aparitie in: mecanice, metabolice si mixte (tabel 4) (3, 35).
Tabel 4. Principalele complicatii medicale ale obezitatii
Complicatii
Mecanice
Complicatii
Metabolice
Complicatii
Mecanice si Metabolice
lumbago
tendinita
osteoporoza
accidente profesionale
incontinenta urinara
intertrigo
edeme/ celulita
dehiscenta plagilor
constipatie
osteoporoza
reflux gastroesofagian
insulinorezistenta
toleranta alterata la glucoza
diabet zaharat
dislipidemie
boli cardiovasculare aterosclerotice
hiperuricemie/ guta
litiaza veziculara
hirsutism
cancer de san, prostata, uter, colon
dismenoree
infertilitate
ovar polichistic
hipertensiune arteriala
insuficienta respiratorie
apnee de somn
insuficienta venoasa cronica
boala hemoroidala
transpiratie excesiva
artroze
osteoartrite
risc anestezic crescut
disgravidie
eclampsie
nastere prematura
In ultimii ani numeroase studii au confirmat relatia obezitatii abdominale (in special viscerala), mai mult decat cresterea masei totale adipoase corporale, cu cateva consecinte morbide a obezitatii (tabel 5) (35). Mecanismul este probabil activitatea lipolitica ridicata a acestui depozit adipocitar, avand drept consecinta cresterea concentratiei de AG liberi in vena porta si a sintezei lipoproteice hepatice. Acest fenomen accelereaza procesul aterosclerotic si insulinorezistenta chiar si la indivizi normoponderali.
Tabel 5. Comorbiditati asociate obezitatii abdominale. Repartitie pe sexe.
Sex feminin
Sex masculin
infarct miocardic si angina pectorala
diabet zaharat tip 2
accident vascular cerebral
cancer uterin
ovar polichistic
dismenoree
hirsutism
litiaza biliara
probleme psihosociale
cardiopatie ischemica
diabet zaharat tip 2
accident vascular cerebral
hipertensiune arteriala
dislipidemie
artroze
ulcer gastro-duodenal
apnee de somn
In continuare sunt prezentate cateva complicatii ale obezitatii, importante din punct de vedere al rasunetului hemodinamic si clinic.
7.1. Complicatii cardiovasculare
Complicatiile cardiovasculare sunt cele mai importante si frecvente la pacientii obezi, datorita atat surplusului ponderal cat si patologiilor asociate (diabet zaharat, dislipidemie etc.).
7.1.1. Hipertensiunea arteriala
S-a constatat ca intre tensiunea arteriala si greutatea corporala exista o relatie cauzala directa, progesiva, dependenta de sex, varsta si rasa, un exces ponderal de 10% insotindu-se de o crestere medie tensionala sistolica cu 6 mmHg. Incidenta HTA este mai mare la femei, rasa neagra si varste sub 55 ani, fiind de trei ori mai mare la indivizii cu surplus ponderal de 10% (56). Studiul Framingham a obiectivat prezenta unui risc dublu a indivizilor hipertensivi de a deveni obezi, sustinand ipoteza unei relatii cauzale in dublu sens. In acelasi timp, studiul Urziceni a pus in evidenta o relatie pozitiva intre IMC si tensiunea arteriala atat sistolica, cat si diastolica (fig.2). Semnificatia fiziopatologica a acestei relatii este discutata in capitolul "Sindromul insulinorezistentei".
Printre factorii implicati in aparitia HTA la pacientii obezi sunt citatati in literatura:
1. Factori centrali
- hiperactivitatea axului hipotalamo-hipofizo-suprarenalian
- hipertonie vasculara simpatica
2. Factori adipocitari
- hipersecretie leptinica
- hipersecretie de angiotensina
- cresterea conversiei cortizonului in cortizol
3. Factori comportamentali si psihologici
- sedentarism
- aport crescut de sare
- stres psiho-social
4. Factori hemodinamici si metabolici
-cresterea retentiei de sodiu in tubul renal distal
- cresterea volumului sanguin
- hiperinsulinemie
- scaderea secretiei factorului natriuretic atrial
- disfunctia endoteliala
- hipoxia
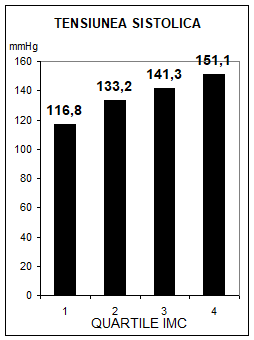
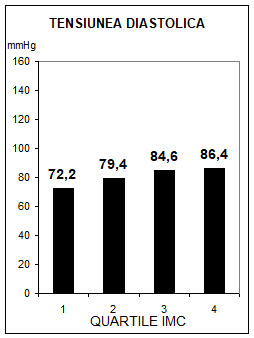
Fig.2 Relatia dintre indicele masei corpului si tensiunea arteriala, asa cum rezulta din studiul Urziceni
7.1.2. Cardiopatia ischemica
Studii numeroase efectuate incepand din anii 60 au certificat o prevalenta crescuta a infarctului miocardic, anginei pectorale si mortii subite la persoanele obeze, dependenta de sex, varsta si tipul de obezitate (24, 42, 55, 65). Studiul Framingham a aratat o relatie lineara intre mortalitatea cardiovasculara si excesul ponderal, acesta din urma fiind un factor de risc independent pentru afectiunile cardiovasculare (24).
Ateroscleroza accelerata, caracteristica pacientilor obezi, este secundara:
- hipersecretiei de citokine proinflamatorii (TNFα, IL-6, IL-1β)
- cresterii concentratiilor plasmatice a factorilor procoagulanti (fibrinogen, PAI-1, factorii VII, VIII si von Wilebrand) in paralel cu scaderea concentratiilor factorilor fibrinolitici
- hiperinsulinismului si insulinorezistentei, secundare excesului de AGL
7.1.3. Insuficienta cardiaca
La persoanele obeze, insuficienta cardiaca este secundara bolilor asociate: HTA, cardiopatia ischemica si insuficienta respiratorie; excesul ponderal creste de doua ori riscul de insuficienta cardiaca, predominent la sexul masculin.
Excesul ponderal determina cresterea debitului cardiac (prin cresterea volumului de ejectie sistolic) si expansiune volemica, conducand la hipertrofia si dilatatia ventricului stang cu aparitia unui tablou de insuficienta cardiaca stanga (20). Hipertrofia ventriculara stanga se insoteste de agravarea ischemiei miocardice si cresterea frecventei/gravitatii tulburarilor de ritm, si implicit a mortii subite.
Insuficienta respiratorie, intalnita adesea in obezitate, poate determina hipertensiune pulmonara si insuficienta cardiaca dreapta.
7.1.4. Moartea subita
Studii epidemiologice (24) au obiectivat o incidenta crescuta a mortii subite in obezitate, de cinci ori mai mare decat la normoponderali. Moartea subita poate fi o consecinta a bolii aterosclerotice sau a aritmiilor. Mecanismul de aparitie a aritmiilor fatale este hiperactivitatea simpatica, marimea ventricului stang fiind cel mai bun marker clinic de identificare a persoanelor cu risc aritmic (48).
7.2. Accidente vasculare cerebrale (AVC)
Obezitatea, in special abdominala, dubleaza riscul de aparitie a AVC printr-un mecanism necunoscut, posibil datorita unei anomalii a sistemului fibrinolitic. Studii recente au aratat ca excesul ponderal este factor predictiv pentru AVC ischemic, dar nu si pentru cel hemoragic (44). Prevalenta trombozei cerebrale si hemoragiilor meningiene este mai mare la obezi, independent de valorile tensiunii arteriale.
7.3. Insuficienta venoasa cronica
S-a constatat ca peste 30% din indivizii obezi prezinta insuficienta venoasa in diferite stadii. Mecanismele de aparitie constau in:
- alungirea venelor de drenaj, ce conduce secundar la scaderea vitezei de intoarcere venoasa si staza
- vasodilatatie difuza, accentuand staza
- scaderea presiunii negative intratoracice, prin excesul de grasime viscerala, ce impiedica intoarcerea venoasa
- compresia venelor intraabdominale (iliace, cava, pelvina) prin excesul de grasime viscerala
- sedentarismul, asociat anomaliilor hormonale secundare obezitatii, determina ineficienta pompei musculare cu reducerea presiunii de intoarcere venoasa
- concentratia crescuta a unor factori procoagulanti (fibrinogen, factor VII, VIII, von Wilebrand) asociata scaderii activitatii fibrinolitice (prin cresterea PAI-1).
Obezitatea este un important factor de risc atat pentru tromboza profunda cat si pentru trombembolismul pulmonar, studii necroptice gasind un risc de embolie pulmonara de 1,5-2 ori mai mare la obezi comparativ cu normoponderali (11).
7.4. Complicatii osteo-articulare
Exista doua categorii de factori ce determina aparitia complicatiilor osteo-articulare la pacientii obezi (17):
- factori locali: deformari articulare, leziuni articulare preexistente, microtraumatisme
- factori sistemici: varsta, sex, rasa, factori genetici, densitatea osoasa, anomalii metabolice asociate.
Patologia ceea mai frecvent intalnita este reprezentata de gonartroza, coxartroza si sindromul trofostatic din post-menopauza.
7.5. Diabetul zaharat tip 2 (T2DM)
7.5.1. Asocierea obezitate-diabet zaharat
In 1971, West si Kalfleish au raportat o puternica corelatie intre greutatea corporala si prevalenta diabetului zaharat (T2DM) intr-un studiu ce a cuprins zece populatii diferite de pe tot cuprinsul globului (63). O asociere similara a fost descrisa incepand din 1921 de Joslin (29). La noi in tara, un studiu publicat in 1976 de noi, a obiectivat prezenta obezitatii la 85% din pacientii cu T2DM (25). Date epidemiologice au aratat ca atat obezitatea cat si T2DM au o prevalenta mai mare in tarile dezvoltate comparativ cu cele cu un nivel socio-economic scazut, sugerand rolul alimentatiei si stilului de viata in fiziopatologia celor doua boli. Rezultate recente (33) indica o importanta speciala a cantitatii de grasimi saturate din dieta, supraalimentarea cu aceste principii nutritive conducand la insulinorezistenta si dislipidemie. Astfel, prevalenta T2DM se coreleaza pozitiv cu aportul energetic derivat din acizii grasi saturati furnizati de alimente (33). Insulinorezistenta indusa de grasimile saturate este secundara modificarilor produse in compozitia fosfolipidelor membranare, a semnalului insulinic si inhibarii sintezei de glicogen.
In acelasi mediu, in anumite grupuri etnice exista o prevalenta crescuta a obezitatii si T2DM, fapt ce indica o baza genetica a relatiei dintre cele doua afectiuni.
In 1956, Vague a sugerat ca obezitatea centrala este mai frecvent intalnita in diabetul zaharat tip 2. Aceasta constatare a fost confirmata de Feldman si colab. (16), utilizand diferite metode de apreciere a distributiei tesutului adipos. Intr-un studiu ce a cuprins 30000 de femei, Hartz si colab. au raportat o prevalenta crescuta a T2DM la subiectii cu distributie predominant abdominala a tesutului gras, independent de gradul obezitatii (22). In afara acestui studiu intrapopulational, West a raportat o incidenta crescuta a obezitatii abdominale la indienii Plains din Oklahomma, o populatie cunoscuta cu o prevalenta crescuta a T2DM, comparativ cu caucazienii din U.S.A., ce au o prevalenta scazuta a bolii diabetice tip 2 (64).
Desi datele de mai sus sustin existenta unei relatii stranse intre obezitate si diabet, o serie de studii au aratat ca obezitatea nu este necesara si nici suficienta pentru aparitia diabetului zaharat tip 2. In primul rand, exista un fenotip de T2DM fara exces ponderal. In al doilea rand, exista populatii cu o prevalenta crescuta a excesului ponderal dar scazuta a T2DM. In al treilea rand, in majoritatea populatiilor obezitatea este mai frecventa in randul femeilor, in timp ce prevalenta T2DM nu difera intre sexe. In sfarsit si cel mai important, in toate populatiile majoritatea indivizilor care sunt obezi nu au diabet. In S. U. A. 50% din persoanele adulte sunt obeze, dar mai putin de 10% din populatie au T2DM. La indienii Pima si populatia caucaziana asocierea obezitatii cu diabetul zaharat este influentata de ereditatea diabetica (32).
Studiile incrucisate (cross-sectional) nu au stabilit daca intre obezitate si diabet exista o relatie cauzala, sau un factor comun care le determina pe amandoua. Studii longitudinale si prospective au furnizat unele dovezi cu privire la rolul direct al obezitatii in patogenia diabetului zaharat.
7.5.2. Obezitatea, factor de risc pentru T2DM
Rolul obezitatii ca factor de risc pentru diabetul zaharat tip 2 a fost demonstrat de numeroase studii prospective ce au cuprins populatiile caucaziene din Norvegia, Suedia, Israel si S.U.A., mexicanii din Texas-S.U.A. si indienii Pima. In alte doua studii populationale, desfasurate in Israel si asupra indienilor Pima (15, 41), s-a constatat ca durata si gradul obezitatii sunt factori de risc pentru T2DM. In grupul indienilor Pima riscul de T2DM este dublu la indivizii cu istoric de obezitate de 10 ani sau peste aceasta durata comparativ cu cei cu istoric mai mic de 5 ani (15). Datele noastre (1976) au demonstrat o relatie pozitiva intre vechimea excesului ponderal si aparitia T2DM (fig.1), sustinand rolul diabetogen al excesului ponderal. In studiul Urziceni, relatia dintre IMC / insulinorezistenta si valoarea glicemica a fost directa si proportionala (fig.2)

Fig.3. Raportul intre vechimea excesului ponderal si rata de aparitie a T2DM, dupa Ionescu-Tirgoviste si colab. (25)
(a)
 (b)
(b)
Fig.4 Relatia intre indicele masei corpului si glicemie (a), respectiv insulinorezistenta (b), apreciata prin indicele HOMA-IR, asa cum rezulta din studiul Urziceni.
Distributia centrala a adipozitatii corporale este factor major de risc pentru diabetul tip 2, independent de gradul obezitatii, ipoteza demonstrata de studiile prospective efectuate pe populatiile din Suedia, Japonia si indienii Pima (38, 43).
Atat obezitatea cat si distributia sa viscerala nu sunt singurii factori predictori ai bolii diabetice. Studiile prospective asupra indienilor Pima si asupra altor populatii au aratat ca obezitatea si defectele de secretie/ actiune ale insulinei predispun la diabet, dar au oferit putine informatii cu privire la durata acestor anomalii si a modului lor de interactiune. In grupul indienilor Pima, date longitudinale pe cinci ani au indicat asocierea tranzitiei la toleranta anormala la glucoza cu: cresterea greutatii corporale, scaderea secretiei si actiunii insulinei. Nu s-au observat modificari in productia hepatica de glucoza. Accentuarea surplusului ponderal si a defectului de secretie/ actiune a insulinei, precum si cresterea productiei hepatice de glucoza caracterizeaza progresia tolerantei anormale la glucoza (IGT) la diabet.
7.5.3. Obezitatea si secretia de insulina
a. Acizii grasi liberi. Este cunoscuta asocierea obezitatii atat cu cresterea masei adipoase cat si a concentratiei acizilor grasi liberi (AGL) (lipoliza accelerata). AGL servesc ca sursa de energie pentru majoritatea tesuturilor, fiind esentiali in homeostazia energetica a organismului datorita rolului-semnal intr-o varietate de procese celulare. Este bine documentat rolul acizilor grasi de a intensifica raspunsul pancreasului la numeroase substante insulino-secretoare. Insa, cercetari recente (7) au aratat o deteriorare a functiei β celulare prin expunerea cronica a pancreasului la concentratii excesive de AGL. In studii pe sobolani, infuzia lipidica prelungita are o influenta bifazica asupra secretiei insulinice (7). Astfel, dupa 3 ore se constata o stimulare a insulinosecretiei indusa de glucoza, pentru ca la 48 ore de la inceperea infuziei lipidice sa se inregistreze o scadere marcata a secretiei insulinice. Efectul inhibitor al infuziei lipidice numai asupra insulinosecretiei indusa de glucoza s-a insotit de scaderea oxidarii glucozei, si pare a fi dependent de nivelul oxidarii acizilor grasi (7). Ipoteza β lipotoxicitatii (termen folosit de Unger in 1995) a fost sustinuta in studii in vitro cu privire la efectul troglitazonei in insulele prelevate de la sobolanii ZDF ("Zucker Diabetic Fatty") (51). Aceste rozatoare aveau hiperglicemie cu anomalii semnificative ale procesulului de insulinosecretie, tulburari metabolice atribuite unei cresteri de 50 ori a continutului de trigliceride β insular comparativ cu lotul control nediabetic. Efectul inhibitor al trigliceridelor a fost confirmat prin imbunatatirea insulinosecretiei dupa incubare cu troglitazona (care a redus continutul trigliceridelor).
Mecanismele posibile implicate in aparitia lipotoxicitatii sunt (36):
- scaderea expresiei glucokinazei si GLUT-2, cu reducerea secundara a sensibilitatii celulei β la nivelele glicemice;
- scaderea oxidarii glucozei via unui efect "Randle-like". Alte studii (23, 37) insa, au obiectivat o reducere nesemnificativa a oxidarii glucozei la nivel β celular si o crestere a utilizarii glucozei cu sinteza de ATP.
- activarea directa a canalelor de K+-ATP dependente;
- inhibarea (down-regulation) PKC sau a isoformelor sale;
- stimularea sintezei de UCP-2;
- inductia stresului oxidativ;
- excesul de AG neoxidati induc formarea de oxid nitric, IL-1β (interleukina-1β) si ceramide, responsabile de apoptoza accelerata a celulelor β.
In plus, expunerea cronica la AGL scade expresia genei insulinei, si biosinteza insulinei prin mecanisme nucleare (14).
Se pare ca majoritatea mecanismelor lipotoxice descrise sunt datorate mai mult procesului de esterificare a AG decat oxidarii lor. De exemplu, in insulele de sobolani, reducerea concentratiei ARNm insulinic indusa de palmitat este modulata de esterificarea acizilor grasi la nivele crescute de glucoza.
In cercetarile pe subiecti umani rezultatele sunt controversate, unii experimentatori demonstrand un defect insulinosecretor indus de nivelele cronic crescute de AGL, in timp ce alte grupuri au raportat o crestere a secretiei insulinice in aceleasi conditii.
Boden si colab. au gasit o crestere absoluta a secretiei insulinice in timpul a 48 ore de clamp hiperglicemic efectuat simultan cu administrarea iv. de Intralipid si heparina. De mentionat ca nu s-a raportat nivelul secretiei insulinice la insulinorezistenta (IR) indusa de infuzia lipidica (36).
La o concluzie diferita au ajuns Paolisano si colab. (36), acestia raportand o scadere absoluta a raspunsului insulinic la glucoza dupa 24 de ore de concentratie crescuta de AGL, proces reversibil, sugerand un defect functional.
Ambele grupuri de cercetatori au obtinut o crestere cu 50% a fazei precoce a secretiei insulinice in timpul testului de toleranta la glucoza, la pacientii cu T2DM la care s-a administrat Acipimox pentru reducerea nivelului AGL.
Lewis si colab. au evaluat secretia insulinica stimulata de glucoza la barbati normoponderali, nondiabetici, in conditiile unui nivel plasmatic dublu al acizilor grasi indus de infuzia iv. de Intralipid si heparina (36). S-a constat ca un nivel acut crescut de AGL timp de 1,5 ore inainte de clampul hiperglicemic conduce la cresterea raspunsului insulinic la glucoza si reducerea insulinosensibilitatii (IS), fara afectarea indexului de distributie (Disposition Index, DI= secretia de insulina x sensibilitatea la insulina). Dupa 48 ore de expunere a celulei β la concentratii crescute de acizi grasi s-a inregistrat insa o scadere marcata a secretiei insulinice si a IS, cu reducerea secundara a DI. Prin urmare, celula β reuseste sa compenseze in conditii acute scaderea IS indusa de excesul de AGL, in timp ce expunerea cronica la AGL in exces o face incapabila sa-si adapteze capacitatea insulino-secretorie la scaderea sensibilitatii la insulina.
Aceiasi cercetatori au descris o reducere masiva a secretiei insulinice indusa de concentratii cronic crescute de AGL la pacientii obezi nediabetici.
Efectul insulinotropic marcat al AGL observat in toate aceste studii a ridicat intrebarea: toti acizii grasi contribuie egal la acest efect? Potenta insulinotropica individuala a acizilor grasi a fost examinata la sobolani in conditii de post (57), constatatandu-se o crestere dramatica a raspunsului insulinic la glucoza sub infuzie de acizi grasi cu lant lung si grad mare de saturare. In acelasi sens, alti cercetatori au raportat, in contextul unor valori glicemice mari, o scadere absoluta a secretiei insulinice prin administrare de oleat/ heparina sau heparina/ Intralipid (uleiul de soia fiind principalul constituent), acizi grasi cu grad ridicat de nesaturare (36). Efectul este mai pronuntat pentru oleat comparativ cu Intralipid. La valori glicemice scazute atat oleatul cat si Intralipid-ul cresc insulinosecretia.
In sfarsit, exista evidente obtinute de la soarecii transgenici ce exprima amiloid insular uman care atesta o asociere a consumului crescut de grasimi alimentare cu dezvoltarea disfunctiei β celulare, relatie mediata de depunerea insulara de amiloid (7).
Mecanismul lipotoxicitatii β celulare este expus pe larg in subcapitolul "celula β pancreatica".
b. Alti produsii de secretie adipocitari
Leptina. Concentratia leptinei creste proportional cu gradul obezitatii atat la oameni cat si la animale. Hormonul scade eliberarea bazala si stimulata a insulinei prin mecanisme biochimice diferite, printre care un rol central il ocupa inhibarea complexului fosfolipaza C / PKC (vezi adipocitul).
TNFα, IL-1, IL-6. Implicarea citokinelor in disfunctia insulinosecretorie pancreatica este mediata de productia crescuta de oxid nitric, cu efect supresiv mitocondrial.
Adiponectina constituie un valoros indicator al potentialului diabetogen al obezitatii. Scaderea concentratiei sale plasmatice coreleaza strans cu evolutia catre T2DM.
7.5.4. Obezitatea si insulinorezistenta
Relatia dintre gradul obezitatii si actiunea in vivo a insulinei a fost intens cercetata atat la oameni cat si la animale. Utilizandu-se tehnica clampului euglicemic-hiperinsulinemic s-a putut studia relatia obezitate-insulinosensibilitate la indienii Pima nediabetici (28). In combinatie cu calorimetria indirecta, aceasta tehnica a permis evaluarea preluarii tisulare a glucozei mediata de insulina (in special la nivel muscular), precum si a celor doua componente, oxidativa si nonoxidativa (sinteza de glicogen), ale metabolismului glucidic. Astfel, s-a constatat o asociere negativa nonlineara intre gradul obezitatii si actiunea in vivo a insulinei, in conditiile unor concentratii fiziologice de insulina. La nivele maximale insulinice induse s-a inregistrat o relatie negativa lineara semnificativa intre actiunea insulinei si gradul obezitatii. Este necesar de subliniat ca la acest grup populational adipozitatea explica aproximativ 36% si 15% din variatia actiunii insulinice la concentratii fiziologice insulinemice, si respectiv la nivele maximale stimulate ale insulinemiei. O parte din diferentele in preluarea tisulara a glucozei insulin-mediata pot fi explicate si de tipul distributiei tesutului adipos.
Intr-un studiu prospectiv ce a cuprins subiecti predispusi la T2DM, obezitatea reduce actiunea insulinei intr-o mai mare masura decat la subiectii fara aceasta predispozitie genetica (40). Pornind de la acest rezultat se poate afirma ca obezitatea potenteaza efectul genelor diabetogene asupra actiunii insulinei.
Pacientii cu obezitate centrala sunt mai insulinorezistenti decat cei cu obezitate gluteofemurala, cantitatea de glucoza preluata de tesuturile periferice corelandu-se negativ cu masa adipocitelor intraabdominale. Explicatia consta in particularitatile metabolice ale adipozitatii centrale (vezi tipurile de tesut adipos). Aditional, pacientii cu obezitate centrala au un numar crescut de fibre musculare albe cu un numar scazut de capilare in muschiul scheletic (21).
O serie de factori au fost propusi pentru a explica relatia obezitate-insulinorezistenta, printre acestia aflandu-se AGL, TNFα, IL-6, leptina, adiponectina etc.
a. Acizii grasi liberi (AGL)
Insuliorezistenta in muschiul scheletic. Randle si colab. au fost primii care au emis ipoteza insulinorezistentei musculare induse de concentratii crescute de AGL, proces mediat de oxidarea predominanta a AG. Boden si colab. (28) au investigat potentialul mecanism prin care nivelele crescute de AGL inhiba preluarea tisulara a glucozei insulin-mediata, atat la indivizii sanatosi cat si la cei cu T2DM. La subiectii sanatosi s-a constatat o inhibare a oxidarii carbohidratilor dupa o ora de infuzie lipidica in conditiile clampului euglicemic-hiperinsulinemic. Dupa 2-3 ore preluarea glucozei insulin-mediata s-a redus semnificativ, inhibarea oxidarii glucozei nefiind probabil singurul mecanism responsabil. La pacientii cu T2DM scaderea preluarii glucozei insulin-mediata, aparuta dupa 3-4 ore de infuzie lipidica, s-a insotit de o inhibitie proportionala a glicolizei si sintezei de glicogen. Alte studii ulterioare au demonstrat ca inhibarea preluarii tisulare a glucozei insulin-mediata determinata de nivelele crescute de AGL se datoreaza in special unui defect de fosforilare/ transport al glucozei decat unei anomalii in sinteza de glicogen (28).
Ellis si colab. (14) au raportat o puternica corelatie negativa intre insulinosensibilitate si cantitatea de acizi grasi cu lant lung dispusi intramiocitar. Explicatia poate fi existenta unui exces lipidic intramuscular sau/ si inhibarea oxidarii mitocondriale a acizilor grasi la nivelul carnitin palmitoil transferazei 1 (CPT 1), enzima responsabila de transferul in mitocondrie al derivatilor acil-CoA.
Concentratia crescuta de acizi grasi intramiocitari, secundara excesului de AGL, determina prin esterificare la diacilglicerol, si posibil in mod direct, activarea protein kinazei C (PKC) (36). In muschiul scheletic al sobolanilor infuzia de Intralipid / heparina determina activarea isoformei θ a PKC. Inactivarea PKC θ la soarecii transgenici previne anomaliile in actiunea insulinei induse de excesul de AG (14). Activarea PKC conduce la fosforilarea resturilor de serina/ treonina ale substratului-1 al receptorului insulinic (IRS-1), cu inactivarea secundara a fosfatidil inozitol-3 Kinazei (PI3K). Rezultatul final este disparitia stimulului pentru translocarea GLUT-4 la suprafata celulara avand drept consecinta reducerea preluarii musculare a glucozei (fig.3). Este posibil ca acizii grasi intramiocitari sa afecteze translocarea GLUT-4 si prin acilarea proteinelor implicate in procesul de fuziune membranara (53). S-a demonstrat si un efect inhibitor direct al PKC asupra sintezei de glicogen (2).

Fig.5. Semnalizarea insulinica la nivel miocitar in prezenta / absenta nivelelor crescute de acizi grasi (adaptat dupa 39)
Legenda: I= insulina, Ir= receptor insulina, IRS-1= substratul 1 al receptorului insulinic, T= resturi de tirozina, S= resturi de serina, P= fosforilare, PKCθ= isoforma θ a protein kinazei C, DAG= diacilglicerol, LCACoA= esteri CoA ai acizilor grasi cu lant lung (long chain acyl-CoA), AGL= acizi grasi liberi, GLUT-4= transportor al glucozei, PI3K= fosfatidil inozitol-3 kinaza.
Un alt mecanism prin care concentratiile crescute de AGL induc insulinorezistenta musculara implica calea hexozaminica, asa cum descriu unii cercetatori (36). Productia de hexozamine este stimulata de preluarea miocitara crescuta a glucozei in conditii de hiperglicemie si hiperinsulinemie. Acizii grasi inhiba fosfofructokinaza-1 (PFK-1), stimuland productia hexozaminica prin cresterea nivelelor de fructozo-6-fosfat. Mecanismul biochimic care leaga calea hexozaminica de insulinorezistenta nu este cunoscut Este posibil ca UDP-N-acetil- glucozamina (un produs final al caii), prin glicozilare si stabilizarea unor factori de transcriptie, sa regleze expresia unor gene implicate in controlul sintezei de glicogen.
Stresul oxidativ poate fi un alt element ce mediaza relatia insulinorezistenta musculara-AGL. Acizii grasi pot stimula formarea de specii reactive de oxigen (ROS-reactive oxygen species) 1) direct prin reactii de peroxidare si productie mitocondriala, si 2) indirect via caii hexozaminice (36). ROS sunt implicate in insulinorezistenta prin afectarea expresiei unor gene si a semnalelor de transductie, prin intermediul unor modificari redox la nivelul unor molecule critice. Stresului oxidativ, indus de concentratiile crescute de AGL, determina si activarea PKC, via activarii unei serin/treonin kinaze (IKK-β), inhiband in acest mod fosforilarea resturilor tirozinice ale receptorului insulinic si IRS-1. Rezultatul este inactivarea IRS-1 cu blocarea semnalizarii insulinice.
Atat direct, prin legare de PPAR, cat si indirect, prin activarea cailor semnal descrise anterior, acizii grasi modifica expresia unor gene implicate in oxidarea lor mitocondriala si peroxizomala. Structura AG moduleaza nivelul de activare a receptorilor nucleari; astfel, acizii grasi omega 3, prin activarea preferentiala a PPAR, sunt asociati cu insulinosensibilitate crescuta si depozite intramiocitare lipidice reduse.
In concluzie, se poate afirma ca exista o relatie bifazica intre metabolismul miocitar al AG si etiologia T2DM. Este posibil ca in stadiile precoce subclinice ale diabetului, la nivele relativ normale plasmatice ale VLDL si AGL, in miocit sa existe un defect de oxidare a acizilor grasi, posibil datorita unei disfunctii a axului ACC/CPT 1. Rezultatul este acumularea graduala in miocit de acizi grasi cu lant lung si scaderea insulinosensibilitatii. Ulterior, in paralel cu declinul insulinosecretiei si cresterea cronica a concentratiilor VLDL si AGL, nivelele miocitare de acizi grasi ating un punct critic ce compenseaza inhibitia CPT 1, cu accelerarea β oxidarii mitocondriale. Din acest moment ciclul Randle se activeaza si exacerbeaza insulinorezistenta.
Insulinorezistenta hepatica. Cresterea concentratiei de AGL, in special in obezitatea viscerala, determina initial o expresie hepatica crescuta a receptorilor SREBP-1c (Sterol Regulatory Binding Protein-1c) cu stimularea secundara a enzimelor lipogenice si cresterea nivelului de malonil-CoA. In aceste conditii, la nivel hepatocitar este inhibata degradarea oxidativa a acizilor grasi, via inhibitiei CPT 1 malonil-CoA mediata, cu cresterea productiei de trigliceride si a secretiei hepatice de VLDL, ce accentueaza hiperlipemia (39). Continutul hepatocitar ridicat de acizi grasi activeaza PKC (in special isoformele β si δ) conducand la inhibarea activitatii glicogen sintetazei si anomalii ale caii semnal insulinice (36). Ulterior, cand nivelul intracelular de AG atinge un anumit nivel, se produce derepresarea CPT 1 (reglare feedback negativa a nivelului malonil-CoA) cu stimularea βoxidarii acizilor grasi si secundar a gluconeogenezei hepatice (piruvat carboxiliaza, o enzima cheie a gluconeogenezei, are ca efector alosteric pozitiv acetil-CoA). Efectul final este accentuarea insulinorezistentei hepatice.
Ca si in muschiul scheletic, la nivel hepatocitar AG moduleaza expresia unor gene ce codifica enzime cheie ale gluconeogenezei si catabolismului lipidic prin activarea receptorilor PPARα (39). In acest mod, reglarea activitatii PEPCK (fosfoenolpiruvat carboxi-kinaza) si glucozo-6-fosfatazei creste rata productiei hepatice de glucoza si astfel, gradul insulinorezistentei. Se pare ca efectul principal al activarii PPAR este ameliorarea insulinosensibilitatii prin limitarea depozitului lipidic hepatic.
b. Alti produsi de secretie adipocitara (vezi adipocitul)
TNFα, IL-6. La nivel adipocitar citokinele, avand concentratii crescute in obezitate, au efect catabolic intens, cu cresterea nivelului AGL. Acest efect in asociere cu stimularea productiei si secretiei hepatice de trigliceride explica insulinorezistenta indusa de citokine.
Adiponectina. Nivelele scazute de adiponectina inregistrate la pacientii obezi si la rudele gr.1 ale pacientilor cu T2DM au o relatie negativa cu insulinosensibilitatea, prin scaderea fosforilarii receptorului insulinic si a lipooxidarii musculare.
Rezistina. Un alt candidat adipocitar implicat in inulinorezistenta este rezistina, asa cum sugereaza unele studii pe animale cu obezitate indusa genetic sau de aport. Datele obtinute din cercetari pe subiecti umani sunt contradictorii, unii experimentatori neevidentiind diferente intre pacientii insulinorezistenti si cei sanatosi.
Fractiunea C3 al complementului. S-au raportat o asociere a concentratiilor ridicate ale acestei proteine sintetizate adipocitar cu obezitatea si T2DM. O relatie negativa intre nivelele plasmatice ale fractiunii C3 a complementului si insulinosensibilitate s-a descris la indienii Pima (28).
Proteina agouti. Cresterea concentratiilor intracelulare de Ca2+ liber poate fi cheia care leaga insulinorezistenta de proteina agouti, produsa in exces in obezitate
c. Anomalii hemodinamice
Obezitatea, in special asociata diabetului zaharat tip 2, se insoteste de scaderea densitatii capilare la nivelul muschiului scheletic asociata cu reducerea proportiei de fibre musculare tip 1 si anomalii in transportul endotelial de insulina si a vasodilatatiei insulinmediate (4). Aceste modificari favorizeaza instalarea insulinorezistentei musculare.
d. Anomalii genetice
Este posibil ca inhibarea sintezei de glicogen si cresterea continutului lipidic intracelular sa fie determinate si de o selectie "naturala" evolutiva a unor gene ce constituie asa numitul genotip "economicos" (thrifty genotype) (33). Consecinta acestei selectii genetice este scaderea insulinosensibilitatii musculare, cu rol protector in perioadele de aport alimentar scazut. In conditiile actuale , cand supraalimentarea este un comportament alimentar frecvent, aceasta selectie genetica se coreleaza pozitiv cu obezitatea si T2DM. Printre componentele genotipului "economicos" au fost citate genele ce codifica glicogen sintetaza, proteine din cascada-semnal insulinica (ex. GLUT-1) si peptide ce regleaza apetitul (ex. leptina).
7.5.5. Obezitatea si sistemul nervos
Studii pe subiecti umani au demonstrat rolul sistemului nervos autonom in metabolismul glucozei si insulinei. La pacientii obezi cu o dieta hipocalorica s-a observat o reducere a ritmului scaderii ponderale asociata cu scaderea activitatii sistemului nervos simpatic (SNS). SNS moduleaza homeostazia energetica a organismului prin cresterea ratei metabolismului bazal, a activitatii fizice spontane si a actiunii dinamice specifice a alimentelor; in plus, activitatea SNS se coreleaza pozitiv cu rata lipooxidarii (28). Prin mecanismele descrise scaderea activitatii SNS contribuie la dezvoltarea obezitatii si a T2DM.
Insulinosecretia este modulata de sistemul nervos simpatic (stimulare) si parasimpatic (inhibare), asa cum au aratat o serie de date experimentale. Nervii vegetativi par a fi implicati in faza precoce a insulinosecretiei (28).
Desi mecanismele tulburarilor metabolice (fig.4) implicate in patogenia T2DM la pacientii obezi sunt partial descifrate, ramane subiect de dezbatere daca insulinorezistenta (IR) sau disfunctia β celulara constituie defectul primar, deoarece ambele anomalii sunt greu de evaluat independent. Punctul nostru de vedere este urmatorul: diabetul zaharat tip 2 ca tulburare complexa a metabolismului energetic al organismului se dezvolta progresiv, parcurgand mai multe spirale diabetogene. Intr-o prima etapa, insulinorezistenta musculara deviaza fluxurile metabolice de la muschi (principalul consumator de glucoza) catre alte sectoare celulare. Intrucat functia primordiala a adipocitului este aceea de a depozita trigliceride, hiperinsulinismul, indus de insulinorezistenta musculara si discreta hiperglicemie ocazionata de scaderea captarii glucozei in muschi, va realiza o conditie ideala pentru expansiunea tesutului adipos. Aceasta expansiune (castigul ponderal poate depasi uneori 5 Kg/an) nu ar fi posibila daca adipocitul nu ar fi sensibil la insulina.
Rolul diabetogen al excesului ponderal survine puternic pe o a doua spirala diabetogena, cand masa adipocitara mult expansionata (in special in teritoriul abdominal, cu drenaj portal) va declansa un dublu mecanism diabetogen: 1) primul este acela de producere a adipokinelor care accentueaza insulinorezistenta deja prezenta in unele tesuturi (tesutul muscular, dar posibil si in alte celule). AGL crescuti in circulatia portala vor conduce la depozitarea excesiva a trigliceridelor in hepatocite ("ficatul cu incarcare grasa"), stimuland in plus neoglucogeneza si cresterea debitului hepatic de glucoza cu efect hiperglicemiant; 2) al doilea este acela al suprasolicitarii mari si prelungite a aparatului secretant β celular care trebuie pe de o parte sa invinga insulinorezistenta musculara si hepatica, iar pe de alta sa secrete un exces de insulina pentru masa adipoasa suplimentara, care poate depasi 30% din masa tisulara initiala (din perioada normoponderala). In fine, dereglarile metabolice profunde gluco-lipidice din principalele tesuturi consumatoare de energie, vor avea efecte negative asupra insulinosecretiei, afectata prin mecanismul mentionat al gluco/ hepatotoxicitatii.
In aceste conditii, devine clar ca procentul obezilor care vor deveni diabetici (cca. 30% dintre ei) va fi reprezentat de subgrupul care mosteneste o capacitate insulinosecretorie β celulara scazuta sau cu potential mic de regenerare. Suprasolicitarea aparatului insulinosecretor, indusa suplimentar si de excesul ponderal, va conduce in final la o deteriorare progresiva a functiei β celulare, exprimata clinic prin trecerea pacientului supraponderal prin etapele de toleranta alterata la glucoza si apoi de T2DM clinic manifest.
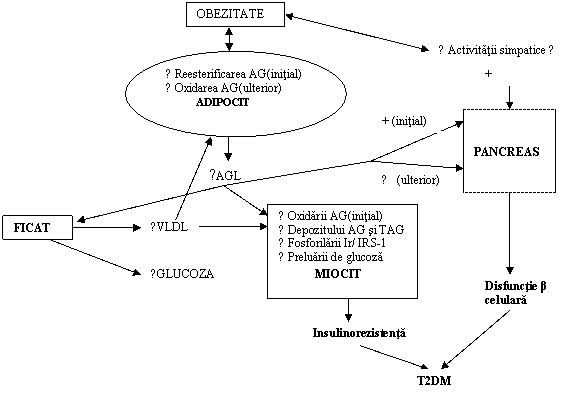
Fig.6. Reprezentarea schematica a patogeniei T2DM la pacientii obezi (adaptat dupa 39)
8. Managementul obezitatii
8.1. Masuri nefarmacologice
Beneficiile scaderii ponderale in T2DM sunt indiscutabile, dar imposibilitatea, pentru majoritatea pacientilor, de a obtine o greutate corporala acceptabila si de a o mentine pe termen lung reprezinta o problema serioasa in tratamentul diabetului zaharat.
Beneficiile scaderii ponderale. O scadere ponderala de 0,5-10 kg la pacientul obez se insoteste de numeroase beneficii pe termen scurt (3, 10, 18):
1. Mortalitatea:
- o scadere cu 20% a mortalitatii totale;
- scade cu 37% mortalitatea prin cancer;
- scade cu 44% decesul prin diabet zaharat;
- scade cu 9% decesul prin boli cardiovasculare.
2. Diabet zaharat:
- scade riscul de aparitie cu peste 50%;
- scade cu 15% HbA1c;
reduce glicemia bazala cu 30-50%.
In 1995 UKPDS a raportat o scadere pe termen lung (luni-ani) a glicemiei in conditiile persistentei scaderii ponderale, iar 5-10% din pacientii cu T2DM nou depistat pot avea glicemie à jeun normala in primul an de boala. Insa, in timp, ameliorarea insulinosensibilitatii secundara scaderii in greutate are un impact redus asupra valorilor glicemice datorita agravarii progresive a disfunctiei β celulare. Asa se explica de ce unii pacienti raspund doar in primii 1-2 ani de tratament la masurile nefarmacologice, ulterior necesitand tratament farmacologic antidiabetic.
3. Tensiunea arteriala:
- scade cu 10 mmHg componenta sistolica;
- scade cu 20 mmHg componenta diastolica.
4. Profilul lipidic:
- scade cu 10% colesterolul total;
- scade cu 10-15% LDL colesterolul;
- scad cu 20-40% trigliceridele plasmatice;
- creste cu 10-15% HDL colesterolul.
5. Ameliorarea simptomelor din afectiuni respiratorii, osteoarticulare, boli cardiovasculare.
6. Reducerea complicatiilor ginecologice, obstetricale si urologice.
7. Creste calitatea vietii pacientului, cu imbunatatirea statutului social.
Este necesar ca medicul si pacientul sa stabileasca de comun acord obiectivele si metodele abordarii scaderii ponderale. Se impune o scadere ponderala moderata si etapizata. O prima treapta consta intr-o reducere ponderala cu 5-10% obtinuta in aproximativ 3-6 luni si mentinerea noii greutati cca. 6-9 luni. Ulterior se impune o continuare a scaderii ponderale pana la greutatea stabilita initial si mentinerea greutatii finale o perioada nelimitata.
Cine trebuie sa slabeasca? Toti pacientii obezi sau supraponderali incadrati in clase clinice de risc moderat sau crescut.
Situatii ce contraindica scaderea ponderala (3):
- sarcina, perioada de lactatie;
- tuberculoza activa, hepatita cronica activa, ulcerul gastro-duodenal in puseu dureros, nefropatiile cronice, colestaza, sindromul de malabsortie, guta;
- anorexie nervoasa, depresie;
- greutatea ciclica, intalnita la indivizii cu oscilatii mari ale greutatii corporale la care tinta terapeutica este mentinerea unei greutati stabile.
Obtinerea greutatii dorite presupune o dieta hipocalorica, corectia tulburarilor de comportament alimentar, exercitiu fizic, farmacoterapie, interventii chirurgicale, metode terapeutice individualizate fiecarui pacient.
8.1.1. Dieta hipocalorica
Este necesar ca tipul de dieta sa fie ales in functie de aderenta pacientului, patologia asociata si obiectivele terapeutice. Principiile generale ale unei diete hipocalorice constau in: limitarea consumului alimentar in afara meselor, evitarea alimentelor cu densitate calorica mare, mese mici si fractionate (4-6/zi), stoparea fumatului si un consum scazut de alcool. In general, se recomanda o dieta cu deficit de 500 Kcal/zi fata de aportul alimentar anterior, estimandu-se o scadere ponderala cu 5-10% din greutatea initiala intr-o perioada 3 luni (3, 10). Dietele caracterizate printr-un deficit caloric intre 1000-1300 Kcal/zi fata de alimentatia anterioara (LCD-low calorie diet) asigura o scadere ponderala in medie cu 20% din greutatea initiala, si sunt recomandate in special pacientilor cu risc crescut (3, 10). Dietele foarte restrictive (VLCD-very low calorie diet), sub 800 Kcal/zi, conduc la o scadere ponderala marcata si rapida, dar sunt obisnuit indicate la pacientii cu IMC peste 40 Kg/m2 care trebuie sa scada rapid in greutate datorita problemelor medicale intercurente sau urgentelor chirurgicale. In plus, acest ultim tip de dieta predispune la ciclizarea greutatii si la un risc crescut de complicatii cardiovasculare.
Astazi, in functie de principiile alimentare dominante, sunt utilizate in practica clinica mai multe tipuri de diete hipocalorice (60).
Dieta cu aport scazut de lipide (20-30% din aportul caloric). Acest tip de dieta conduce obisnuit la o scadere modesta a greutatii corporale, comparativ cu rezultatele obtinute la indivizii care anterior aveau un aport zilnic lipidic crescut (in special din S.U.A.). Aportul crescut de grasimi alimentare conduce la rezistenta centrala la actiunea leptinei cu hiperleptinemie secundara si cresterea masei adipoase. Scaderea proportiei grasimilor din dieta determina ameliorarea partiala a semnalului leptinic cu reducerea secundara a apetitului si greutatii corporale. Scaderea medie in greutate atribuita acestui tip de dieta este de 3-4 Kg, raspunsul depinzand de interactiunea factorilor de mediu si genetici determinanti ai greutatii corporale. Perioadele de urmarire de peste un an nu au evidentiat mentinerea scaderii ponderale.
Dieta cu aport scazut de glucide determina o reducere modesta a aportului caloric si a scaderii in greutate. Efectul acestui regim are la baza si aportul crescut de fibre din sursele de carbohidrati, care inhiba apetitul si contribuie la scaderea ponderala. O restrictie severa de HC (sub 25 g/zi), exclusa inT2DM, asigura o scadere ponderala moderata insotita de reducerea insulinosecretiei, trigliceridemiei plasmatice, mobilizarea depozitelor hepatice de glicogen si cetoacidoza; unele dintre aceste efecte sunt contracarate de proportia ridicata a grasimilor in dieta, prin mobilizarea excesiva de acizi grasi din trigliceride.
Dieta cu mentinerea aportului proteic normal, 12-15% din aportul caloric, este recomandata in tarile in care consumul de proteine este mare (peste 15% din aportul caloric) datorita efectelor negative pe termen lung a aportului proteic excesiv (boli renale, osoase, cancer intestinal). Studii asupra dietelor bogate in proteine au raportat o scadere ponderala mai pronuntata pe o perioada de 6 luni decat prin utilizarea celor doua diete anterioare.
Este foarte important ca dieta recomandata pacientilor cu exces ponderal sa fie raportata la afectiunile asociate.
In diabetul zaharat tip 2 recomandarile dietetice se suprapun partial cu cele intalnite la pacientii nediabetici (3, 10, 26). In general, structura dietei va consta in 55%-60% HC, 25-30% lipide (cu aport de colesterol sub 250 g/zi) si 12-17% proteine (adaptat la functia renala; un aport de 17%, sau chiar 15%, din ratia calorica sub forma de proteine poate fi mare pentru un pacient cu nefropatie diabetica incipienta, grabind declinul functiei renale). Se va interzice consumul de alcool. Aportul de fibre alimentare va fi de cca. 30 g si de sare sub 6 g (adaptat la valorile tensionale).
8.1.2. Exercitiul fizic
Activitatea fizica este un element terapeutic de prima importanta care trebuie, totusi, individualizat si adaptat la patologia asociata. Efortul fizic potenteaza scaderea in greutate indusa de dieta hipocalorica, reduce insulinorezistenta si diminua masa adipoasa intraabdominala. S-a observat ca activitatea fizica limiteaza reducerea masei musculare indusa de unele diete hipocalorice (10). Numeroase studii au aratat ca activitatea fizica reduce simptomatologia si riscurile tuturor comorbiditatilor asociate. In general se recomanda efectuarea de exercitii fizice de minim 3 trei ori pe saptamana, cu o durata de 30-60 minute si o intensitate de 50-70% din capacitatea individuala de efort. Pacientul trebuie incurajat sa efectueze zilnic un nivel cat mai ridicat de activitate fizica (mers pe jos, urcat de scari etc.) Cel mai frecvent sunt recomandate exercitiile fizice dinamice, ce cuprind mai multe grupe musculare (jogging, inot, tenis, gimnastica etc.). In T2DM, ca si in alte afectiuni, tipul si intensitatea exercitiului fizic trebuie sa tina seama de complicatiile prezente.
8.2. Tratamentul farmacologic
Farmacoterapia este necesara pacientilor la care in pofida terapiei nefarmacologice nu s-a reusit obtinerea greutatii corporale stabilite. In practica medicala exista doua mari categorii de substante antiobezitate: 1) substante care inhiba apetitul, cu actiune centrala, si 2) substante ce actioneaza periferic, la nivelul intestinului, unde inhiba absortia lipidelor. Este obligatoriu ca medicamentele folosite in tratamentul obezitatii sa indeplineasca anumite conditii (44): 1) sa aiba un mecanism de actiune cunoscut, 2) toleranta clinica acceptabila, 3) sa nu determine efecte adverse importante dupa o perioada indelungata de administrare, 4) efectul de scadere a greutatii de 5-15 % sa fie doza-dependent si sa dureze pe toata perioada tratamentului, 5) sa nu dea dependenta si 6) sa nu interactioneze cu medicatia majora a pacientului. Analizand aceste conditii vom constata ca tratamentul ideal al obezitatii nu a fost descoperit inca.
In practica clinica sunt utilizate in prezent unele din urmatoarele medicamente:
Sibutramina inhiba recaptarea serotoninei, norepinefrinei si dopaminei la nivel central. Inhiba apetitul si creste metabolismul bazal. Prin inhibarea serotoninei si noradrenalinei stimuleaza termogeneza la nivelul tesutului adipos brun (44). Trial of Obesity Reduction and Maintenance (STORM) a raportat o scadere in greutate de 9% sub sibutramina, scadere care persista la 18 luni de la inceperea terapiei (60). Medicamentul determina si o reducere semnificativa a HbA1c la pacientii cu T2DM la care s-a obtinut o scadere ponderala de peste 10% din greutatea initiala (46). Deoarece exista posibilitatea unor reactii nedorite la nivel cardiovascular sau sistem nervos, se recomanda evitarea administrarii medicamentului la aceaste categorii de pacienti. Doza recomandata este de 5-15 mg/zi.
Orlistat-ul (Xenical) blocheaza actiunea lipazei intestinale cu reducerea secundara a absortiei grasimilor alimentare. Efectul este scaderea in greutate, imbunatatirea profilului lipidic si reducerea riscului cardiovascular. Nu interfera cu absortia celorlalte principii nutritive si nu are efecte secundare centrale. Este necesara insa o suplimentare de vitamine liposolubile. S-a obiectivat o reducere in greutate de 5-10% (10). Studiul XENDOS (Xenical in the prevention of diabetes in obese subjects) publicat in 2002 a aratat ca medicamentul poate preveni, intarzia sau incetini evolutia T2DM. S-a raportat o reducere cu 37% a riscului de aparitie a T2DM dupa schimbarea stilului de viata si tratament cu Orlistat. Doza recomandata este de 120 mg x3/zi, la mesele bogate in grasimi.
Flatulenta si incidentele digestive neplacute (ex. steatoree) constituie unul din principalele obstacole in utilizarea de lunga durata a acestor medicamente.
Acarboza inhiba α glucozidaza intestinala, cu rol in absortia glucidelor complexe. In acelasi timp scade si trigliceridemia postprandiala, probabil printr-un mecanism legat de raspunsul la insulina. Are efect doza-dependent si contribuie la mentinerea unei greutati stabile in T2DM. In studiul STOP-NIDM, acarboza reduce cu 25% riscul de dezvoltare a T2DM (10, 62). Este contraindicata in unele boli intestinale. La doze mai mari flatulenta si disconfortul abdominal pot fi stanjenitoare.
Metforminul este obisnuit folosit la pacientii cu T2DM cu exces ponderal. Pe langa efectul antihiperglicemic, medicamentul induce scadere in greutate sau limiteaza castigul ponderal indus de alte ADO (antidiabetice orale) si insulina.
Efedrina si cofeina fac parte din a doua linie de tratament farmacologic al obezitatii. 25-40% din efectul de reducere a greutatii provine din stimularea termogenezei, iar restul de 75-60% este asigurat prin inhibarea apetitului. Efectul asupra greutatii corporale este mai pronuntat in terapia mixta. Se recomanda cu prudenta la pacientii cu afectare cardiovasculara, datorita cresterii riscului de tahiaritmii si HTA (60).
Si alte medicamente antiobezitate au fost utilizate in practica medicala (D-fenfluramina, fenteramina etc), dar la care s-a renuntat datorita reactiilor adverse serioase.
In prezent sunt in studii o serie de substante care au ca tinte moleculare leptina, IL-1, NPY, colecistokinina Axokina etc., si fara a ne face prea multe iluzii, vor reprezenta terapia viitoare in tratamentul obezitatii.
8.3. Tratamentul chirurgical
Metodele chirurgicale de tratament al obezitatii (reunite generic sub denumirea de chirurgie bariatrica) sunt luate in considerare in urmatoarele situatii extreme (1, 3, 10):
1. IMC peste 40 Kg/m2 (unii specialisti recomanda initial tratament farmacologic 6 luni-1 an;
2. IMC peste 35 Kg/m2 in prezenta complicatiilor medicale ale obezitatii;
3. insuccesul metodelor de scadere / mentinere in greutate aplicate timp de 1 an;
4. existenta unor complicatii medicale (ex. apnee obstructiva in somn, esofagita de reflux severa, artrita invalidanta) ce necesita o scadere rapida in greutate.
Tehnicile chirurgicale cel mai frecvent luate in considerare sunt: gastroplastia, gastrobanda rigida sau gonflabila, by-pass gastric, by-pass bilio-intestinal, by-pass jejuno-ileal. In multe cazuri este necesara o echipa complexa formata din chirurgi, nutritionisti si psihologi cu multa experienta in domeniu.
Bibliografie
1. AACE/ACE POSITION STATEMENT on the prevention, diagnosis and treatment of obesity (1998 Revision)
2. Ahmad Z., Lee F. T., DePaoli-Roach A., Roach P. J.: Phosphorylation of glycogen synthase by the Ca2+ and phospholipid-activated protein kinase (protein kinase C). J. Biol. Chem. 259: 8743-8747, 1984
3. Asociatia romana pentru studiul obezitatii (ARSO): Managementul obezitatii si supraponderii la adulti. Jurnalul roman de diabet, nutritie, boli metabolice 2 (1) 2001
4. Baron A. D.: Hemodynamic actions of insulin. Am. J. Physiol. 30: 187-202, 1994
5. Björntorp P.: Endocrine abnormalities in obesity. Diabetes Reviews 5: 52-68, 1997
6. Bloomgarden Z. T.: Diabetes and obesity. American Diabetes Association Annual Meeting 1999. Diabetes Care 23 (1): 118-124, 2000
7. Boden G., Shulman G. I.: Free fatty acids in obesity and type 2 diabetes: defining their role in the development of insulin resistance and β-cell dysfunction. E. J. Clin. Invest. 32 (3): 14-23, 2002
8. Bouchard C.: Genetics of obesity. Ed. CRC Press. 1994
9. Chiesi M., Huppertz C., Hofbauer K. G.: Pharmacotherapy of obesity: targets and perspectives. Trends in Pharmacological Sciences 22 (5): 247-254, 2001
10. Colisnic A., Soimaru R.: Abordul nonfarmacologic al obezitatii. Revista pentru educatie medicala continua. 1 (7): 72-78, 2003
11. Conn W. W.: Epidemiology of venous thromboembolism. Ann. Surg. 186:149-164, 1977
12. Deprés J. P.: Abdominal obesity as important component of insulin-resistance syndrome. Nutrition 9: 452-459, 1993
13. Dusserre E., Moulin P., Vidal H.: Differences in mRNA expression of the proteins secreted by the adipocytes in human subcutaneous and visceral adipose tissue. Biochim. Biophis. Acta 1500: 88-96, 2000
14. Ellis B. A., Poynten A., Lowy A. J., Furler S. M., Chisholm D. J., Kraegen E. W., Cooney G. J.: Long-chain acyl-CoA esters as indicators of lipid metabolism andinsulin sessitivity in rat and human muscle. Am. J. Physiol. Endocrinol. Metab. 279: 554-560, 2000
15. Everhart J. E., Pettitt D. J., Bennet P. H., si colab.: Duration of obesity increase the incidence of NIDDM. Diabetes 41: 235, 1992
16. Feldman R., Sender A. J., Siegelaub A. B.: Difference in diabetic and nondiabetic fat distribution patterns by skinfold measurements. Diabetes 18: 478, 1969
17. Felson D. T., Aderson J. J.: Obesity and osteoarthritis. J. Rheumatology 22: 7-9, 1995
18. Filip L., Lupu S.: Vademecum clinic al obezitatii. Revista pentru educatie medicala continua. 1 (7): 44-56, 2003
19. Friedman J. M., Leibel R. L., Bahary N. : Molecular mapping of obesity genes. Mamm. Genome. 1: 130-144, 1991
20. Grossman E., Oren S., Messerli F. H.: Left ventricular filling in the systemic hypertension of obesity. Am. J. Cardiology 68: 57-60, 1991
21. Gulve E. A., Henriksen E. J., Rodnick K. J. si colab.: Glucose transporters and glucose transport in skeletal muscles of 1- to 25-mo-old rats. Am. J. Physiol. 264: 319, 1993
22. Hartz A. J., Rupley D. C., Rimm A. A.: The asociation of girth measurements with disease in 32 856 women. Am. J. Epidemiol. 119: 71, 1984
23. Hirose H., Lee Y. H., Inman L. R., Nagasawa Y., Johnson J. H., Unger R. H.: Defective fatty acid-mediated beta-cell compensation in Zucker diabetic fatty rats. Pathogenic implications for obesity-dependent diabetes. J. Biol. Chem. 271: 1659-1664, 1996
24. Hubert H. B., Feinlieb M., McNamara P. M., Castelli W. P.: Obesity as an independent risk factor for cardiovascular disease: a 26-year follow-up of participants in the Framingham Heart Study. Circulation 67: 968-977, 1983
25. Ionescu-Tirgoviste C., Cheta D., Popa E., Mincu I.: Le rôle de l`obésité dans l`etiopathogénie du diabéte sucré. Med. et Nut. 12 (2): 97-105, 1976
26. Ionescu-Tirgoviste C.: Diabetologia moderna. EdituraTehnica, Bucuresti 1997
27. Jéquier E., Tappy L.: Regulation of body weight in humans. Physiological Reviews 79 (2): 451-480, 1999
29. Joslin E. P.: The prevention of diabetes mellitus. JAMA 76: 79, 1921
30. Kahn S., Prigeon R., Schvartz R. si colab.: Obesity, body fat distribution, insulin sensitivity and islet beta-cell function as explanations for metabolic diversity. J. Nutr. 131: 354-360, 2001
31. Kelley D., Thaete F., Troost F. si colab.: Subdivisions of subcutaneous abdominal tissue and insulin resistance. Am. J. Physiol. 278: 941-948, 2000
32. Knowler W. C., Pettit D. J., Saad M. F. si colab.: Diabetes mellitus in the Pima Indians: incidence, risk factors and pathogenesis. Diabetes and Metabolism Review 6:1, 1990
33. Le Roith D., Taylor S. I., Olefsky j. M.: Diabetes mellitus. A fundamental and clinical text. Lippincot, Williams and Wilkins. Second edition, 2000
34. Lean M. E., Han T. S., Morrison C. E.: Waist circumferince as a mesure for indicating need for weight management. BMJ 311: 158-161, 1995
35. Lean M. E.: Clinical handbook of weight management. Editura Martin Dunitz 1996
36. Lewis G. F., Carpentier A., Adeli K., Giacca A.: Disordered fat storage and mobilization in the pathogenesis of insulin resistance and type 2 diabetes. Endocrine Reviews. 23 (2): 201-229, 2002
37. Lian Y., Buettger C., Berner D. K., Matschinsky F. M.: Chronic effect of fatty acids on insulin release is not through the alteration of glucose metabolism in a pancreatic beta-cell line (βHC9). Diabetologia 40: 1018-1027, 1997
38. Lillioja S., Mott D. M., Spraul M. si colab.: Insulin resistance and insulin secretory dysfunction as precursors of non-insulin-dependent diabetes mellitus. Prospective studies of Pima Indians. N. Engl. J. Med. 329: 1988, 1993
39. McGarry J. D.: Dysregulation of fatty acid metabolism in the etiology of type 2 diabetes. Diabetes Care 51(1): 7-18, 2002
40. Meneilly G. S., Minaker K. L. si colab.: Impairment of noninsulin-mediated glucose disposal in the elderly. J. Cli. Endocrinol. Metab. 63: 566, 1989
41. Modan M., Karasik A., Halkin H si colab.: Effect of past and concurrent body mass index on prevalence of glucose intolerance and type 2 (non-insulin-dependent) diabetes and on insulin response. The Israel study of glucose intolerance, obesity and hypertension. Diabetologia 29: 82, 1983
42. National center of Health Statistics (NHANES II). Vital and Health Statistics. NHANES II, seria I; 15, 1981
43. Ohslon L. O., Larsson B., Svardsudd K. si colab.: The influence of body fat distribution on the incidence of diabetes mellitus. 13,5 years of follow-up of the participantsin the study of men born in 1913. Diabetes 34: 1055, 1985
44. Paveliu F. S.: Supraponderalitatea si obezitatea de la preventie la tratament. Editura Infomedica 2002
45. Pérusse L., Desprès J. P., Lemieux S., Rice T., Rao D. C., Bouchard C.: Familial aggregation of abdominal visceral fat: results from the Quebec Family Study. Metabolism 46: 378-382, 1996
46. Purnell J. Q.: Obesity. Sci. Am. Med. 2003
47. Rice T., Desprès J. P., Daw E. W., Gagnon J., Borecki I., Pérusse L., Leon A. S., Skinner J. S., Wilmore J. H., Rao D. C., Bouchard C.: Familial resemblance for abdominal visceral fat: the HERITAGE Family Study. Int. J. Obes. 21: 1024-1031, 1997
48. Rumantir M. S., Vaz M., Jennings G. L. si colab.: Neural mechanisms in human obesity-related hypertension. J. Hypertens. 17 1125-1133, 1999
49. Samaras K., Campbell L. V.: The non-genetic determinants of central adiposity. Int. J. Obesity. 21 (10): 839-845,1997
50. Seidell J.: Epidemiology of obesity. The round table meeting on obesity management in Central Europe, 1997
51. Shimabukuro M., Zhou Y. T., Lee Y., Unger R. H.: Troglitazone lowers islet fat and restores beta cell function of Zucker diabetic fatty rats. J. Biol. Chem. 273: 3547-3550, 1998
52. Sjöström L.: A multicompartment body composition technique based on computerized tomography. In: Angel A, Anderson H, Bouchard C, Lau D, Leiter L, Mendelson R (eds) Progress in Obesity Research: Proceedings of the Seventh International Congress on Obesity (Toronto, Canada, August 20-25, 1994) vol 7: 321-324, 1996
53. Sleeman M. W., Donegan N. P., Heller-Harrison R., Lane W. S., Czech M. P.: Association of acyl-CoA synthetase-1 with Glut4-containing vesicles. J. Biol. Chem. 273: 3132-3135, 1998
54. Smith S., Lovejoy J., Greenway F. si colab.: Contributions of total body fat, abdominal subcutaneous adipose tissue compartments, and visceral adipose tissue to the metabolic complications of obesity. Metabolism 50: 425-435, 2001
55. Solomon C. G., Manson J. E.: Obesity and mortality : a review of the epidemiologic data. Am. J. Clin. Nutr. 66 (4): 1044-1050, 1997
56. Stehbens W. E.: The epidemiological relationship of hypercholesterolemia, hypertension, diabetes mellitus,and obesity to coronary heart disease and atherogenesis. J. Clin. Epidemiol. 43 (8): 733-741, 1990
57. Stein D. T., Stevenson B. E., Chester M. W., Basit M., Daniels M. B., Turley S. D., McGarry J. D.: The insulinotropic potency of fatty acids is influenced profoundly by their chain length and degree of saturation. J Clin Invest 100:398-403, 1997
58. Stunkard A. J., Foch T. T., Hrubec Z : A twin study of human obesity. JAMA 256: 51-54, 1986
59. 59. Tchkoia T., Karagiannides I., Forse R. A., Kirkland J. L.: Different fat depots are distinct mini-organs. 8 (5): 227-234, 2001
60. Uwaifo G. I., Arioglu E.: Obesity. Electronic book (medline) 2002
61. Wajchenberg B. L.: Subcutaneous and visceral adipose tissue: their relation to the Metabolic syndrome. Endocrine Reviews 21: 697-738, 2000
62. Ward D.: Acarbose-anti-diabetic, weight loss drug. International Antiaging Systems
63. West K. M., Kalbfleish J. M.: Influence of nutritional factors on prevalence of diabetes. Diabetes 20: 99, 1971
64. West K. M.: Diabetes in American Indians and other native populations of the New World. Diabetes 23: 841, 1974
65. Wild R. A.: Obesity, lipids, cardiovascular risk and androgen excess. Am. J. Med. 98 (1): 27-32, 1995
66. Wilding J. P. H.: Neuropeptides and appetite control. Diabetic Medicine 19: 619-627, 2002
67. Zamboni M., Armellini F., Muller D., Sorkin J., Turcato E., Andres R., Bosello O.: Methodological and clinical aspects of subcutaneous fat distribution. In: Angel A, Anderson H, Bouchard C, Lau D, Leiter L, Mendelson R (eds) Progress in Obesity Research: Proceedings of the Seventh International Congress on Obesity (Toronto, Canada, August 20-25, 1994) vol. 7:145-150, 1996