
|
|
|
UNIVERSITATEA DE PETROL SI GAZE PLOIESTI
FACULTATEA TEHNOLOGIA PETROLULUI SI PETROCHIMIE
Epurarea mecanica si fizico-chimica a apelor uzate
Epurarea apelor este proces complex de retinere si neutralizare a substantelor nocive dizolvate, in stare coloidala sau de suspensii, prezente in apele uzate industriale si orasenesti, care nu sunt acceptate in mediul acvatic in care se face deversarea apelor tratate si care permite refacerea proprietatilor fizico-chimice ale apei inainte de utilizare.
Epurarea apelor uzate cuprinde doua mari grupe de operatii succesive:
- retinerea sau neutralizarea substantelor nocive sau valorificabile prezente in apele uzate;
- prelucrarea materialului rezultat din prima operatie.
Astfel, epurarea are ca rezultate finale:
- ape epurate, in diferite grade, varsate in emisar sau care pot fi valorificate in irigatii sau alte scopuri;
- namoluri, care sunt prelucrate, depozitate, descompuse sau valorificate.
Metodele principale de epurare a apelor reziduale difera in functie de poluantii prezenti. Se pot clasifica, in primul rand, in functie de mecanismul care conduce la reducerea poluantului prin metode "conventionale":
- fizico-mecanice;
- fizico-chimice;
- biochimice sau biologice.
Combinarea acestor metode permite o purificare avansata, efluentii epurati putand fi reintrodusi in circuitul economic. Adoptarea unui anumit procedeu depinde de:
- cantitatea efluentului;
- continutul in poluanti;
- conditiile de calitate impuse la evacuarea apei epurate in emisar;
- mijloacele finaciare ale agentului economic respectiv.
Se poate calcula gradul de epurare corespunzator fiecarui echipament mecanic, chimic sau biologic. Gradul de epurare se stabileste cu relatia:
![]()
in care: ci si cf sunt concentratia initiala si respectiv finala a poluantului in apa supusa epurarii.
Exista ape uzate provenite din industrie care contin poluanti specifici si care nu pot fi inlaturati prin cele trei metode asa zis conventionale. Este cazul apelor uzate care contin substante minerale solubile si substante organice nedegradabile biologic. In aceste situatii se recurge la tehnici de epurare avansate.
Ca eficienta si cost cele mai bune rezultate s-au obtinut in procedeele de epurare cu adsorbtie, cu schimbatori de ioni si procedeele de oxidare chimica.
Procedeele de epurare cu adsorbtie permit eliminarea cantitatilor mici de substante organice ramase dupa etapa biologica. Uzual, ca material adsorbant se foloseste, carbunele activ obtinut prin conditionarea speciala a carbunelui vegetal sau fosil.
Procedeele de epurare cu adsorbtie se aplica, in special, pentru indepartarea avansata a fenolilor, detergentilor si a altor substante ce pot da un miros sau gust neplacut apei de baut.
Procedeele de epurare cu schimbatori de ioni se utilizeaza frecvent pentru eliminarea poluantilor minerali care se gasesc in apa sub forma ionica: calciu, magneziu, sodiu, sulfati, nitrati, fosfati, amoniu, metale grele etc. Anumite tipuri de schimbatori de ioni, sintetizate, pot epura si compusi organici de tipul fenolilor, detergentilor, colorantilor etc.
Procedeele de oxidare chimica se aplica eficient la eliminrea substantelor poluante anorganice (cianuri, sulfuri, anumite metale grele etc.) si organice(fenoli, coloranti, anumite pesticide etc.).
Ca reactivi sunt utilizate substante chimice cu proprietati oxidante: ozonul, apa oxigenata, clorul cu produsii sai derivati (hipocloritul, bioxidul de clor)
Ca tehnici de epurare aplicabile in viitor se mentioneaza:
- eliminarea poluantilor la temperaturi mari in reactoare cu plasma;
- tratarea cu radiatii ultraviolete.
Schema instalatiei de epurare descrie succesiunea etapelor principale aratand legaturile intre ele si indicand elemente de tehnologie. Schema aleasa poate include un anumit numar de etape de tratare (epurare), corelate astfel incat sa realizeze gradul de epurare impus.
Schema unei instalatii de epurare se stabileste in functie de:
- caracteristicile apei uzate;
- de provenienta lor;
- de gradul de purificare necesar;
- de metodele de tratament a namolului;
- de suprafata disponibila;
- de tipul echipamentului ce va fi folosit;
- de conditiile locale.
Alegerea metodei de epurare depinde de eficienta obtinuta in diferite procedee. Acestea sunt prezentate centralizat in tabelul 1.
O statie de epurare ape poate functiona cu una, doua sau trei trepte dupa provenienta si caracteristicile apelor uzate (v. tabelul 2).
Tabelul 1. Eficienta procedeelor de epurare a apei
Procedeu
Indepartare, %
CBO5
CCO
Suspensii
Bacterii
Trecere prin site
5-10
5-15
2-20
10-20
Clorinare
15-30
90-95
Decantare
25-40
20-35
40-70
25-75
Coagulare, floculare
50-85
40-70
70-90
40-80
Epurare in biofiltru
50-95
50-80
50-92
90-95
Epurare cu namol activ
55-95
50-80
55-95
90-98
Epurare in iaz biologic
90-95
70-80
85-95
95-98
Clorinare finala
98-99
Tabelul 2. Provenienta apelor uzate si tratamentele aferente
Ape uzate din
Tratamente aplicate
Industrii prelucratoare de materii prime si substante anorganice
- treapta mecanica
- treapta chimica
- ambele trepte aplicate succesiv
Industrii prelucratoare de materii organice
- treapta mecanica
- treapta chimica
- ambele trepte aplicate succesiv
Activitate sociala
- epurare mecano-chimica
- epurare mecano-biologica
- ambele trepte
Zootehnie
- treapta mecanica
- treapta chimica
- treapta biologica
Intr-o instalatie de epurare ape reziduale se urmareste, in general, epurarea sau pasivizarea tuturor substantelor poluante.
Epurarea fizico-mecanica a apelor uzate constituie prima treapta de epurare a apelor uzate (primary treatment) si se bazeaza pe procese fizice de separare a poluantilor din apele uzate. In aceasta treapta se indeparteaza, in special, materiile solide (cu densitatea mai mare de 1g/cm3) sau cele solide si lichide cu densitati mai mici decat 1 g/cm3. De asemenea sunt retinute si substantele organice, dar cu o eficienta relativ redusa (intre 20 si 30%).
In cadrul epurarii fizico mecanice se disting urmatoarele etape:
1. Retinerea corpurilor si suspensiilor mari;
2. Prelucrarea depunerilor de pe gratare si site;
3. Sedimentarea;
4. Deznisiparea;
5. Decantarea.
Retinerea corpurilor si suspensiilor mari impreuna cu deznisiparea formeaza etapa de pretratare.
Instalatiile pentru epurarea fizico-mecanica se amplaseaza astfel incat apa sa treaca prin ele succesiv si pe cea mai scurta cale. O instalatie de acest tip se compune din (figura 1.):
- bazin de egalizare;
- gratar si denisipator;
- separator de titei;
- bazin de decantare suplimentara (elesteu);
- pompe etc.
Schema unei instalatii de purificare mecanica este prezentata in figura 1. Apa reziduala trece mai intai prin bazinul de egalizare si apoi printr-un deznisipator, pentru depunerea suspensiilor solide. In cazul patrunderii in canalizare a apelor meteorice, bazinul de egalizare permite dirijarea excesului de apa intr-un bazin de rezerva denumit bazin de avarii. Din deznisipator apele trec prin camera de distributie in separatorul de titei, unde se retine cea mai mare parte a produselor petroliere si a malului si apoi in elesteu, unde are loc egalizarea si o separare suplimentara in produse. De aici, apele reziduale trec la o purificare suplimentara sau se recircula in instalatie
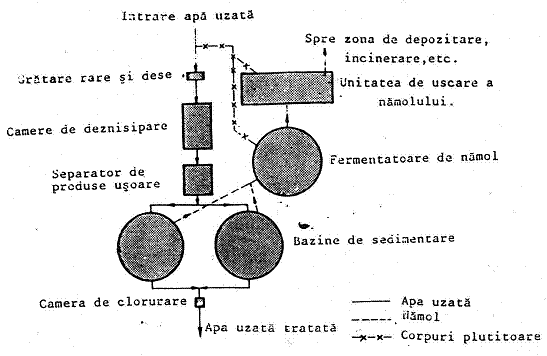
Figura 1. Schema epurararii fizico-mecanice a apelor reziduale.
In continuare se vor prezenta principalele echipamente necesare in epurarea fizico-mecanica.
Gratarele sunt constructii din bare de otel, care au rolul de a retine corpurile si suspensiile mari din apele uzate. Sunt amplasate la intrarea apelor uzate in statia de epurare. In functie de distanta intre bare (b), ele pot fi:
- gratare rare - cu b = 50-150 mm;
- gratare dese: - curatate manual cu b = 40-60 mm;
- curatate mecanic cu b = 16-20 mm.
Gratarele rare se amplaseaza in amontele gratarelor dese. Ele pot fi plane sau curbe. Unghiul pe care gratarele il fac cu planul orizontal depinde de metoda de curatire folosita: gratarele curatate manual au inclinatia cuprinsa intre 30-75°, pe cand cele curatate mecanic au inclinatii de 45-90°.
Formele tipice ale barelor de gratare sunt prezentate in figura 2, iar modul de amplasare al gratarelor cu curatire manuala este ilustrat in figura 3.
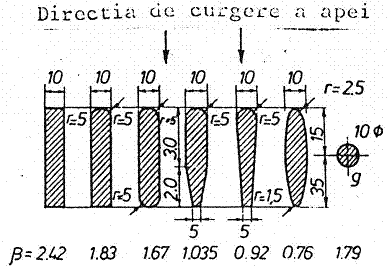
Figura 2. Forme tipice ale barelor de gratare
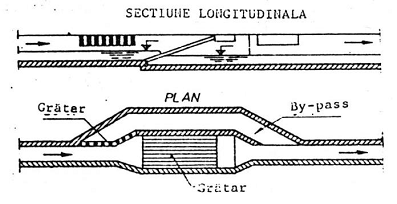
Figura 3. Amplasarea gratarelor cu curatire manuala.
Dimensionarea gratarelor se face astfel incat viteza medie a apei sa fie 0,8 - 0,9 m/s in canalul din amontele gratarului si 1,0 - 1,1 m/s printre barele gratarului. La trecerea debitului de verificare (Qu orar min), viteza medie in canalul din amontele gratarului trebuie sa fie minim 0,4 m/s in scopul evitarii depunerilor.
Sitele au ca scop retinerea materialelor mai fine din apele uzate, care au trecut printre gratare si constau din discuri perforate, impletituri din sarma inox, cu ochiuri de 0,75-1,75 cm. Substantele retinute sunt transportate special, iar in statiile mari sunt fie incinerate, fie fermentate sau compostate.
Sedimentarea este procesul de separare din apele uzate a particulelor solide prin depunere gravitationala. In cursul sedimentarii (care poate fi de mai multe tipuri) se pot delimita intr-o coloana cilindrica de sticla mai multe zone:
- o zona superioara de lichid limpezit;
- o zona de sedimentare cu o concentratie uniforma de suspensii;
- o zona de tranzitie;
- o zona de compresiune tasare a namolului depus.
In epurarea apelor uzate, sedimentarea este utilizata pentru indepartarea, atat a substantelor solide organice, cat si anorganice care se depun in apa sau care au fost aduse intr-o forma care se depune (coagulare, precipitare). Pentru apele uzate, procesul de sedimentare se aplica in urmatoarele amenajari:
2.3.1. Deznisipatoare - unde se separa suspensiile granulare cu dimensiuni de 0,15-0,20 mm si mai mari (nisip, alte particule grosiere). Ele se afla sub forma de particule discrete ce sedimenteaza independent unele de altele si cu viteza constanta. Deznisipatoarele au rolul de a proteja echipamentele impotriva abraziunii produsa de nisip in timpul curgerii, de a preveni colmatarea conductelor cauzata de depunerea particulelor, de a reduce frecventa de curatire a fermentatoarelor de namol si a decantoarelor de depunerile excesive. In statia de epurare, deznisipatoarele sunt plasate in spatele gratarelor si inaintea decantoarelor primare.
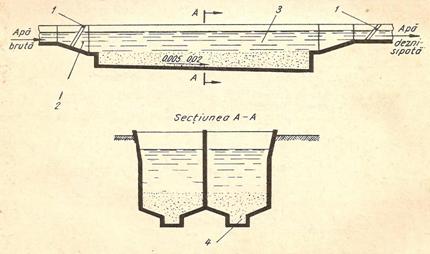
Figura 4. Deznisipator orizontal:1 - gratar; 2 - camera de linistire si de distributie a apei; 3 - camera de depunere; 4 - rigola.
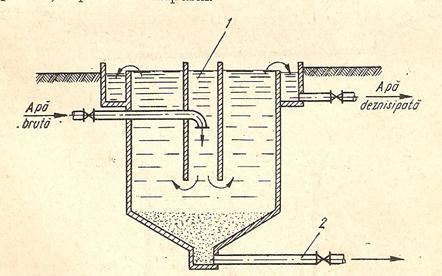
Figura 5. Deznisipator vertical: 1 - compartimentul central de intrare;
2 - conducta de evacuare
2.3.2. Decantoare sau bazine de sedimentare primare unde se retin materiile solide in suspensie separabile prin decantare, precum si suspensiile floculente compuse din:
- particule ce formeaza aglomerari mari;
- flocoane provenite de la coagularea suspensiilor din apa;
- materii organice solide in suspensie care sedimenteaza mai bine cand se unesc intre ele.
2.3.3 Decantoarele finale sau secundare unde se retin, in general suspensiile provenite din treapta de epurare biochimica.
Eficienta de sedimentare a materialului solid in suspensie este influentata de numerosi factori, dintre care cei mai importanti sunt:
- curentii de apa de diferite origini, cu directii diferite, care depind de natura lor;
- curenti turbionari datorati inertiei fluidului la intrare;
- curenti de suprafata produsi de vant in bazinele descoperite;
- curenti de convectie verticala de origine termica;
- curenti de densitate produsi de apa rece sau "grea" care curge in partea de jos a bazinului si apa calda sau "usoara" care curge la suprafata. Pentru a preveni formarea curentilor verticali de densitate, care pot provoca scurt- circuite sau intarzieri in curgerea apei, decantoarele trebuie sa fie cat mai plate posibil. Se recomanda ca raportul intre adancime si diametru sau lungime sa fie aproximativ 1/20.
Calculul de dimensionare a bazinelor de decantare consta in determinarea timpului necesar ca particulele solide sa ajunga la fundul bazinului cunoscand viteza acestora de cadere si viteza de deplasare a apei.
Aceasta etapa intervine in cazul in care sedimentarea naturala a suspensiilor din apa nu este suficienta pentru indepartarea completa a suspensiilor fine sau coloidale si a substantelor chimice dizolvate.
Epurarea fizico-chimica are la baza procedee si fenomene chimice de neutralizare, precipitare, coagulare, floculare, realizate prin tratarea apei cu reactivi chimici.
Metoda se aplica apelor uzate industriale si altor categorii de ape atunci cand se urmareste o epurare rapida si eficienta. Epuarea chimica se aplica atat poluantilor in suspensie, cat si celor dizolvati.
Materiile aflate in suspensie fina, care nu s-au decantat in decantorul primar, fiind dispersate coloidal, se elimina cu ajutorul unor reactivi chimici (coagulanti). Aplicarea procedeului de decantare cu coagulanti asigura eliminarea materiilor in suspensie in proportie de peste 95% si reduce continutul de substante organice dizolvate.
Eliminarea poluantilor dizolvati se realizeaza prin reactii chimice in care reactivul introdus formeaza cu poluantul un produs greu solubil. Acesta fie se depune la baza bazinului de reactie, fie este descompus sau transformat intr-o substanta inactiva chimic. Se pot elimina in acest mod din solutie metalele grele, cianurile, fenolii, coloranti etc. Ca reactivi se utilizeaza laptele de var, clorul, ozonul.
De asemenea, apele uzate cu caracter acid sau alcalin, inainte de deversarea in emisar, se supun preepurarii prin neutralizarea lor in bazine cu ajutorul unor reactivi corespunzatori.
Dimensiunea particulelor de impuritati care pot fi prezente in apele uzate variaza de la 10-7 mm la circa 1 mm. O parte din acestea pot fi separate prin sedimentare. Intru-cat insa o parte din impuritati au dimensiuni si deci viteze de sedimentare prea mici pentru a putea fi separate din apa pe aceasta cale, se recurge la agregarea lor in particule mai mari, care pot fi indepartate prin coagulare si sedimentare.
Particulele foarte fine sunt inconjurate de invelisuri de ioni si poseda deci o incarcare electrica care provoaca repulsia particulelor intre ele, iar pentru agregarea particulelor fiind necesara invingerea sau anularea acestor forte de repulsie.
Toti solii liofobi (adica particulele intre care nu exista interactiune) sunt alcatuiti din doua parti:
- nucleul, partea interioara, neutra din punct de vedere electric, care constituie masa micelei;
- partea exterioara, ionogena, formata din doua straturi de ioni.
Conform conceptiei stratului dublu electric exista un strat de adsorbtie, care adera direct la nucleu si este denumit strat fix sau Helmoltz si un strat difuz, care este format din anioni sau contraioni. Stratul fix este asemanator unui condensator si este denumit strat dublu electric.
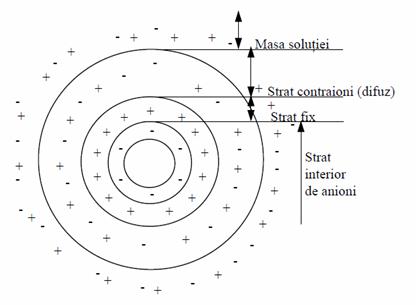
Figura 6 Modelul stratului dublu electric
Particulele coloidale din apa, datorita incarcarii superficiale cu sarcini electrice, apar incarcate cu un potential negativ, numit potential zeta sau potential electrocinetic. Coloizii, prin structura lor, apar incarcati negativ, incarcare ce le confera stabilitate sau echilibru stabil, nu sedimenteaza si se mentin in echilibru mult timp. Stricarea echilibrului coloidal se realizeaza prin neutralizarea sarcinilor electrice ce conduce la sedimentarea particulelor datorita formarii unor particule mai mari, flocoane.
In literatura de specialitate, termenul de coagulare este folosit pentru a descrie procesul de destabilizare produs prin compresia celor doua invelisuri electrice care inconjoara particulele coloide, ceea ce face posibila agregarea lor, iar termenul de floculare se refera la destabilizarea prin adsorbtia unor molecule mari de polimeri care formeaza punti de legatura intre particule.
Procesul de coagulare se petrece in doua faze:
- faza pericinetica, la introducerea reactivului, intr-un timp foarte scurt, cand are loc neutralizarea si formarea de microflocoane neobservabile cu ochiul liber;
- faza ortocinetica, in care are loc formarea de flocoane mari, vizibile cu ochiul liber, chiar agregate, usor sedimentabile.
Daca la inceputul procesului cantitatea de flocoane este de ordinul sutelor de mii/cm3 de apa, se ajunge ca la sfarsitul procesului sa existe 5-10 flocoane/cm3 de apa.
Mecanismele coagularii-flocurarii sunt mecanismele destabilizarii coloizilor, care au fost stabilite in decursul timpului si confirmate prin numeroase cercetari experimentale. Astazi sunt considerate patru mecanisme si anume:
- compresia stratului electric al coloizilor;
- neutralizarea sarcinilor electrice ale coloizilor;
- formarea precipitatelor;
- adsorbtie si legare intre particulelor de precipitare prin punti sau lanturi in punte, Me-OH-Me.
Factorii care contribuie la destabilizarea particulelor sunt:
- hidroliza ionilor polivalenti si formarea de specii monomerice si polimerice de hidroliza;
- adsorbtia speciilor de hidroliza la interfata particulelor coloidale;
- prinderea particulelor destabilizate in agregate;
- antrenarea particulelor destabilizate prin forte Van der Waals;
- schimbari in structura polimerilor de tip Me-OH-Me, cu contributie in adsorbtia flocoanelor.
Influenta unuia sau mai multor factori se manifesta in functie de compozitia chimica si biologica a mediului apos si de natura fizico-chimica a particulei.
Procesul de coagulare-floculare depinde de chimismul apei, respectiv de pH, alcalinitatea, CHO-3, valoarea indicatorilor Cl-, SO-4, de substante organice prezente in special acizi humici si acizi fulvici. De asemenea, procesul de coagulare este dependent in cazul apelor cu incarcare biologica de tipul algelor existente.
Destabilizarea coloizilor cu sarcina electrica negativa - intalniti mai frecvent in practica - se poate realiza prin tratarea cu ioni metalici pozitivi, eficienta sporind cu valenta ionilor. Astfel, pentru a obtine acelasi efect de coagulare cu saruri de potasiu, calciu si aluminiu este nevoie de o doza de saruri de circa 10 ori mai mare in cazul calciului si de circa 500 de ori mai mare in cazul potasiului decat in cazul aluminiului. In practica se folosesc, cu precadere, sarurile de metale trivalente, Fe(III) si Al(III). La coagularea cu saruri metalice are loc formarea de hidroxizi metalici polimerizati, incarcati electric pozitiv, capabili sa se adsoarba pe suprafata particulelor si in acelasi timp sa asigure legaturi intre mai multe particule. Doza de coagulant necesara pentru destabilizare depinde de concentratia coloizilor, de pH si de prezenta in solutie a altor ioni.
Pentru formarea puntilor de legatura intre particulele coloidale destabilizate se utilizeaza polimeri organici sau anorganici. Cei organici pot fi cationici (polimeri de amine tertiare), anionici (polimeri ai acidului acrilic, poliacrilamida mai mult sau mai putin hidrolizata, polistiren sulfonat etc.) sau neionici (poliacrilamida, oxid de polietilena etc.). Drept polielectrolit anorganic se foloseste in special acidul silicic polimerizat.
Polimeri organici cu insusiri floculante sunt prezenti si in secretiile extracelulare ale unor microorganisme, printre care si cele din namolul activ, acestia avand un rol important in flocularea namolului activ.
Concentratia cationilor bivalenti si trivalenti din apa poate exercita o influenta importanta asupra capacitatii polielectrolitilor anionici de a agrega coloizii incarcati negativ. Adaosul de coagulanti cationici sau de polielectroliti in doze excesive poate duce la inversarea sarcinii particulelor coloidale si la restabilizarea lor.
Intru-cat particulele coloidale sunt prezente in aproape toate categoriile de ape uzate industriale, coagularea este unul dintre procesele de epurare care isi gaseste o aplicare larga in practica. In practica tratarii apei, cele mai folosite procedee sunt:
- coagularea cu adaus de reactivi chimici numiti coagulanti;
- coagularea electrica sau electrocoagulare.
Sarurile de aluminiu cele mai utilizate in procesul de coagulare sunt:
- sulfatul de aluminiu, Al2(SO4)3·18H2O;
- aluminatul de sodiu NaAlO2;
- clorura de aluminiuAlCl3·6H2O;
- policlorura bazica de aluminiu (PCBA) etc.
Cel ma folosit reactiv la scara industriala este sulfatul de aluminiu. La introducerea sulfatului de aluminiu in apa are loc reactia de hidroliza pe baza alcalinitatii naturale a apei data de bicarbonati (HCO3-) si carbonati (CO32-), conform rectiei:
Al2(SO4)3 + 3Ca(HCO3)2 + 6H2O ↔ 2Al(OH)3↓ + CaSO4 + 6CO2 + 6H2O
Reactia are loc la un pH=6,5-7,5 care reprezinta ph-ul solubilitatii minime a Al(OH)3.
Studiile facute asupra reactiei de coagulare cu sulfat de aluminiu au aratat existenta mai multor specii de ioni care se formeaza la dizolvarea si diluarea sarurilor de aluminiu in apa, conform reactiilor:

La pH = 6-7, hidroliza se produce in microsecunde; polimerii se formeaza dupa 1s, iar Al(OH)3 precipita in 1-7 sec.
Formarea acestor specii ioni hidroxo-metal este dependenta de pH-ul mediului. In graficul din figura 7. este data distributia speciilor ionice in functie de pH si domeniul de precipitare al Al(OH)3.
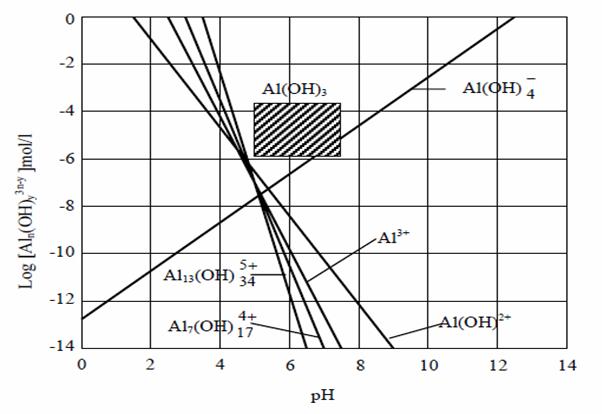
Figura 7. Compozitia de echilibru a solutiei in contact cu precipitat proaspat de Al(OH)3 (partea hasurata reprezinta zona de lucru in tratarea practica).
Speciile de aluminiu rezultate in urma hidrolizei se scriu si cu moleculele de apa, dupa cum urmeaza:
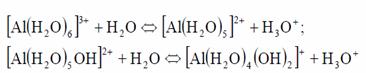
Reactiile continua pana la formarea [Al(H2O)2(OH)4]-, dar exista studii recente in care sunt date combinatii de tipul [Al13(OH)34]5+ sau [Al7(OH)17]4+.
Formarea hidroxidului de aluminiu incepe la pH = 4,5, iar la pH > 8,5 hidroxidul de aluminiu se dizolva formand aluminati, conform reactiei:
![]()
Hidroxidul de aluminiu, ca si alte saruri de aluminiu, prezinta proprietati amfotere, respectiv disociaza atat ca acid, cat si ca baza, in functie de pH-ul mediului, conform reactiilor:
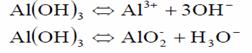
Ionul aluminat hidrolizeaza in prezenta de acid formand Al(OH)3:
AlO2- + 2H2O → Al(OH)3↓ + HO-
astfel ca aluminatul are rolul de coagulant.
In cazul aciditatii apelor datorata HCO-3 sau CO2 dizolvat, ionul de aluminat neutralizeaza aciditatea conform reactiilor:
![]()
Pe de alta parte, hidroxidul de aluminiu, in exces de acid, elibereaza ioni Al3+ in solutie:
![]()
reactia stand la baza recuperarii coagulantului din namolul de la statiile de tratare.
In cazul folosirii sarurilor de aluminiu, procesul de coagulare este sensibil influentat de pH-ul apei si de temperatura. Astfel, in perioade cu temperaturi scazute, procesul de coagulare - floculare este ingreunat, formandu-se flocoane mici, greu sedimentabile.
Continutul de Al3+ rezidual sau remanent, in apa tratata, variaza in functie de doza de sulfat adaugata si de pH.
Coagularea cu sulfat de aluminiu este influentata si de tipul substantelor organice prezente in apa, mai ales de substantele humice, coagularea decurgand in acest caz la pH acid.
Adaugarea sulfatului de aluminiu in apa se face sub forma de solutii cu diverse concentratii, in functie de debitul instalatiei.
Sulfatul de aluminiu este utilizat pentru indepartarea fosforului din apa prin precipitare, conform reactiei:
![]()
Sarurile de fier sunt utilizate in cazul purificarii apelor reziduale, domeniul de precipitare al Fe(OH)3 este mai extins decat la Al(OH)3, incepand de la pH=3. In figura 8 este data distributia speciilor in functie de pH. Sarurile de fier utilizate in tratarea apei, cat si la procesul de epurare sunt:
- sulfat feros FeSO4·7H2O;
- sulfat feric Fe2(SO4)3 ·9H2O;
- clurura ferica FeCl3·6H2O;
Coagularea optima cu sulfat feros are loc in mediu alcalin, cu adaos de var. Mai intai se formeaza hidroxid de Fe2+ care este instabil si in prezenta O2 din apa se transforma in hidroxid feric, conform reactiilor:
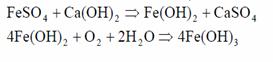
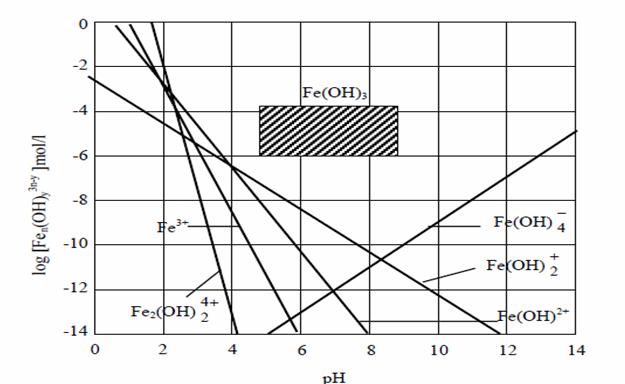
Figura 8. Compozitia de echilibru a solutiei in contact cu precipitat proaspat de Fe(OH)3 (zona hasurata reprezinta zona de lucru in tratarea practica).
Clorura ferica FeCl3ּ 6H2O se prezinta sub forma de cristale brune, foarte higroscopice, in practica utilizandu-se sub forma de solutie concentrata(40%). Utilizarea in amestec cu saruri de aluminiu in raport Al2(SO4)3/FeCl3 de 1/1, conduce la obtinerea de flocoane mari, usor sedimentabile. Se utilizeaza mai ales la tratarea apelor reziduale, pentru eliminarea fosforului.
Reactia de hidroliza a FeCl3 in prezenta HCO-3 din apele reziduale este:
![]()
In cazul utilizarii Fe2(SO4)3 reactia care are loc este urmatoarea:
![]()
Si in cazul coagularii cu saruri de fier, se formeaza ca produsi de hidroliza, specii solubile monomerice, polimerice sau specii hidroxo-metal similare cu speciile discutate de aluminiu. Prin inlocuirea succesiva a moleculelor de apa cu ioni OH- rezulta forme ionice pot fi cationice, neionice si anionice, conform reactiilor:
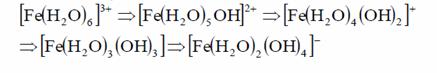
In calitate de coagulanti primari pot fi utilizate unele substante organice cu greutate moleculara mai mare de 104 cu denumire de polielectroliti organici, tip cationic. Acestia inlocuiesc total sau partial coagulantii pe baza de aluminiu si fier.
Coagulantii organici de sinteza se utilizeaza in doze de 10-50 mg/l si pot fi grupati in trei clase de compusi:
- melaminformaldehide cu formula:
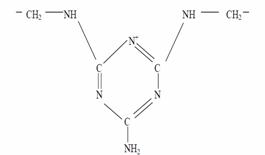
-epiclorhidrin - dimetilamina:
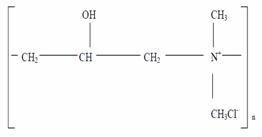
-policrorura de dialidimetil amoniu:
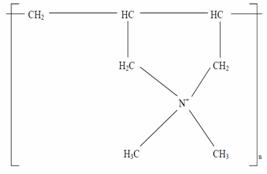
3.1.4 Coagularea electrochimica (electrocuagularea)
Electrocoagularea consta in introducerea in apa a ionilor metalici necesari coagularii, prin procesul de electroliza. Se folosesc celulele de electroliza cu anozi metalici, de aluminiu, fier, cupru. Prin procesul de dizolvare anodica, elementul metalic este trecut in stare ionica conform reactiilor:
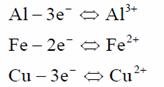
In continuare are loc reactia de hidroliza in Al(OH)3 sau Fe(OH)2:
![]()
In cazul anozilor de fier, hidroliza conduce la Fe(OH)2; Fe2+ se oxideaza pe baza oxigenului din apa sau a clorului la fier trivalent cu formarea Fe(OH)3, care coaguleaza particulele coloidale prin sorbtia acestora pe particulele coloizilor.
De remarcat este faptul ca la electrodul anod au loc si reactii secundare in afara de cea de obtinere a Al3+. Astfel, ionul clor din apa se transforma in clor gazos:
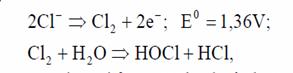
care poate reactiona si forma HCl reducand pH-ul.
La catod au loc reactii de formare atat a hidrogenului gazos, cat si a ionilor oxidril.
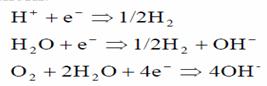
Ca urmare a acestor reactii, pH-ul apei electrocoagulate sufera modificari, unele date experimentale indicand ca pe masura ce tensiunea creste, pH-ul scade.
In scopul imbunatatirii procesului de coagulare - floculare , in tratarea apei se utilizeaza diferite substante cu efect de marire a flocoanelor si a vitezei de sedimentare. Aceste substante sunt cunoscute sub denumirea de adjuvanti . Adjuvantii utilizati in coagulare - floculare sunt de origine minerala, sau de origine organica.
Adjuvanti minerali
Din aceasta grupa fac parte:
- silicea activa (silicat de sodiu neutralizat cu H2SO4);
- silico-aluminat (silicat de sodiu activat cu sulfat de Al);
- argile (bentonita, caolin);
- nisip fin;
- carbune activ;
- carbonat de calciu;
- kiselgur (diatomee);
Silicea activa este constituita din acid polisilicic obtinut prin polimerizarea controlata a acidului silicic, obtinut prin neutralizarea silicatului de sodiu, de la pH=12 pana la pH = 9±0,2, conform reactiei:
![]()
Acidul metasilicic polimerizeaza in acid polisilicic. Obtinerea unui grad de polimerizare satisfacator se face prin diluarea solutiei, dupa timpul de activare de 2h la un pH=9±0,2. Scaderea pH-ului conduce la transformarea solului de silice in gel. Silicea activa este stabilita 24 h. Dozele folosite in tratare sunt de 0,4 - 4 mg/l SiO2 (in general 10% din doza de sulfat de aluminiu).
Silico-aluminat de sodiu este analog silicei active si se obtine prin neutralizarea silicatului de sodiu cu sulfat de aluminiu sau cu alta sare de aluminiu.
Adjuvanti organici de sinteza
Sunt macromolecule cu catene lungi, obtinute prin asocierea monomerilor sintetici, avand sarcini electrice sau grupe ionizabile. Acesti produsi au masa moleculara 104 - 105 si prezinta eficienta superioara polimerilor naturali.
Adjuvantii organici de sinteza se prezinta ca produse solide, ca emulsii (polimer in solvent organic) sau ca solutii (20 g/l in apa). In practica tratarii este necesara prepararea de solutii diluate (0,1 - 1%). Dozele utilizate sunt de 0,1-0,2 mg/l apa, in statii de tratare pentru apa potabila si doze de peste 0,5 mg/l in prelucrarea apelor uzate si a namolurilor.
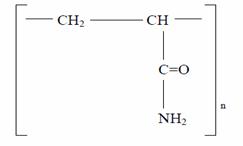
Adjuvantii organici de sinteza se clarifica in trei grupe:
- neutri (neionici) de tip policrilamida:
- anionici, care sunt de obicei copolimeri ai acrilamidei cu acid acrilic; sunt caracterizati prin existenta unui grup ce permite adsorbtia si alt grup ionizat negativ, carboxilic (-COOH) sau sulfuric (-SO3H):
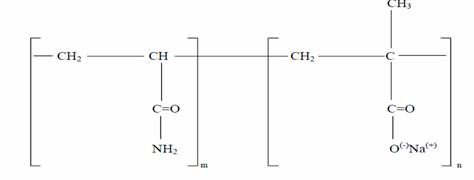
- cationici de tip copolimeri ai acrilaminei cu un monomer cationic. Ex. metacrilat de dimetilaminoetil:
Adjuvantii naturali
Adjuvantii naturali sunt polimeri naturali extrasi din substante de natura animala sau vegetala. Din aceasta categorie fac parte alginatii, amidonul , polizaharidele etc. Alginatii de sodiu sunt obtinuti din acid alginic extras din algele marine. Prezinta o structura polimerica constituita din acid mannuronic si acid glucuronic. Adjuvantii sunt eficace ca floculanti mai ales cu sarurile de fier dar dau rezultate bune si cu cele de aluminiu. Dozele utilizate sunt de ordinul 0,1-2 mg/l.
Acest proces de epurare are la baza proprietatea unor metale (mai ales solide) ca, atunci cand sunt puse in contact cu o apa mineralizata (continand saruri ionizate) sa inlocuiasca (sa schimbe) ionii din apa cu ioni proprii (prezenti in materialul insusi). Se deosebesc schimbari de cationi (cationiti) si schimbari de anioni (anioniti). In ecuatiile care urmeaza se ilustreaza mecanismul de actiune al schimbatorilor de ioni: cationitii retin cationii eliberand ioni de hidrogen (cationiti in forma H), iar anionitii retin anionii eliberand ioni OH- (anioniti in forma OH)
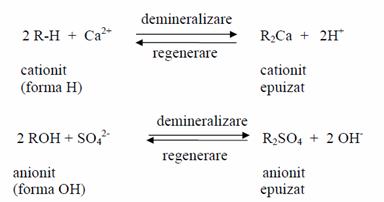
Punand apa mineralizata in contact succesiv, cu cantitati suficiente de anionit si de cationit, produsul obtinut este o apa lipsita de saruri (apa demineralizata). Reactiile prezentate mai sus sunt reversibile; prin tratarea schimbatorilor epuizati cu acizi (ioni H+) in cazul cationitilor si cu baze (ioni OH-) in cazul anionitilor, are loc regenerarea acestora, respectiv se reface cationitul in forma H si anionitul in forma OH.
In practica, schimbatorii de ioni se utilizeaza la scara mare pentru dedurizarea apelor (eliminarea ionilor de metale bivalente). In acest caz se folosesc cationiti in forma sodiu (Na), iar regenerarea lor se face cu clorura de sodiu.
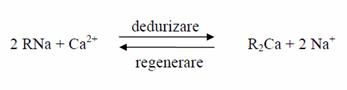
Exista doua moduri de aplicare a schimbatorilor de ioni in epurarea apelor, in sarja si in coloana. Al doilea mod este preferat. In aceasta varianta apa, eliberata in prealabil de suspensii si impuritati organice dizolvate, este trecuta peste un pat fix de schimbator sub forma de granule. In aceste conditii, schimbatorul se epuizeaza treptat dinspre zona amonte spre zona aval. In momentul epuizarii se trece la regenerarea schimbatorului introducand in coloana solutie regenerata si spaland apoi cu apa curata.
Folosirea schimbatorilor de ioni pentru demineralizarea apelor uzate se aplica numai in zonele cu deficit mare de apa, unde se impune recuperarea apei din efluentii reziduali, epurati in prealabil prin alte metode pentru indepartarea suspensiilor si a substantelor organice dizolvate. Aplicarea extinsa a procesului este limitata de costul ridicat al tratarii.
Un inconvenient important al schimbatorilor de ioni este acela al formarii unor produse de regenerare care constituie reziduuri apoase a caror evacuare finala comporta dificultati mari. Situatia se schimba atunci cand sarurile retinute pe schimbatorii de ioni si eliberate la regenerare isi gasesc o valorificare.
Neutralizarea este procesul prin care pH-ul unei ape uzate, avand valori in afara intervalului favorabil dezvoltarii florei si faunei acvatice (pH=6,5-8,5), este reglat prin adaus de acizi sau baze dupa caz. Neutralizarea apei are ca efect si micsorarea insusirilor corozive ale apei care pot determina degradarea materialelor cu care vine in contact, cum ar fi conducte, constructii si instalatii de transport sau de epurare.
Inainte de a stabili masurile de neutralizare este necesar:
- sa se epuizeze toate posibilitatile de a micsora cantitatea de acizi evacuata; prin aceasta, in afara de economia de acizi se obtine si micsorarea cheltuielilor pentru neutralizare;
- trebuie examinata posibilitatea de neutralizare reciproca, totala sau partiala, a apelor uzate acide si alcaline, rezultate din aceeasi intreprindere sau din intreprinderi invecinate. In astfel de cazuri, se prevad bazine de egalizare separate pentru apele acide si cele alcaline, bazine din care se poate realiza apoi o dozare proportionala cu debitele medii ale celor doua categorii.
Pentru neutralizarea apelor acide se poate folosi o gama larga de substante cu caracter bazic (oxizi, hidroxizi, carbonati). Alegerea neutralizantului se face in functie de natura acidului care trebuie neutralizat, de costul neutralizantului, de volumul si caracteristicile sedimentelor formate dupa neutralizare.
Neutralizantii care pot fi luati in consideratie in practica sunt: piatra de var CaCO3 si dolomita CaMg(CO3)2; varul sub forma de hidroxid de calciu CaO (lapte de var sau var stins praf); NaOH si Na2CO3. Pentru neutralizare se pot folosi si unele deseuri industriale cum sunt namolurile de la fabricile de soda, unele sterile de la preparatiile miniere, namolurile de la obtinerea acetilenei din carbid, etc.
Piatra de var (CaCO3) este unul dintre primii neutralizanti folositi pentru neutralizarea apelor acide. Dupa provenienta ei, piatra de var prezinta reactivitate variabila fata de acizii minerali. Aceasta depinde de compozitia chimica si mai ales de structura cristalina a materialului. Reactivitatea diferitelor feluri de carbonati de calciu naturali scade in ordinea: dolomita, creta, ardezie, marmura, calcar de scoici.
Filtrarea printr-un strat de calcar granular are efect de neutralizare numai in cazul apelor cu continut mic de acizi pana la 0,3-0,5 %; daca concentratia este mai mare, in afara de scaderea reactivitatii, se produce o cimentare a granulelor din patul filtrant.
Reactivitatea pietrei de var este micsorata chiar si in cazul acizilor clorhidric si azotic, daca acestia sunt prezenti in concentratii mai mari (peste 1,2 %), desi dau compusi de reactie solubili. Explicatia pare a fi aceea ca la concentratii mari de acizi rezulta o cantitate sporita de bioxid de carbon care, acoperind o mare parte din granulele de calcar, le micsoreaza suprafata de contact. Neutralizarea prin filtrare peste piatra de var nu este posibila cand in apa sunt prezenti ioni ai metalelor grele care formeaza pelicule de hidroxizi pe suprafata granulelor. Piatra de var se poate folosi la neutralizare si sub forma de pulbere care se adauga ca atare, in stare uscata, sau sub forma de suspensie apoasa.
Laptele de var (suspensie de hidroxid de calciu in apa) se foloseste la neutralizare in concentratie de 5-10% CaO. Doza de var se calculeaza astfel incat sa reprezinte circa 105% din valoarea calculata stoechiometric. In cazul neutralizarii acidului sulfuric, se recomanda ca reglarea adausului sa fie facuta astfel incat pH-ul amestecului sa fie cat mai aproape de valoarea pH=7, cand rezulta un precipitat cu granule mai mari care sedimenteaza mai repede.
Hidroxidul si carbonatul de sodiu sunt neutralizanti foarte eficienti, usor de transportat, depozitat si dozat, care duc la formarea unor sedimente mai putin voluminoase decat calcarul si varul. In schimb, costul lor este mai ridicat. Cele doua substante pot fi achizitionate ca produse solide, hidroxidul de sodiu putand fi achizitionat si sub forma de lesie concentrata.
Pentru neutralizarea apelor alcaline se pot folosi acizii reziduali rezultati din diferite procese industriale, cu conditia ca acestia sa nu contina in concentratii suparatoare alte impuritati.
Un neutralizant ieftin pentru apele uzate alcaline il constituie gazele de ardere bogate in bioxid de carbon, circa 14 % vol., care rezulta de exemplu de la centralele termice. Se poate utiliza si bioxidul de carbon imbuteliat, in acest caz, instalatia si exploatarea ei sunt foarte simple, dar cheltuielile sunt ridicate. Bioxidul de carbon pentru neutralizare poate fi produs si direct in apele uzate, prin combustie cu ajutorul unui arzator scufundat.
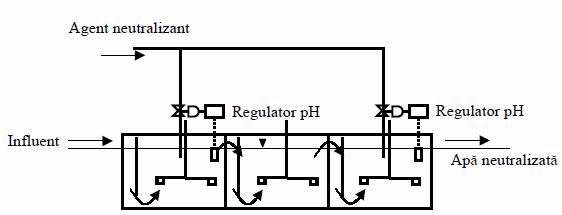
Figura 9. Instalatie de neutralizare.
Oxidarea si reducerea sunt procese in care substantele se transforma in altele ca urmare a schimbului de electroni. Despre materialele care se transforma cedand electroni se spune ca se oxideaza, iar despre cele care accepta electroni, ca se reduc, cele din prima categorie fiind materiale reducatoare, iar cele din a doua, materiale oxidante. Intrucat nu poate exista o reactie de oxidare fara o reactie cuplata de reducere, procesul in ansamblul sau este numit o reactie de oxido-reducere. Aceasta interpretare a reactiilor de oxido-reducere este aplicabila compusilor anorganici.
Scopul oxidarii in epurarea apelor uzate este de a converti compusii chimici nedoriti in altii care sunt mai putin sau deloc suparatori. In acest scop, nu este necesara oxidarea completa, de exemplu, in cazul substantelor organice, nu este necesara transformarea lor pana la bioxid de carbon, apa si alti oxizi. Oxidarea se aplica atat substantelor anorganice (Mn2+, S2-, CN- etc.) cat si celor organice (fenoli, amine, acizi humici, diverse combinatii cu insusiri toxice, bacterii etc.).
Oxidarea chimica cu oxigen din aer decurge cu viteze satisfacatoare numai la temperaturi si presiuni peste cele ordinare si, eventual, in prezenta de catalizatori. In practica se recurge la agenti oxidanti mai energici: ozonul, permanganatii, feratii, apa oxigenata, clorul si bioxidul de clor.
Oxigenul, care are o mare importanta in epurarea biologica aeroba, este introdus in apa uzata de epurat, de obicei, prin aerare. Oxigenul molecular este folosit, de exemplu, pentru oxidarea ionilor bivalenti de fier si mangan si a sulfurilor, in prezenta de catalizatori.
Ozonul este oxidant mult mai energic, capabil sa reactioneze rapid cu o gama larga de poluanti si cu microorganismele din apa. El este generat prin descarcari electrice la tensiuni inalte (5000-30000V) in aer sau in oxigen uscat, aplicand concomitent racirea pentru a evita descompunerea. Aerul si oxigenul ozonizat sunt introduse in apa prin difuzorii porosi sau prin sisteme mecanice de dispersie. In epurarea apelor uzate, ozonul este folosit pentru decolorare, dezinfectie, oxidarea partiala a unor substante nocive (fenoli, detergenti, cianuri etc.). Este de subliniat ca ozonul are o toxicitate ridicata (pentru expunere continua concentratia in aer fiind limitata a circa 0,1 mg/m3).
Permanganatii sunt oxidanti puternici folositi mai ales pentru finisarea efluentilor care au fost supusi anterior altor procese de epurare, pentru eliminarea culorii si a mirosului, oxidarea fierului, sulfurilor si cianurilor. La tratarea cu permanganati rezulta bioxid de mangan hidratat, care, pe de o parte functioneaza ca absorbant si coagulant, dar pe de alta parte necesita a fi indepartat din apa.
Clorul poate oxida eficient hidrogenul sulfurat, mercaptanii, nitritii, amoniacul, fierul si manganul, cianurile si unele substante organice. Deosebit de raspandita este distrugerea cianurilor cu clor pana la formare de cianati sau chiar de azot molecular, conform reactiilor:
CN- + OCI- → CNO- + Cl-
2 CNO- + 3 OCl- → N2 + 2 HCO3- + 3 Cl-
Un dezavantaj al folosirii clorului la tratarea apelor care contin substante organice este formarea compusilor organici halogenati cu nocivitate ridicata. Acest efect este eliminat in cazul folosirii bioxidului de clor, care, datorita stabilitatii sale scazute, se prepara in situ.
In afara clorului molecular, pentru epurarea se utilizeaza si alte produse cu continut de clor activ, cum ar fi hipocloritii de sodiu si de calciu, clorura de var, cloraminele.
Ca si oxidarea poluantilor, reducerea este folosita pentru transformarea unor poluanti cu caracter oxidant, nociv, in substante inofensive sau care pot fi indepartate din apa prin aplicarea altor procese de epurare. Un caz tipic este reducerea cromului hexavalent la crom trivalent in vederea precipitarii acestuia ca hidroxid, conform reactiei:
(Cr2O7)2- + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + 7H2O +(SO4)2-
Reducerea se poate face cu fier bivalent sau cu acid sulfuros in mediu acid.
Agentii reducatori folositi curent in practica sunt sarurile fierului bivalent, sulfitii, acidul sulfuros si alte combinatii cu sulf la valente mai mici decat 6, fierul metalic in mediu acid.
Precipitarea este procesul de epurare bazat pe transformarea poluantilor din apele uzate in produsi greu solubili. Precipitarea este, de regula, rezultatul unor reactii chimice din care rezulta substante mai greu solubile, dar ea poate avea loc si in urma schimbarii unor conditii fizice, cum ar fi suprasaturarea unei ape prin concentrare, micsorarea solubilitatii unor substante organice prin sporirea concentratiei de electroliti, micsorarea solubilitatii unei sari prin marirea concentratiei unuia dintre ionii care o compun respectiv a ionului cu nocivitate scazuta. In legatura cu acest ultim exemplu, este ilustrativa marirea eficientei de indepartare a fluorurilor din apa, la precipitarea lor ca fluorura de calciu, prin introducerea de ioni de calciu, eventual prin adaus de CaCl2.
Acest adaus deplaseaza echilibrul in favoarea transformarii unei cantitati mai mari de ioni F- in fluorura de calciu greu solubila, conform reactiei:
2 F- + Ca2+ → CaF2 (precipitat)
Precipitarea chimica se aplica frecvent la indepartarea din apa a ionilor metalelor grele, avand in vedere ca acestia formeaza hidroxizi cu solubilitate scazuta la anumite valori ale pH-ului
In tabel sunt prezentate valori ale pH-ului la care solubilitatea hidroxizilor unor metale scade sub anumite limite, precum si diversi poluanti si reactivii care pot fi utilizati pentru precipitarea lor.
Tabelul 3. Poluanti care pot fi indepartati prin precipitare
Poluantul
Agentul de precipitare
Produsii obtinuti
Cianuri
Saruri de fier bivalent
-ferocianuri greu solubile, slab disociate, cu nocivitate scazuta
Saruri ale metalelor alcaline
Var, hidroxizi alcalini
Sulfati
-carbonat de calcu si hidroxid de mangneziu greu solubili
-formare de sulfati greu solubili(ex. BaSO4)
Saruri ale unor metale grele
Xantati
Sulfuri solubile
Proteine (deseuri de par, coarne, copite, sange)
-xantati metalici (ex.Ca)
-sulfuri insolubile (de Hg, Cd)
-combinatii greu solubile (ex. pentru indepartarea Hg)
Sulfuri
Saruri sau hidroxizi de fier
-sulfura de fier greu solubila
1. World water balance and water resources of Earth, UNESCO, Paris, 1978;
2. Robescu, D., Robescu, Diana, Procedee, instalatii si echipamente pentru epurarea apelor, Litografia UPB, Bucuresti, 1996;
3. Cocheci V., Popp V. I., Probleme actuale ale protectiei, tratarii si epurarii apelor, Simpozion p.9, Timisoara, 1984;
4. Stoianovici, S., Robescu, D., 'Procedee si echipamente mecanice pentru tratarea si epurarea apei', Ed.Tehnica, Bucuresti, 1983;
5. Beychok ,M.R., Aqueous Wastes from Petroleum and Petrochemical Plants", volum 22, nr.7, John Wiley Sons, London, 1967.