
|
|
|
Potentialul chimic
Relatiile din §5 si §6 sunt valabile numai pentru sisteme inchise, in care masa componentelor ramane constanta.
Pentru o faza deschisa cu c
componente, ecuatiile variatiilor infinitezimale ale functiilor
termodinamice devin (daca lucrul mecanic elementare este dat de ![]() ):
):
![]() (XIV.42)
(XIV.42)
![]() (XIV.43)
(XIV.43)
![]() (XIV.44)
(XIV.44)
![]() (XIV.45)
(XIV.45)
unde ![]() , potentialul chimic al componentului i din sistem, este
definit ca marimea partial molara a functiilor
termodinamice:
, potentialul chimic al componentului i din sistem, este
definit ca marimea partial molara a functiilor
termodinamice:
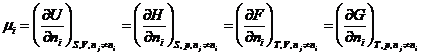 (XIV.46)
(XIV.46)
Pentru un proces la presiune si temperatura constante:
![]() (XIV.47)
(XIV.47)
si la echilibru:
![]() (XIV.48)
(XIV.48)
Entalpia libera a unei faze este data de relatia:
![]() (XIV.49)
(XIV.49)
Ecuatia de tip Gibbs-Duhem, la presiune si temperatura constante, este:
![]() (la p si t constante) (XIV.50)
(la p si t constante) (XIV.50)
Relatiile aplicate lui μ sunt de forma identica cu cele cunoscute pentru entalpia libera.
Deoarece G = H - TS, conform expresiilor cunoscute pentru H si S (ecuatia (XIV.7)), in cazul unui amestec de gaze perfecte, se obtine:
![]()
si astfel
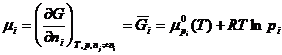 (XIV.51)
(XIV.51)
Deoarece ![]() si
si ![]() , se obtin imediat expresiile:
, se obtin imediat expresiile:
![]() (XIV.52)
(XIV.52)
![]() (XIV.53)
(XIV.53)
Potentialul chimic pentru un component al unei solutii ideale lichide este dat de relatia:
![]()
In aceste ecuatii μ0 corespunde potentialului chimic standard (v. Cap. XIV si XIX).
Exemplul 17. O solutie ideala prezinta trei proprietati caracteristice: aditivitatea volumelor, termoneutralitatea (caldura de diluare este 0) si conformarea cu legea lui Raoult (prin generalizare, presiunea de vapori a unui component din solutie este egala cu produsul dintre fractia molara si presiunea de vapori a lichidului pur).
Sa se arate ca aceste trei proprietati decurg, in mod necesar, din ecuatia potentialului chimic de forma:
![]()
Rezolvare:
Conform ecuatiei cunoscute (XIV.13), se obtine:
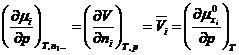
de unde rezulta ca, la temperatura si presiune
constante, volumul partial molar ![]() este o constanta,
independenta de compozitia solutiei, deci volumul solutiei
se poate calcula din suma volumelor componentelor.
este o constanta,
independenta de compozitia solutiei, deci volumul solutiei
se poate calcula din suma volumelor componentelor.
A doua proprietate rezulta din ecuatia (XIV.37):
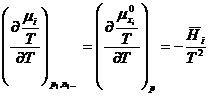
si deci, la temperatura si presiune constante, entalpia
partial molara ![]() este o constanta,
deoarece nu depinde de compozitie (caldura de diluare este
nula).
este o constanta,
deoarece nu depinde de compozitie (caldura de diluare este
nula).
Legea lui Raoult (generalizata) rezulta din ecuatia de echilibru dintre vapori si solutie:
![]()
La temperatura si presiune
constante pi = const · xi si deoarece ![]() ,
, ![]() (presiunea de vapori a
componentului pur), se obtine:
(presiunea de vapori a
componentului pur), se obtine:
![]()
Exemplul 18. Sa se calculeze ΔG, ΔH si ΔS la formarea unui amestec dintr-un 1 mol O2 cu 1 mol N2 la presiune si temperatura constante, daca fiecare gaz se afla, inainte de amestec, la 25 oC si presiunea de 1 atm.
Rezolvare:
Utilizand, pentru fiecare gaz, ecuatia
potentialului chimic ![]() se obtine (i = 1
sau 2):
se obtine (i = 1
sau 2):
![]()
Rezulta, pentru amestec:
![]()
Deoarece, pentru gaze perfecte ![]() , rezulta:
, rezulta:
![]()
Problema se rezolva si utilizand
ecuatiile ![]() si
si ![]() , unde
, unde ![]() .
.
Exemplul 19. Sa se calculeze lucrul minim de separare WS in componente pure a 1000 g solutie 18% de glucoza in apa, la 100 oC (la aceeasi presiune).
Rezolvare:
Entalpia libera a solutiei este
data de ecuatia ![]() (indicii 1 si 2
se refera la apa, respectiv glucoza).
(indicii 1 si 2
se refera la apa, respectiv glucoza).
Considerand solutia ideala,variatia de entalpie libera de amestec este:
![]()
si lucrul maxim de amestec este definit prin ecuatia:
![]()
iar lucrul minim de separare, prin ecuatia:
![]() (a)
(a)
Solutia contine:
![]() si
si ![]()
iar fractiile molare sunt:
![]() si
si ![]()
Inlocuind valorile numerice in ecuatia (a), se obtine pentru lucrul de separare:
![]()