
|
|
|
Definitii
Se numeste sistem un domeniu separat de mediul inconjurator si in care actioneaza aceleasi legi fizico-chimice.
Sistemul de dispersie reprezinta un amestec alcatuit din doua componente:
componenta dispersanta (mediul de dispersie, solventul);
componenta dispersata (dispersa, dispersoidul, solvitul).
Componenta dispersata reprezinta elementul activ, iar componenta dispersanta, elementul relativ pasiv (relativ, deoarece, asa cum vom vedea, influenteaza caracteristicile sistemului).
Clasificare
Exista mai multe criterii de clasificare a sistemelor de dispersie, in functie de caracteristicile si de modul de comportare.
Gradul de dispersie (Wolfgang Ostwald). Se numeste grad de dispersie inversul diametrului particulei dispersate.
= 1/d
> 109 m-1 = solutie moleculara: invizibila la microscopul optic si la ultramicroscop;
107 m-1 < < 109 m-1 = sistem coloidal (coloid): vizibil la ultramicroscop;
< 107 m-1 = suspensie: vizibila la microscopul optic sau chiar cu ochiul liber (Fig. 1).
Fig. 1. Gradul de dispersie si vizibilitatea particulelor
Clasificarea lui Ostwald presupune particulele dispersate ca fiind sferice, deci nu se poate aplica in toate cazurile (exemplu: molecula unei hidrocarburi saturate, cum este C100H202, are o lungime de 12,5 nm si un diametru de 0,15 nm; ea formeaza solutii moleculare).
Sistem monodispers si sistem polidispers.
Sistem monodispers: contine particule avind dimensiuni de acelasi ordin de marime;
sistem polidispers: contine particule cu dimensiuni de ordine de marime diferite.
Densitatea de atomi (H. Staudinger) se refera la numarul de atomi (n) cuprinsi in particula dispersata:
n < 103 atomi = solutie moleculara;
103 < n < 109 atomi = coloid;
n > 109 atomi = suspensie.
Criteriul fazelor. Faza reprezinta o parte omogena a unui sistem, marginita de celelalte parti prin suprafete la nivelul carora are loc o variatie brusca a proprietatilor fizico-chimice. Zona de separatie poarta numele de interfata.
Sisteme monofazice: cuprind o singura faza; nu au discontinuitati; sunt omogene.
Sisteme polifazice: cuprind zone de discontinuitate, la nivelul carora se manifesta fenomene de interfata; sunt heterogene.
Cu terminologia de mai sus, faza poate fi definita ca portiune omogena a unui sistem heterogen.
In Tabelul 1 e sistematizata clasificarea sistemelor de dispersie in solutii moleculare, coloizi si suspensii, iar in Tabelele 2 si 3 sunt indicate diversele combinatii posibile ale sistemelor mono si respectiv polifazice, in functie de starea de agregare a celor doua componente.
Starea de agregare a componentelor sistemului de dispersie (dispersanta si dispersata) poate fi oricare: gazoasa, lichida, solida. In raport de caracteristicile si interactiunea dintre componente, se formeaza sisteme mono ori polidisperse.
Tabelul 1. Clasificarea sistemelor de dispersie
Criteriul
Solutii moleculare
Coloizi
Suspensii
Autor
Grad de dispersie (m-1)
D > 109
109 > D > 107
D < 107
W. Ostwald
Numar de particule
n < 103
103 < n < 109
n > 109
H. Staudinger
Criteriul fazelor
monofazice
polifazice
Tabelul 2 Sisteme disperse monofazice (solutii moleculare)
gaz
gaz
orice amestec gazos
lichid
exemplu: vapori in aer
lichid
gaz
orice gaz in lichid
lichid
lichide miscibile
solid
exemplu: solutii de electrolit
solid
solid
unele aliaje
Tabelul 3. Sisteme disperse polifazice
Mediul de dispersie
Faza dispersata
gaz
lichid
ceata
nori
aerosoli
solid
fum
aerosoli
lichid
gaz
spuma
lichid
emulsie (lichide nemiscibile)
solid
sol
coloid
suspensie
solid
gaz
spuma solida
lichid
gel
solid
aliaje
Concentratia
Compozitia cantitativa a sistemelor de dispersie (concentratia) poate fi exprimata in mai multe moduri:
Concentratie molara (molaritate): numarul de moli de solvit la 1 litru de solutie.
Concentratie molala (molalitate): numarul de moli de solvit la 1 kg de solvent.
Concentratie procentuala:
de masa: grame de solvit la 100 grame de solutie;
volumica: grame de solvit la 100 ml de solutie.
Fractie molara: numarul de moli de solvit raportat la numarul total de moli ai solutiei; suma fractiilor molare ale tuturor componentelor este egala cu unu.
Concentratie normala (normalitate): pentru solutii de electroliti reprezentind numarul de echivalenti de solvit la 1 litru de solutie (un echivalent este egal cu cantitatea de substanta care contine un numar NA - numarul lui Avogadro - de sarcini electrice elementare).
Unitatea de masura a concentratiei in Sistemul International (SI) este kmol/m3.
Caracteristici generale
Gradul de dispersie: > 109 m-1 (d < 10-9 m).
Sunt sisteme omogene, monofazice.
Starea de agregare a mediului dispersant:
gazoasa - orice amestec de gaze;
lichida - importante pentru medicina; se vor studia in detaliu;
solida.
Solubilitatea
Unele substante sunt miscibile (formeaza faze omogene) in orice proportie. In alte situatii, solventul poate dizolva cantitati limitate dintr-o substanta solida, peste care cantitate solvitul precipita. Cind solutia atinge aceasta limita se numeste saturata. Concentratia solutiei saturate reprezinta solubilitatea substantei respective si poate fi exprimata in oricare din unitatile de masura ale concentratiei. Saturatia este o stare de echilibru, ascultind de legile termodinamice ale echilibrului. Solubilitatea depinde de: natura solventului, natura solvitului, temperatura, uneori si presiune, deci de interactiunea dintre solvent si solvit. Solubilitatea e cu atit mai mare cu cit interactiunea dintre moleculele de solvent si de solvit e mai puternica (se pot forma mai multe legaturi). Pentru realizarea unei solutii e necesar ca fortele de atractie dintre moleculele celor doua componente (dispersa si dispersanta) sa fie mai mari sau cel putin egale cu cele dintre moleculele solventului insusi. Daca aceasta conditie e indeplinita, solutia se formeaza in mod spontan, moleculele solvitului fiind inglobate de catre solvent.
N.B. Pentru definirea mediului de dispersie si a substantei dispersate, se ia, in general, prin conventie, precumpanirea cantitativa. Totusi, atunci cind una din componente este apa, solventul cel mai comun, ea e considerata mediul de dispersie, chiar daca nu precumpaneste cantitativ (exemplu: solutie de alcool in apa, de concentratie 60%). Se numesc solutii apoase si sunt de cea mai mare importanta in medicina.
Dizolvarea gazelor
In cazul in care un gaz e in contact cu un lichid, o parte din gaz trece in lichid (datorita agitatiei termice), formind cu acesta o faza unica: solutia de gaz in lichid. Este un fenomen pur fizic si se numeste dizolvarea gazului in lichid.
Legea lui Henry. Cantitatea de gaz ce se dizolva in unitatea de volum de lichid este proportionala cu presiunea gazului sau cu presiunea partiala a fiecarui gaz, atunci cind e vorba de un amestec de gaze. Se numeste coeficient de solubilitate volumul de gaz (redus la 0 °C si 1 atm) care se dizolva, in conditii date, intr-un litru de lichid. Coeficientul de solubilitate scade cu temperatura (la fierbere, gazele sunt total eliminate din lichid).
Dintre gazele ce formeaza aerul atmosferic, cel mai mare coeficient de solubilitate il are CO2, atit in apa cit si in diversele lichide biologice (singe, plasma etc.).
Dizolvarea gazelor in singe si in tesuturi
Conform legii lui Henry, cantitatea de gaze dizolvate depinde de presiunea lor partiala in amestecul gazos inspirat. La cresterea presiunii (hiperbarism), dizolvarea are loc dupa o lege exponentiala (mai intii rapid, apoi din ce in ce mai lent), constanta de timp a procesului fiind o caracteristica a mediului, atit la compresie cit si la decompresie. Exista, din acest punct de vedere, tesuturi rapide si tesuturi lente. Apare astfel un disbarism intre diferite tesuturi, ca si intre singe si tesuturi, important in special la decompresie (exemplu: in situatia revenirii la suprafata a scafandrilor).
Efectele disbarismului la decompresie. Eliminarea gazelor inerte (N2, He, H2) la decompresie fiind mai rapida din singe decit din tesuturi, la o decompresie brusca acestea ajung sa fie suprasaturate, ceea ce determina aparitia unor bule de gaz (emboli), ce produc tulburari cunoscute sub denumirea de "boala de decompresie". Pot aparea accidente grave datorita localizarii embolilor gazosi la nivelul arterelor creierului si maduvei spinarii. Aceste accidente pot fi evitate printr-o decompresie lenta, dupa anumite reguli foarte precise, caz in care gazele dizolvate in tesuturi trec in singe, acesta drenindu-le in plamini, de unde se elimina.
Efectele toxice ale hiperbarismului. Hiperoxia (cresterea presiunii de oxigen) peste 1,7 105 N/m2 are urmari toxice asupra sistemului nervos central, manifestate prin greata, ameteli, convulsii; mecanismul de actiune nu e complet elucidat, un rol important avindu-l formarea de radicali liberi. Efectul e cu atit mai pronuntat cu cit hiperoxia e de durata mai mare.
Cresterea presiunii gazelor inerte determina ceea ce se numeste "betia adincurilor"; are simptome similare primelor stadii ale narcozei. Gazele actioneaza asupra sistemului nervos central, mecanismele moleculare nefiind deplin cunoscute. Efectul narcotic al diferitelor gaze variaza in ordinea He < H2 < N2 < Ar, de unde utilizarea He in amestecul gazos furnizat scufundatorilor la peste 60 m adincime.
CO2 la suprapresiuni mici are un efect stimulator; cresterea presiunii duce la acumularea CO2 in tesuturi, deci la acidoza; toxicitatea este importanta la suprapresiuni mari, ceea ce determina excluderea CO2 din amestecul inspirator destinat scufundatorilor.
La punerea in contact a unui solid cu un lichid, pot aparea doua situatii distincte:
Solidul este solubil si formeaza un amestec omogen (faza unica). Dizolvarea este posibila pina la o anumita concentratie, corespunzatoare saturarii solutiei. Spre deosebire de gaze, solubilitatea creste cu temperatura.
Solidul este insolubil si ramin doua faze distincte. De fapt, insolubilitatea absoluta e rara, intotdeauna existind un numar mic de molecule dizolvate.
Solubilitatea depinde de legaturile intermoleculare din solid si respectiv din lichid ca si de interactiunile posibile lichid-solid. Exemplu: hidrocarburile nu sunt solubile in apa deoarece moleculele apei sunt legate prin punti de hidrogen, iar ale hidrocarburilor prin legaturi van der Waals. Din cauza naturii diferite a acestor forte, nu se pot forma legaturi intre moleculele solventului si ale solvitului. Moleculele de zaharoza sunt unite, in stare cristalina, prin legaturi de hidrogen. In contact cu apa, se formeaza tot punti de hidrogen intre moleculele de apa si de zaharoza, deci zaharoza se dizolva in apa.
Interactiunea solvent-solvit modifica proprietatile fizice ale solutiei. Exemplu: punctul de fierbere al unei solutii creste, iar punctul de congelare scade proportional cu concentratia. Cresterea temperaturii de fierbere la dizolvarea unui mol de substanta in 1 litru de solutie se numeste constanta ebulioscopica. Scaderea punctului de congelare la dizolvarea unui mol de substanta in 1 litru de solutie poarta numele de constanta crioscopica.
Electroliti
Electrolitii sunt substante formate din ioni pozitivi si ioni negativi si nu din molecule neutre. Exemplu: NaCl - in stare solida, in nodurile retelei cristaline se gasesc ioni de Na+ si Cl-. Dizolvarea e insotita de disocierea electrolitica, deci in solutie se vor afla sarcini electrice libere (ioni pozitivi si ioni negativi), formind solutii de electrolit. O astfel de solutie e buna conducatoare de electricitate.
Disocierea electrolitica
In reteaua cristalina, ionii sunt mentinuti in pozitii fixe datorita fortei de atractie electrostatica, data de legea lui Coulomb.
![]()
unde 0 este permitivitatea vidului.
In solutie, forta de atractie dintre ioni scade datorita permitivitatii solventului, care e supraunitara ( = 0 r).
![]()
Permitivitatea relativa (constanta dielectrica) a apei este foarte mare (r 80), ceea ce determina o scadere accentuata a fortei de interactiune dintre ioni.
In plus, molecula apei avind o structura dipolara, ionii sunt atrasi de polul de semn opus al moleculelor de apa.
Cele doua fenomene suprapuse determina si faciliteaza disocierea electrolitului (Fig. 2).
Fig. 2. Efectul dipolului apei asupra disociatiei electrolitice
N.B. Permitivitatea creste cu momentul dipolar al moleculelor mediului.
Gradul de disociere. Reactia de disociere a unui electrolit AB se poate scrie sub forma:
AB ![]() A+ + B-
A+ + B-
in care A+ si B- reprezinta ionii rezultati (pentru simplificare, am scris relatia in cazul unor ioni monovalenti).
Conform legii actiunii maselor:
![]()
in care K este constanta de disociere; ea este o caracteristica a substantei si defineste echilibrul dintre moleculele neutre si cele disociate (in cazul unui electrolit).
Se numeste grad de disociere raportul dintre numarul n de molecule disociate si numarul total de molecule dizolvate din solutie (n0).
![]()
Pornind de la gradul de disociere, se poate face o clasificare a electrolitilor in:
electroliti tari, complet disociati in solutie apoasa;
electroliti slabi, partial disociati in solutie apoasa.
Gradul de disociere depinde de constanta de disociere si de concentratia totala. Gradul de disociere creste cu dilutia (scaderea concentratiei). La dilutie infinita (C 0), electrolitii (chiar cei slabi) sunt total disociati.
Conductivitatea solutiilor de electrolit
Conductivitatea este inversul rezistivitatii.
![]()
si se masoara in -1 m-1.
Conductivitatea depinde de: concentratia purtatorilor de sarcina liberi (ioni), valenta ionilor, mobilitatea ionilor, caracteristicile solutiei. Pentru a putea compara conductivitatea diferitelor solutii, trebuie definita o marime care sa se refere la o anume cantitate de substanta dizolvata. Aceasta marime se numeste conductivitate echivalenta () si reprezinta raportul dintre conductivitatea solutiei si concentratia ei normala.
![]()
in care CEq reprezinta concentratia exprimata in echivalenti/litru de solutie (CEq = C n; C = concentratia molara, iar n = valenta).
Conductivitatea echivalenta depinde de concentratie, deoarece nu e proportionala cu concentratia. La scaderea concentratiei, L creste, tinzind spre o valoare maxima la dilutie infinita, notata cu L . Este o caracteristica a substantei.
C 0; L L
Variatia conductivitatii echivalente depinde de tipul de electrolit. In cazul electrolitilor slabi, L e mic si variaza puternic cu concentratia, datorita cresterii numarului de molecule disociate la marirea dilutiei. In cazul electrolitilor tari, L e mare, data fiind disocierea totala; scade usor la concentratii mari datorita interactiunii dintre ioni si scaderii mobilitatii ionilor.
Cum intr-o solutie de electrolit sunt intotdeauna atit ioni pozitivi cit si ioni negativi, L e suma conductivitatilor, la dilutie infinita, a celor doi ioni,
L L L
datorita faptului ca, la dilutie infinita, ionii nu se influenteaza reciproc (legea miscarii independente a ionilor la dilutie infinita). Conductivitatea fiecarui ion, la rindul ei, depinde de mobilitate, in general diferita la anioni si la cationi.
Gratie interactiunii dintre ioni, doar o fractiune f din concentratia totala de ioni din solutie poate participa liber la conductie. f se numeste coeficient de activitate.
Produsul dintre coeficientul de activitate si concentratie poarta numele de activitate (a).
a = f C
Daca interactiunea dintre ioni e slaba, f 1,
a C
Cimpul electric generat de ioni in solutie depinde de concentratie, de valenta si de interactiunea cu alti ioni. Pentru a se tine seama de toti acesti factori, s-a introdus o marime numita tarie ionica (I), definita ca:
![]()
in care Ci si ni reprezinta concentratia si respectiv valenta diferitilor ioni din solutie.
Solvatarea ionilor. Datorita interactiunii electrostatice dintre ioni si moleculele polare ale solventului (apei), fiecare ion se inconjoara de o atmosfera de molecule de solvent (Fig. 7), proces numit, asa cum am vazut (vezi Apa), solvatare (hidratare, in cazul apei). La deplasarea in solutie, ionul antreneaza si moleculele de apa de hidratare, influentind mobilitatea ionului. Hidratarea anionilor e, de regula, diferita de cea a cationilor.
In Tabelul 4 sunt date concentratiile ionice aproximative ale plasmei sanguine. Pe baza lor se poate calcula taria ionica a plasmei. Se obtine I = 0,145.
Tabelul 4 Concentratiile ionice din plasma
Ionul
C (Eq/l plasma)
Na+
0,142
K+
0,005
Ca++
0,00125
Mg++
0,001
Cl-
0,103
HCO3-
0,027
HPO4-
0,001
Fenomene la nivelul electrozilor
Daca se introduce intr-un electrolit un electrod metalic, de exemplu o placa de Zn, ionii metalici de Zn++ au tendinta de a penetra in solutie. Nu e vorba propriu-zis de o dizolvare a metalului; ionii sunt atrasi de forte electrostatice. In consecinta, pierzind sarcini pozitive, electrodul se incarca negativ si va atrage ioni pozitivi din solutie. Se formeaza astfel un dublu strat electric si fenomenul inceteaza.
Fig. 3 Formarea dublului strat electric la electrozi
a mm > ms; b. mm < ms.
In cazul in care solutia contine ionii metalului din care e confectionat electrodul, patrunderea ionilor in solutie depinde de potentialul chimic (vezi fenomene de transport. Difuzia) la care ei se afla in electrod (µm; caracteristica a metalului) si in solutie (µs; dependent de activitatea lor). Daca potentialul chimic al ionilor in solutie este mai mare (µs > µm), acestia sunt atrasi de electrod, care astfel se incarca pozitiv.
In ambele situatii, diferenta de potential ce se stabileste intre electrod si solutie, numita potential de electrod, se poate calcula din conditia ca variatia de energie datorita dublului strat electric sa echilibreze variatia de energie data de diferenta de potential chimic.
Se obtine:
![]()
in care: a = activitatea ionului metalic din solutie;
V0 = potentialul normal de electrod, egal cu diferenta de potential metal-solutie cind a = 1, determinat de natura metalului; metalele alcaline au un potential normal puternic negativ, deci trec in solutie.
Masurarea absoluta a acestui potential nu e posibila, deoarece implica existenta unui al doilea electrod de masura, care determina un nou potential de electrod. Se poate face o determinare relativa, fata de un electrod de hidrogen, al carui potential normal e considerat, prin conventie, nul. El reprezinta diferenta de potential dintre un electrod de hidrogen gazos, la presiunea atmosferica normala, si o solutie care contine ioni de hidrogen cu activitatea egala cu unu (Fig. 4).
Fig. 4. Electrodul de hidrogen
In cazul in care solutia nu contine ionul metalului din care e confectionat electrodul, potentialul de electrod e instabil si nu poate fi calculat.
La introducerea in solutie a doi electrozi din metale diferite, intre acestia apare o diferenta de potential egala cu suma algebrica a celor doua potentiale de electrod. Daca se leaga intre ei un fir conductor exterior, va circula un curent electric. S-a format astfel o pila electrica.
Pila electrica este o sursa care genereaza o tensiune electromotoare intr-un sistem ce cuprinde electroliti. Ea poate fi de doua feluri:
pila chimica: la electrozi se produc reactii chimice;
pila de concentratie: energia electrica e produsa de transferul solvitului de la o concentratie la alta. Pile electrice pot apare la protezari cu metale diferite.
Polarizarea electrozilor altereaza rezultatele masuratorilor pentru care sunt folositi electrozii, deoarece tensiunii ce urmeaza a fi masurata i se adauga potentialul de electrod. Pentru a evita acest lucru, se construiesc electrozi nepolarizabili. Ei trebuie sa cuprinda ioni existenti in solutie. In sistemele biologice, ionii cei mai frecventi sunt: Na+, K+, Ca++, Mg++. Din aceste metale nu se pot construi electrozi, deoarece au potentiale normale puternic negative si se dizolva in solutie.
Intre electrod si solutie se interpune un intermediar care poate schimba ioni atit cu electrodul propriu-zis cit si cu solutia. Rezultatele cele mai bune se obtin daca solutia intermediara are un cation comun cu electrodul si un anion comun cu solutia. Exemplu: electrod de argint clorurat (Ag-AgCl) sau electrod de calomel (Hg-HgCl2).
Potentialul de oxido-reducere (redox)
Fenomenul de oxido-reducere consta in reactii in care o particula (atom, molecula sau ion) schimba electroni cu o alta particula. Pierderea de electroni se numeste oxidare.
M M + e M+ M++ + e M M + e etc.
Reactia inversa, in care particula primeste electroni se numeste reducere.
M + e M M+ + e M M++ + e M+ etc.
In general se noteaza cu Ox forma oxidata si cu Red forma redusa a aceleiasi substante.
Red Ox + ne (oxidare)
Ox + ne Red (reducere)
Cele doua reactii reprezinta componentele unei reactii generale de echilibru, numita de oxido-reducere.
Red ![]() Ox + ne
Ox + ne
In aceasta reactie electronii au un rol analog ionilor, deci se poate scrie ecuatia de echilibru, conform legii actiunii maselor:
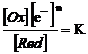
Ansamblul formelor redusa si oxidata ale aceleiasi substante formeaza un sistem de oxido-reducere (sistem redox).
Transferul de electroni determina aparitia unei diferente de potential, numita potential de oxido-reducere sau potential redox.
![]()
in care V0 e potentialul redox normal, deci in raport cu un electrod normal de hidrogen. Cu cit potentialul redox al unui sistem e mai pozitiv, cu atit sistemul respectiv e mai oxidant.
Un sistem redox foarte important in sistemele biologice si care se ia, de obicei, ca referinta este:
1/2 H2 ![]() H+ +
e
H+ +
e
In acest caz, potentialul redox va fi:
![]()
V0 fiind zero. In conditiile in care pH = 0 ([H+] = 1 M), presiunea de H2 de 1 atmosfera, V = 0 V. La 25 °C si pH = 7, rezulta:
V = -0,42 V
In cazul unui transfer de electroni intre sisteme cu potential redox diferit, are loc o variatie a entalpiei libere DG. Tinind seama de relatia dintre variatia entalpiei libere si constanta de echilibru a reactiei (vezi Elemente de termodinamica. Entalpia libera a reactiilor chimice) si luindu-se ca referinta sistemul [H2/2H+ + 2e ], rezulta:
DG = -nF DV
in care DV este diferenta potentialelor redox ale celor doua sisteme. Se observa ca variatia entalpiei libere e de semn contrar variatiei potentialului redox, deci un transfer de electroni poate avea loc spontan de la un sistem cu potential redox mai mic spre unul cu potential mai mare, ceea ce e de extrema importanta in energetica celulara (vezi Energetica celulara).
Refractia. Indicele de refractie al solutiilor variaza aproximativ liniar cu valoarea concentratiei (relatia e cu atit mai aproape de liniaritate cu cit concentratia e mai mica). Refractometria (masurarea indicelui de refractie) se utilizeaza pentru determinarea concentratiei de glucoza in urina (glicozuria), in cazul diabetului zaharat; in urina normala glucoza e absenta.
Activitatea optica. Substantele organice care au cel putin un carbon asimetric sunt optic active (rotesc planul luminii polarizate). Aceleiasi formule moleculare ii corespund structuri spatiale diferite, simetrice in oglinda, cu activitati optice diferite: dextrogira (roteste spre dreapta) si levogira (roteste spre stinga). In urma sintezei chimice, se obtin ambele variante, in proportii egale - amestec racemic. In organism, se sintetizeaza si se retine, in functie de tipul substantei, numai una din variante. Exemplu: substantele care deriva din L-glicerolaldehida (levo) fac parte din grupa L: aminoacizi. Substantele care deriva din D-glicerolaldehida (dextro) fac parte din grupa D: glucide (fructoza face parte din grupa D, desi e levogira).
Unghiul de rotatie (a) depinde de tipul substantei, exprimata printr-o marime numita putere rotatorie specifica r (marime de material ca si densitatea, rezistivitatea etc.) si de numarul de molecule active aflate pe traiectoria razei de lumina, deci, in solutie, de concentratie si de lungimea stratului strabatut (l).
a rlC
Puterea rotatorie specifica reprezinta unghiul cu care e rotita directia de polarizare de catre o coloana de solutie cu lungimea egala cu 1 m si concentratia de 1 kmol/m3.
[r]SI
= ![]()
Rezulta ca, masurind unghiul de rotatie, se poate determina concentratia substantei. Dispozitivul se numeste polarimetru.
Absorbtia luminii. Asa cum am aratat, absorbtia luminii corespunde excitatiei electronice (in vizibil si UV) sau moleculare (in IR), fiecare substanta avind un spectru de absorbtie specific.
Relatia cantitativa dintre intensitatea luminii emergente si a celei incidente e data de legea lui Beer-Lambert.
I = I0e-µ1C
in care: I0 = intensitatea luminii incidente;
I = intensitatea luminii emergente;
C = concentratia solutiei;
= coeficient de absorbtie (de extinctie);
l = lungimea stratului de solutie strabatut.
Pornind de la legea Beer-Lambert, se definesc doua marimi direct masurabile experimental:
T = I/I0 = transmisia;
E = -log T = extinctia.
T este o masura a energiei transmise, iar E e masura energiei absorbite in solutie. T si E sunt marimi fundamentale pentru fotometrie.
Tehnicile experimentale bazate pe absorbtia luminii in solutii sunt spectrofotometria si fotocolorimetria. Ele se bazeaza pe inregistrarea spectrului de absorbtie al solutiei si permit:
determinari calitative
identificarea substantelor pe baza spectrului de absorbtie (lungimile de unda la care apar maxime de extinctie);
precizarea naturii legaturilor chimice, bazata pe benzile de absorbtie ale diferitilor cromofori;
determinarea unor importante functii termodinamice, ca entropia si capacitatea calorica;
determinari cantitative
evaluarea cantitativa a concentratiei substantelor, pe baza legii Beer-Lambert;
determinarea puritatii unei substante.
Principalii factori care influenteaza spectrul de absorbtie al solutiilor sunt:
Natura solventului. Interactiunea dintre moleculele solventului si ale solvitului poate modifica semnificativ spectrul de absorbtie, chiar daca nu au loc reactii chimice. Efectul e important in cazul solventilor polari.
pH-ul. Virarea culorii pe care se bazeaza determinarea pH-ului arata masura in care acesta modifica spectrul de absorbtie. Cind in solutie se afla un amestec de doua substante ce se pot transforma una in alta, curbele de extinctie pentru diferite pH-uri se intersecteaza intr-un punct, numit punct izobestic (Fig. 5).
Fig. 5. Punctul izobestic
Concentratia solutiei. Legea lui Beer-Lambert este valabila la concentratii mici, unde µ e independent de concentratie. In unele solutii, in special de coloranti, se formeaza, la concentratii mari, asociatii moleculare, de obicei dimeri, ceea ce determina modificari importante ale spectrului de absorbtie: apar doua puncte izobestice, pentru monomer si pentru dimer.
Temperatura. Agitatia termica limiteaza formarea dimerilor, deci are o influenta contrara cresterii concentratiei.
Iradierea substantei. Iradierea in UV sau in vizibil poate determina reactii fotochimice si, in consecinta, deplasarea curbelor de absorbtie.
Fotoluminiscenta. Randamentul emisiei fluorescente variaza cu valoarea concentratiei: este nula la dilutie infinita, creste rapid la cresterea concentratiei, atingind un maxim (optim de fluorescenta), dupa care scade din nou, dat fiind ca ciocnirile dintre moleculele solutiei pot determina dezactivari neradiative (Fig. 6).
Fig. 6. Variatia fluxului fluorescent cu valoarea concentratiei
Cm = concentratia corespunzatoare optimului de fluorescenta.
Caracteristici generale
Gradul de dispersie: 107 m 1 < D < 109 m 1 (10 9 m < d < 10 7 m); se vad la ultramicroscop.
Sunt sisteme heterogene, polifazice.
Starea de agregare a mediului dispersant (cf. Tabelul 3):
gazoasa;
lichida; importante pentru medicina; se vor studia in detaliu;
solida.
Apar fenomene de interfata importante si datorita ariei mari a suprafetei de contact dintre dispersoid si mediul de dispersie: W. Ostwald a calculat ca 1 cm3 de materie vie divizata in micelii cu diametrul d = 5 nm are o suprafata totala de 6 000 m2. Lumičre a stabilit ca unei suprafete a corpului de 1,5 m2 ii corespunde o suprafata micelara de 2 000 000 m2 = 200 ha!
Obtinerea de coloizi ori de solutii moleculare depinde atit de natura substantei dispersate cit si de mediul de dispersie. Exemplu: NaCl in apa da o solutie moleculara; NaCl in alcool da un coloid.
Etimologie: din termenii grecesti kolla = clei si eidos = aspect; termen creat de Graham, in 1861.
Clasificarea coloizilor
Dupa origine:
naturali;
origine animala; exemplu: lapte, albumina;
origine vegetala; exemplu: amidon;
origine minerala; exemplu: ferocianura ferica;
artificiali; exemplu: nitroceluloza in alcool si eter (fulmicoton sau colodiu), aur coloidal (cunoscut din antichitate pentru proprietatile lui curative).
Dupa consistenta:
sol - sistem coloidal in care faza dispersanta e lichida, iar faza dispersata solida; este fluid si reprezinta tipul clasic de coloid;
gel - substanta dispersata are forma unei retele spongioase in ochiurile careia se gaseste solventul; este o forma gelatinizata.
Dupa structura particulei dispersate:
micele;
macromolecule nemicelare; exemplu: cauciuc, fibre textile artificiale;
micele macromoleculare; cea mai mare parte a coloizilor biologici.
Dupa interactiunea dintre dispersat si dispersant:
liofili (hidrofili, in cazul apei); au afinitate pentru solvent;
liofobi (hidrofobi, in cazul apei); faza dispersata nu formeaza legaturi cu solventul; coaguleaza usor; exemplu: solurile de Au, Ag.
Prepararea coloizilor
Exista o serie de metode de preparare, atit fizice cit si chimice. Cea mai des utilizata este dispersarea substantei prin ultrasonare.
Interactiunea cu solventul (apa)
In contact cu apa, proteinele formeaza sisteme coloidale. Interactiunea cu solventul depinde de structura si caracteristicile macromoleculei, in special de numarul si asezarea gruparilor polare si, respectiv, a celor hidrofobe. Din acest punct de vedere, particulele coloidale proteice se impart in hidrofile si hidrofobe.
Macromoleculele hidrofile, datorita gruparilor polare pe care le contin, atrag dipolii apei formind o coroana in jurul proteinei, coroana in cadrul careia moleculele de apa sunt stratificate, astfel incit asezarea lor e din ce in ce mai dezordonata, pe masura ce creste distanta (Fig. 7). Procesul poarta numele de hidratare a macromoleculei, iar apa astfel structurata reprezinta apa legata. Hidratarea, asa cum se va vedea, este importanta in stabilitatea sistemului coloidal.
Macromoleculele hidrofobe nu au afinitate pentru apa, asa incit limita de separare dintre cele doua faze e neta.
Fig. 7. Hidratarea macromoleculelor
Stabilitatea sistemelor coloidale proteice
Datorita ariei mari a suprafetei de contact dintre faza dispersata si cea dispersanta, aceasta joaca un rol esential in stabilitatea sistemului coloidal. Intervin legaturile ce se formeaza intre cele doua faze, deci energia de suprafata.
Privit cu ochiul liber ori la microscopul optic, un sistem coloidal pare omogen. In anumite conditii, particulele se aglomereaza si devin vizibile, sub forma de flocoane, care, incet, incet, se depun; sistemul si-a pierdut stabilitatea. Fenomenul se numeste floculare si reprezinta o separare a fazelor.
Ea este cu atit mai facila cu cit afinitatea pentru mediul de dispersie e mai mica (Fig. 8).
Fig. 8. Stabilitatea sistemelor coloidale proteice
a. Particula proteica incarcata si hidratata (stabila); b. particula proteica incarcata, dar deshidratata (putin stabila); c. particula proteica descarcata, dar hidratata (putin stabila); d. particula proteica descarcata si deshidratata (foarte instabila); e. floculare.
Moleculele proteice hidrofile au in jurul lor, asa cum am vazut, o coroana de molecule dipolare de apa si de ioni anorganici din solutie, formind un dublu strat electric. Particulele avind aceeasi incarcatura electrica se resping, ceea ce duce, implicit, la stabilitatea sistemului coloidal.
Flocularea se poate obtine prin:
deshidratarea moleculelor, de exemplu prin adaugarea de electroliti care atrag mai puternic dipolii apei (e nevoie de 20 - 60% electroliti);
anularea sarcinii electrice a moleculei si deci disparitia dublului strat electric, de exemplu la pH izoelectric;
prin combinarea celor doua modalitati.
In urma flocularii, particulele precipita. Este un fenomen pur fizic. Daca prin adaugare de apa se revine la starea dispersata, coloidul se numeste reversibil.
In cazul proteinelor hidrofobe, stabilitatea sistemului e mentinuta doar de fortele de respingere electrostatica dintre molecule, fiind deci foarte sensibile la floculare. Se formeaza o pulbere anhidra, care nu mai poate reveni la starea coloidala prin adaugare de apa. Sunt coloizi ireversibili.
Stabilitatea unui sistem coloidal poate fi distrusa si prin coagulare, proces chimic, de obicei mediat enzimatic. Coagularea consta in transformarea unei proteine solubile intr-o proteina insolubila, ce realizeaza, in mediul ei, o retea solida. Exemplu: coagularea singelui este un proces complex, in care fibrinogenul solubil se transforma in fibrina insolubila; poate fi impiedicata prin adaugarea de anticoagulante, cum ar fi heparina, citratul de sodiu etc. Coagularea laptelui se datoreaza transformarii cazeinei solubile in cazeinat de calciu insolubil.
Flocularea mai e influentata si de alti factori, ca: temperatura, viscozitatea, tensiunea superficiala.
O aplicatie importanta a flocularii o reprezinta depurarea apelor de cimpie, care contin coloizi incarcati negativ ce pot fi precipitati cu Al+++ sau Fe+++.
Gelificarea
Gelificarea consta in transformarea unui sol in gel, retea solida spongioasa, in ochiurile careia se gaseste solventul.
Caracteristicile gelurilor:
Au consistenta (nu sunt fluide), ceea ce sugereaza faptul ca apa nu este libera.
Au o anumita textura: gelatina, prin intindere, devine anizotropa.
Sunt deformabile plastic, dar au si o anumita elasticitate.
Prin absorbire de apa, se umfla.
Tixotropia: trecerea gelului in sol, prin agitatie mecanica.
Adsorbtia: fenomen fizic prin care se intelege fixarea unor particule, ioni sau molecule, pe suprafata gelului.
Sinereza: reprezinta imbatrinirea gelului; apa se separa la suprafata sub forma de picaturi.
Gelificarea se produce prin: scaderea temperaturii, desicare, floculare cu electroliti, ultrafiltrare.
Proprietatile sistemelor coloidale
Proprietati optice
Difuzia luminii. La trecerea unui fascicul luminos printr-o solutie macromoleculara, o parte din lumina incidenta este imprastiata in toate directiile: difuzia (imprastierea) luminii.
Sub actiunea undei electromagnetice incidente, particulele se polarizeaza si apar dipoli electrici oscilanti. Momentul dipolar indus variaza periodic si difuzeaza in spatiu o unda secundara de aceeasi lungime de unda cu radiatia incidenta (Fig. 9).
Fig. 9. Difuzia luminii
![]() = vectorul intensitate
cimp electric al radiatiei incidente;
= vectorul intensitate
cimp electric al radiatiei incidente; ![]() = vectorul intensitate
cimp electric al radiatiei difuzate; = unghiul de
imprastiere.
= vectorul intensitate
cimp electric al radiatiei difuzate; = unghiul de
imprastiere.
Modul in care are loc difuzia depinde de caracteristicile moleculelor: dimensiuni, forma, masa moleculara, indice de refractie etc.
Pentru
particulele mici fata de lungimea de unda a radiatiei
incidente
(d l/20),
se poate considera ca toti atomii componenti sunt excitati
sincron si deci ei vor oscila in faza. In aceste conditii,
efectul se insumeaza. Este ceea ce se numeste imprastierea Rayleigh. Intensitatea luminii difuzate
variaza cu patratul intensitatii luminii incidente, cu
patratul numarului de atomi ce compun particula si cu puterea a
patra a frecventei. In consecinta, la o iradiere in lumina
alba, radiatia imprastiata apare albastra
(exemplu: albastrul cerului).
Pentru particule cu dimensiuni comparabile cu l, distantele dintre atomii extremi fiind mari, acestia nu mai oscileaza in faza si cresterea intensitatii luminii difuzate devine mai lenta. Pe masura maririi particulelor, culoarea se deplaseaza de la albastru spre rosu, deoarece lungimile de unda mai mari permit dimensiuni mai mari ale particulelor inainte de a apare fenomenul descris.
In cazul sistemelor coloidale, lumina difuzata e vizibila cu ochiul liber, solutia devenind opalescenta: fenomenul Tyndall. Efectul e cu atit mai pronuntat cu cit diferenta dintre indicii de refractie ai celor doua faze (dispersa si dispersanta) e mai mare.
Proprietati electrice
Electroforeza. Electroforeza reprezinta deplasarea macroionilor proteici sub actiunea unui cimp electric continuu.
Asa cum am vazut, un ion proteic negativ atrage polul pozitiv al moleculei de apa si ionii mici pozitivi din solutie, formind in jurul ionului o coroana: atmosfera ionica (Fig. 10), preponderant pozitiva. Atunci cind ionul se deplaseaza, el antreneaza si o parte (aderenta de macromolecula) din apa si atmosfera ionica. Unitatea cinetica va fi deci ionul proteic impreuna cu stratul aderent. Intre aceasta si masa solutiei se stabileste o diferenta de potential numita potential electrocinetic.
Fig. 10. Atmosfera ionica a unui anion proteic
Linia continua delimiteaza anionul proteic, iar linia intrerupta, atmosfera ionica aderenta.
Daca macroionul proteic se afla intr-un cimp electric continuu, el se va deplasa sub actiunea unei forte ce depinde de sarcina lui aparenta (data de sarcina proteinei si a atmosferei ionice). Acestei deplasari i se opune o forta rezistenta, datorita viscozitatii mediului. In consecinta, particula va atinge o viteza limita constanta, corespunzatoare egalitatii celor doua forte. Pentru un cimp electric de intensitate E = 1 V/m, aceasta viteza se numeste mobilitatea electroforetica si depinde de natura ionului, prin dimensiuni si numar de grupari polare, si de natura mediului, prin pH, tarie ionica si viscozitate.
Intr-un mediu coloidal, cuprinzind mai multe tipuri de proteine, fiecare va avea o anume mobilitate, deci intr-un anumit interval de timp va parcurge o alta distanta. Electroforeza permite, in felul acesta, separarea componentelor, determinarea naturii si concentratiei lor.
Caracteristici generale
Gradul de dispersie: D < 107 m-1 (d > 10-7 m); se vad la microscopul optic sau cu ochiul liber;
Sunt sisteme heterogene, polifazice;
Nu trec prin hirtia de filtru;
Sunt, in general, instabile;
Starea de agregare a mediului dispersant (cf. Tabelul 3):
gazoasa;
lichida;
solida.
Clasificarea suspensiilor
Dupa origine:
naturale; exemplu: unt, latex;
artificiale.
Dupa dimensiunea particulei dispersate:
microscopice; exemplu: sapunul (stearat de sodiu);
macroscopice; exemplu: nisip in apa.
Prepararea suspensiilor
Prepararea suspensiilor se face, in general, prin maruntire mecanica, eventual prin ultrasonare, sau folosind emulgatori (vezi infra).
Emulsiile reprezinta sisteme disperse in care ambele faze sunt lichide. De regula, ele intra in categoria suspensiilor, dar se poate atinge si un grad de dispersie mai mare, asa ca unii autori le incadreaza in sistemele coloidale (vezi Linus Pauling, Chimie generala).
Exista anumite substante, numite emulgatori, care faciliteaza emulsionarea, fara actiune mecanica. Exemplu: unele substante tensioactive ca alcoolul, sapunul, camforul. Emulgatorii sunt folositi in industria farmaceutica pentru usurarea administrarii unor medicamente grase; exemplu: untura de ficat de peste; se acopera astfel gustul si mirosul neplacute.
Stabilitatea emulsiilor
Emulsiile sunt, de obicei, instabile, particulele dispersate depunindu-se spontan. Factorii care le pot mari stabilitatea sunt, in principal, urmatorii:
tensiunea superficiala; substantele tensioactive (vezi Fenomene de interfata) au rol de emulgatori;
viscozitatea; cu cit viscozitatea mediului e mai mare, cu atit deplasarea particulelor se face mai greu si deci si aglomerarea lor e mai dificila;
densitatea; suspensiile sunt cu atit mai stabile, cu cit densitatea celor doua faze e mai apropiata;
In cazul produselor farmaceutice sub forma de suspensii, acestea trebuiesc agitate inainte de intrebuintare, pentru omogenizare.
Distrugerea emulsiilor
Distrugerea emulsiilor se refera la separarea fazelor prin aglomerarea particulelor dispersate si depunerea lor. Se poate realiza:
spontan;
chimic, prin adaugare de sapun de calciu sau de ioni polivalenti;
prin filtrare;
mecanic, prin centrifugare.
Cele trei clase de sisteme de dispersie, solutii moleculare, coloizi, suspensii, nu se gasesc separate in organism.
Singele, de pilda, este solutie, in masura in care dispune de cristaloizi (Na+, Cl-, K+, Ca++ etc.), este un coloid, intrucit cuprinde proteine (seralbumine, serglobuline, fibrinogen etc.) si suspensie, ilustrata de elementele figurate (hematii, leucocite, trombocite).
La rindul lui, lichidul cefalo-rahidian (LCR) are substante cristaloide, deci e solutie, albumine (in concentratie foarte scazuta), deci e coloid si, foarte rare (citeva pe cimpul microscopic), celule endoteliale si limfocite, deci e reprezentata si componenta de suspensie.
In consecinta, comportarea lichidelor biologice e deosebit de complexa, raspunzind proprietatilor conjugate ale tuturor celor trei clase ale sistemelor de dispersie.