
|
|
|
STRUCTURA
TRANSPORTORULUI BtuCD DIN SUPRAFAMILIA TRANSPORTORILOR ABC, CU APLICATIE
Mult studiata deja bacterie Escherichia coli, Gram-negativa detine 2 membrane de protectie (externa si interna), pe care nutrientii trebuie sa o traverseze pentru a ajunge la citoplasma si pentru a hrani celula. Nutrienti mici sunt difuzati prin membrana externain periplasma prin porii de apa filtranti ai proteinelor numite porine; in acelasi timp, transportorii activi ai membranei externe preiau nutrientii prea mari pentru a se strecura prin porine. Odata aflati in periplasma, transportorii specifici substratului, localizati in membrana interna, muta nutrientii in citoplasma.
O clasa de astfel de transportori ai membranei interne, cunoscuti sub denumirea de transportori periplasmici de legare a proteinelor, apartin casetei ABC de transportori - leganzi ai ATP-ului, suprafamilie ce cupleaza ATP-ul hidrolizat transportului activ.
Acesti transportori- proteina ABC, sunt activi la toate speciile, de la bacterie la om, mediind atat fluxul cat si efluxul diverselor elemente de compozitie celulara.
O
paleta de boli umane, cum ar fi fibroza chistica, au fost detectate
ca mutatii la nivelul genelor codificatoare a transportorilor ABC. Analiza
structurala a transportorului BtuCD, de
 Structura
transportorului de vitamina B12 reprezinta o structura dubla, "completa" a unui transportor tipic ABC, constand in 2 domenii ce
traverseaza membrana sau subunitatile BtuC si 2 casete BtuD,
leganzi ai ATP - ului. Cytoplasm
Structura
transportorului de vitamina B12 reprezinta o structura dubla, "completa" a unui transportor tipic ABC, constand in 2 domenii ce
traverseaza membrana sau subunitatile BtuC si 2 casete BtuD,
leganzi ai ATP - ului. Cytoplasm
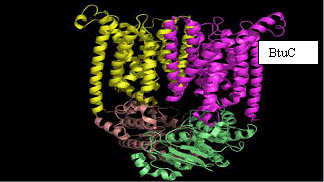
3.2 Ĺ BtuD

Prima structura completa, descrisa fost cea a MsbA, o proteina implicata in transportul lipidului A prin membrana interna a E. coli de pe partea de sinteza in citoplasma spre destinatia sa finala in membrana externa.
O analiza atenta la nivelul acestor 2 transportori demonstreaza diferente evidente: MsbA contine 6 panglici α-helicate in regiunile transmembranare, in timp ce fiecare subunitate BtuCD contine 10 helice transmembranare ce se impacheteaza intr-un model ce traverseaza prin diferite unghiuri, avand un factor care antreneaza deplierea inainte de a ajunge pe partea opusa a membranei.
Structura BtuCD dezvaluie un canal de transfer pozitionat intre subunitati suficient de larg pentru patrunderea vitaminei B12. Canalul este inchis automat la suprafata citoplasmatica de doua bucle citoplasmatice ce conecteaza α-helicele transmembranare.
Transportorii
ABC ce muta nutrientii cu greutati moleculare mici prin
membrana sunt construiti special cu doar 10 sau 14 helice
transmembranare, 12 reprezentand numarul canonic. Acesta constatare
arata faptul ca cele 20 de helice vazute
Suprafata de contact
dintre caseta si regiunea transmembranara este asemanatoare
Fig. 8. Motivele Walker A (albastru), Walker B (orange), motivul semnaturi/amprenta (rosu), bucla D (cyan), cyclotetravanadat(verde) in regiunea de legare a nucleotidelor (scene F5 - nov 28) http://www.chem.umass.edu/~cmartin/Courses/BioStruct/2005/StudentPresentations/KhadineHiggins/W_ABC_Khadine.pdf
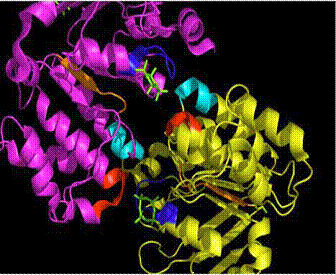 In
prima subunitate a casetei legand a ATP-ului, numita HisP, o subunitate de
permeaza histidinica de natura bacteriana, cu situsuri de
legare a nucleotidelor, definite prin motivele Walker A si B, rasucite
fata de interfata dimerului HisP.
In
prima subunitate a casetei legand a ATP-ului, numita HisP, o subunitate de
permeaza histidinica de natura bacteriana, cu situsuri de
legare a nucleotidelor, definite prin motivele Walker A si B, rasucite
fata de interfata dimerului HisP.
Ca o consecinta a acestei rasuciri, legatura ATP-ului cu HisP este expusa la suprafata, in contrast cu alte ATP-aze unde ATP-ul este ingropat intr-un buzunar.
Modelul propus de cercetatori,ca amprenta (motiv de semnatura) , Leu - Ser- Gly- Gly- Gln (LSGGQ), specific transportorilor ABC, fiecarei casete si subunitati, este un model opus altor casete de transportori cu legare de ATP.
In ce priveste acest motiv, BtuCD se aseamana structural cu Rad50 implicat in reglajul ADN, si mai putin cu MsbA, iar activarea hidrolizei ATP-ului poate fi asociata cu miscarea acestui motiv LSGGQ ce intra in contact cu fosfatii ATP-lui.
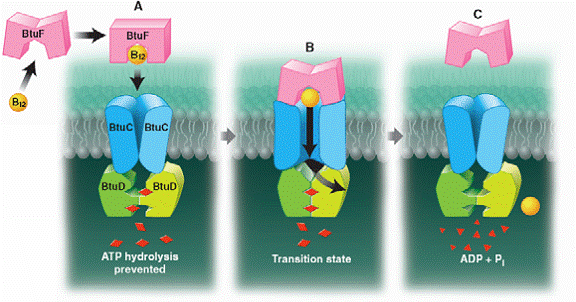
Fig.9. Model ce arata cum hidoliza ATP-ului, in casetele ATP, provoaca schimbari conformationale in domeniile transmembranare asigurand transportul vitaminei B12 in citoplasma.
Sunt eliberati ADP si Pi (fosfat anorganic), in acest proces fiind nevoie de retragerea motivului LSGGQ. Deoarece cele 2 casete de legare a ATP-ului sunt in stransa legatura cu cele 2 subunitati transmembranare, poate fi imaginat faptul ca miscarea celor 2 casete una catre alta, ca raspuns la legarea si hidrolizarea ATP-ului, s-ar putea traduce prin miscari de deschidere a portii dintre cele 2 subunitati transmembranare, permitand astfel vitaminei B12 sa intre in citoplasma prin canalul central.
Ce previne iesirea vit.B12 inapoi in periplasma? S-a demonstrat ca proteina de legatura periplasmica, maltoza, este cuplata pentru transportul acesteia in hidroliza ATP-ului.
A extrage un fragment din sistemul de transport al maltozei, interactiunile stranse de legare in sistemul Btu ce se asteapta sa se dezvolte in timpul hidrolizei ATP-ului (intre proteina-ligand BtuF si subunitatile BtuC, si intre subunitatile BtuD si moleculele ATP de pe interfata dimerului (Fig.9), pot reduce afinitatea de legare a proteinei fata de vitamina B12 la deschiderea portii catre citoplasma.
Aceste schimbari simultane vor permite vit. B12 sa se disocieze si sa intre in citoplasma, exceptand periplasma, care se afla temporar in blocaj datorita prezentei fizice a proteinei BtuF in complexul transportor.
In concluzie, diversitatea structurala a regiunilor transmembranare, demonstrate in analize ale structurii complete a transportorilor ABC, fiecare croit, specializat, pentru indeplinirea unei sarcini bine determinate, subliniaza importanta experimentelor induse la nivelul acestor transportori ABC in vederea obtinerii unei intelegeri depline a antrenarii hidrolizei ATP-ului pentru participarea in diverse procese.