
|
|
|
Legile electrolizei (legile lui Faraday)
1) In absebta unui camp electric ioni din solutiile de electrolit se misca in toate directiile, iar sub influenta unui camp electric existent io i pozitivi se indreapta spre catod iar cei negativi spre anod. In timpul electrolizei are loc pe langa schimbul sarcinii electrice si un schimb de masa. Cantitatea de substanta depusa pe electrolit depinde de cantitatea de electricitate (q) care traverseaza solitia de electrolit.
m=k*q
q- cantitatea de electricitate
k - coeficient de proportionalitate (echivalent electronic) si reprezinta cantitatea de substanta depusa pe electrolit la trecerea unitatii de cantitate de electricitate
q = 1 coulomb
q= i*t , i - intensitatea curentului, t - durata procesului
Putem spune ce cantitate s-a depus stiind q, i, t, k
A doua lege a lui Farraday (electrolizei) - se refera la cantitatea de metal depusa
m = M*i*t / z*F z - intensitatea, z - valenta ionului de metal, F- coordonata lui Faraday (F=96500), M - Masa atomica a metalului depus.
Cantitatea de metal depusa pe un electrolit este proportionala cum asa atomica a electrolitului, cu intensitatea curentului si durata procesului si invers proportionala cu valenta si nr lui Faraday.
Potentialul de electrod
 a) P>p b) P<p
a) P>p b) P<p
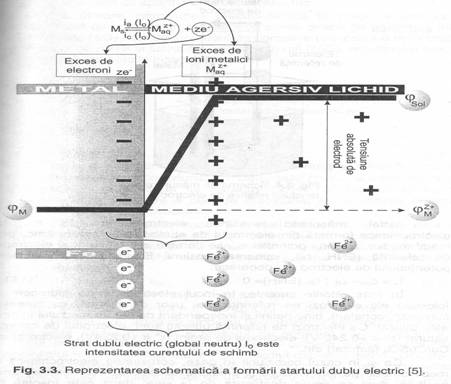
La cufundarea unei lame de matal intr-o solutie ce contine ionii metalului se intalnesc doua situatii :
a) cand concentratioa ionilor este mai mica, P>p , o parte din ioni metalici trec pe lamela inb solutie, suprafata lamelei ramane cu exces de electroni iar ionii metalici din solutie (+) se aranjeaza sub forma unui strat la mica distanta de suprafata lamelei
b) cand in solutie exzista exces de ioni (+) acestea se acumuleaza pe suprafata lamelei iar electronii in exces de solutie se aliniaza la distanta de suprafata.
In ambele variante intre suprafata lamelei si straturile de ioni sau electroni din solutie apare o diferenta de potential caracteristica fiecarui metal in parte numit potential de electrod si notat ε0M pe masura ce ionii metalici trec dintr-o faza in alta, campul electrtic se intensifica, se opune acestei treceri, pana se ajunge la o stare de echilibru cand schimbul dintre ioni si electroni se face in cantitati echivalente,
Cantitatea de electricitate care participa in unitatea de timp la acest proces se numeste proces de schimb notat cu I0 si are 2 componente :
- curentul de schimb anodic IA
- curentul de schimb catodic IC
Stratul dublu electric si potentialul de electrod al firului
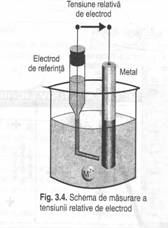
Electrozi de comparatie
Pentru a stabili potentialul de electrod al unui metal trebuie sa se masoare tensiunea electromotoare care apare intre acest electrod si un electrod de comparatie (referinta)
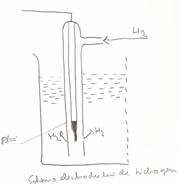
Electrodul de Hidrogen
EHH - electrodul normal de hidrogen
Se considera ca potentialul electrodului de hidrogen este ) astfel incat potentialul oricarui metal masurat in comparatie cu EHH ne indica potentialul real de electrod al metalului respectiv
EHH este format dintr-o lama de platina introdusa intr-o solutie deHCl concentratie 1 N si saturata prin barbotare continua cu (H2), concentratie ionilor de hidrogen si presiunea acestora este egala cu unitatea. Deoarece utilizarea a EHH este dificila pentru comparatie se folosesc alte tipuri de electrozi de referinta care au potential propriu (εpr) diferit de zero
Electrodul de calamel (Hg/Hg2Cl2/KCl) ECS
Este format din mercur in contact cu calamelul (Hg2Cl2) si o solutie declorura de potasiu KCl de la 0.1N, 1N sau solutie saturata
εECS = 0.2415 V
ε0M = ε ECS ± E , E - tensiunea electromotoare masurata
Electrodul cu cloruri de argint
Electrodul de cupru Cu/CuSO4
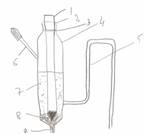
In cazul structurilor subterane, electrodul de Cu/CuSO4 saturat (avand potentialul 0,316 V/ENH) este recomandat si utilizat din cauza simplicitatii si usurintei realizarii lui, chiar in conditii de santier
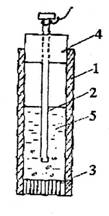
Electrodul de referinta Cu/CuS04 saturat: 1-tub de plastic; 2-sarma de cupru; 3-inchidere poroasa(dop de pluta, spre ex.); 4‑dop de cauciuc; 5-solutie CuS04 saturata plus cristale de CuSO4
ε = 0.34 V
Metal
Potentialul, V
Metal
Potentialul, V
Al/Al3+
-0.166
H2/2H+
0.000
ZN/Zn3+
-0.762
Cu/Cu2+
0.345
Fe/Fe2+
-0.440
Ag/Ag+
0.799
CD/CD2+
-0.402
Au/Au+
1.7
Ni/Ni2+
-0.23
Pb/Pb2+
-0.123
Curbe de potential (curbe de polirizare)
In conditii de echilibru la interfata de separare metal solutie schimbul sarcinii electrice este constant, astfel ca intensitatea curentului anodic IA este egala cu intensitatea curentului catodic Ic, valoarea totala a curentului masurat se numeste curent de schimb (si se noteaza cu I0)
Deoarece practic cantitatea de metal admisibila depinde depinde de suprafata metalului in practica se foloseste densitatea de curent masurata in A sau mA/m2 pentru ca avem ia, ic, si i0. In cursul unui proces de coroziune valorile masurate vor fi densitatea curentului de coroziune notata icor si potentialul mixt de coroziune notat cu ε cor
Curbele de polarizare se traseaza in coordonate i si ε pt a generaliza o curba de potential are forma
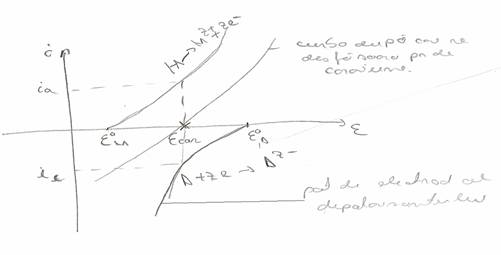
Potentialul coroziv este un potential mixt si pe axa potentialelor reprezinta punctul in care, intensitatea curentului anodic si catodic se egalizeaza
Diagrama Edeleanu Evans
Pentru a usura trasarea si interpretarea curbelor de polarizare s-a recurs la reprezentarea grafica a acestora in coordonate ε functie de lg i astfel incat curbel ede pe aceasta linie sunt linii drepte
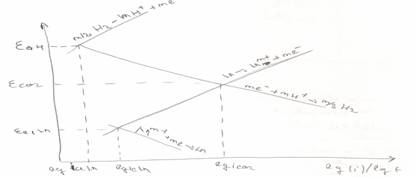
Diagramele Edeleanu Evans ne ofera informatii despre natura termodinamica, cinetica si natura proceselor de coroziune
Diagrama Paurbaix - trasata in coordonate ε functie de pH
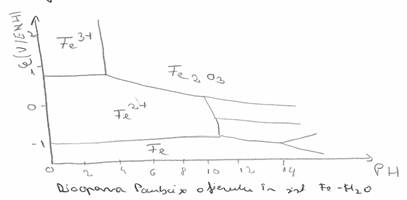
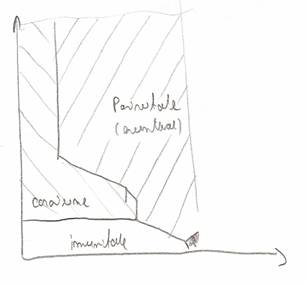
In domeniul de imunitate fierul nu se corodeaza iar pe masura ce ε creste coroziunea se produce intai cu formare de ioni de Fe2+, iar apoi Fe2+, Cresterea pH - ului aduce fierul intr-o zona cand acesta se acopera cu o pelicula de Fe(OH)2 sau Fe2O3
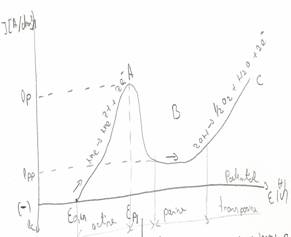
Prezentarea schematica a conditiilor de coroziune si pasivant ui prin curba de polarizare anodic
La scufundarea Fe intr-o solutie coroziva potentialul creste pe masura ce are loc oxidarea, fenomen insotit si de cresterea rapida a densitatii de curent, ionii de Fe formati se dizolva si difuzeaza in solutie (dom activ), pe masura ce coroziunea avanseaza si potentialul creste din solutie precipita pe suprafata fierului cristale de Fe(OH)2 care se constituie ca bariere in calea coroziunii (domeniul activ pasiv), in continuare se descompun Fe(OH)2 si se formeaza Fe2O3 care va forma un strat pasivantpe suprafata fierului impiedicand corodarea (domeniul pasiv) in domeniul transpasiv reincepe corodarea fierului datorita consumului de oxigen dizolvat in solutie