
|
|
|
Securitatea oncogena in cultivarea celulelor stem mesenchimale
Summary
The oncogenetic security in mesenchymal stem cells cultivation
The article summarizes recent data concerning developing of the new strategy - genetic instability monitoring techniques in the cultures of human mesenchymal stem cells. Stem cells are characterized by their self-renewal ability and high differentiation potential. Described methods detect cell senescence in culture and evaluate changes associated with moderate telomere shortening and characterized by cell cycle arrest, mutations in genes responsible to apoptosis, and cancer-associated genes p53, p15, Rb, NF-kB, Myc and repair machinery.
Key words: stem cells, cells cultures, genetic instability
Actualitatea
Termenul de celule stem (CS) defineste o populatie de celule-precursoare tisulare sau celule putin diferentiate ce circula in singe, ce poseda capacitatea de autoregenerare si diferentiere in componentii celulari ai diferitor tesuturi. In ultimul timp apare tot mai multa informatie despre utilizarea cu succes a transplantarii CS in cazul tratamentului maladiilor maligne ale singelui, maladiilor neurodegenerative, autoimune [1, 14].
Celulele stem mezenchimale (CSM) (stem stromale) se considera unul din cele mai de perspectiva tipuri de material autolog pentru terapia celulera si ingineria tisulara. Inceputul extins al experimentelor clinice a metodelor terapeutice cu CSM se explica printr-un sir de caracteristici (Tab. 1).
Proprietatile generale ale CS mezenchimale mature
Capacitatea inalta de proliferare
Abilitatea deosebita de adeziune
Structura similara cu a fibroblastelor
Formarea coloniilor in culturi
Polipotenta genomului
Compatibilitatea imunologica completa
Constitirea unei banci familiare de celule stem
O parere unica in privinta expresiei markerilor nu exista, nu sint descrisi si markerii unicali ai CSM. Totusi majoritatea cercetatorilor descriu aceste cellule ca SH-2, SH-3, SH-4, STRO-1, Sca-1, Thy-1, CD44, CD29, CD71, CD106, CD120a, CD124 - positive si CD34, CD45 - negative.
Posibilitatile aplicarii metodelor terapeutice cu CS in scopurile medicinii regenerative pun probleme serioase ce tin de controlul calitatii si sigurantei, in primull rind - oncogenice, obtinute pe baza lor a culturilor celulare. Intrebarea ce tine de securitate oncogena a celulelor stem mature, in general, si mezenchimale, in particular, ramine nestudiata, dar foarte actuala, importanta si determinind viitorul medicinii regenerative. Asupra potentialului risc cancerogen ale CS umane mature dupa transplantarea lor indica faptul, ca ele expreseaza markerii comuni cu CS embrionale si multiple linii maligne.
Descoperirile revolutionare ale biologiei moleculare si celulare in genomica si proteomica permite de a aborda sistematic examinarea problemei ce tine de asigurarea calitatii culturilor celulare, obtinute in vitro. La aceste descoperiri se poate atribui fenomenul apoptozei ca moartea genetic programata a celulelor, dependenta potentialului proliferativ al celulelor de virsta lor (efectul lui Heiflic), lungimea telomerelor si activitatea telomerazei, stresul oxidativ cu actiune deterioratoare a formelor active ale oxigenului asuprae membranelor si moleculelor de ADN, genele socului termic si controlul de catre ele a sintezei proteinelor antistresoare, anticorpii monoclonali utilizati la fenotiparea subpopulatiilor de limfocite distincte functional, pluripotenta CS, instabilitatea genomului cu mutatii ale ADN-ul mitochondrial, metilarea ADN-ului si acetilarea histonilor [22].
Imunofenotiparea celulelor. Celulele CD133+ au fost descrise ca CS ale organismului matur in anul 1997. Ele se expreseaza pe celulele hematopoietice imature si celulele progenitoare si nu exista pe celulele mature, diferentiate ale singelui. Ultimile date literare stiintifice descriu potentialul oncogen al celulelor CD133+. S-a constatat, ca aceste celule au o capacitate inalta de dividere si expansiune in vitro, ce a permis de a fi considerate drept una din cele mai timpurii populatii stem in organismul matur al omului. Exista o serie de lucrari, ce descriu fenomenul aparitiei din CD133+ a celulelor umane, ce confirma teoria participarii acestor celule in cancerogeneza si releva, ca aceste celule sint cele mai "tinere" in organismul uman si poseda caracter stem deosebit de exprimat [12].
In afara de CD133+, la rolul marker a fost propus antigenul de suprafata CD30+, care se refera la familia de receptori ai factorului necrozei tumorale si asigura protectia celulelor de declansarea cailor apoptotice (deci, este responsabil de supravietuirea lor). S-a demonstrat, ca expresia acestui receptor este caracteristica numai celulelor transformate. Modificarile in celulele cultivate prezentau in sine duplicarea partii bratului lung al cromozomului 1, trisomia cromozomului 12 etc. Expresia markerului CD30+ este posibil legata de procesele adaptive si constituie o reactie rapida de raspuns la stres in defectele genetice [10].
Este cunoscut, ca la cultivarea indelungata celulele pot suferi modificari fenotipice si genotipice considerabile. Cauzele acestei instabilitati ramin pina acum neclare. Astfel, evidentierea biomarkerilor (sau grupelor de markeri), ce caracterizeaza instabilitatatea genetica a liniilor celulare ar simplifica considerabil analiza lor si ar permite de a modifica metodele de cultivare pentru o mai buna sustinere a stabilitatii genomului celular.
Experimentele clinice cu aplicarea terapiei celulare se efectuiaza in diferite tari, si in prezent cea mai raspindita metoda pentru depistarea instabilitatii genetice a celulelor ramine cariotiparea.
Cariotiparea. Se disting modificari numerice si structurale ale cariotipului. La cele numerice se refera marirea numarului de cromozomi sau pierderea cromozomilor. Celulele cu numarul modificat de cromozomi se numesc celule aneuploidie. Modificarile de structura sint prezentate de translocatii (t) - translocarea unei sectiuni a cromozomului; deletii (del) - pierderea materialului cromozomial sau inversii (i) - rasucirea segmentului in limitele unei cromozom la 180o [18].
Analiza cariotipului CSM la studierea transformarii spontane a celulelor stem umane mature in cazul cultivarii indelungate, prezentata de Rubio D., Garcia-Castro J., Martin M. si coaut., a aratat trisomii, tetrapploidii si/sau reconstructii cromozomiale. Aceste modificari, inclusiv translocatiile intre cromozomii 3 si 11, reconstructiile in interiorul cromozomului 5, trisomia cromozomului 8 si aparitia izocromozomului 8, nu au fost intimplatoare si succesive [23].
Tabelul 2
Principalele anomalii cromozomiale caracteristice celulelor cu potential malign [18]
Anomaliile cariotipului
Frecventa
Anomaliile
cariotipului
Frecventa
t (9; 22) (q34; q11)
t (15; 17) (q22; q21)
t (4; 11) (q21; q23)
del (6q)
i (16)
t (1; 19) (q23; p13)
t (8; 14) (q24; q32)
+8
18
12
10
9
8
6
6
5
del/t (11q23)
del (7q)
t (8; 14) (q24; q11)
i (7q)
t (1; 3) (p36; q21)
+20
-20
del (9) (p21-22)
4
4
2
2
1
1
1
1
O importanta deosebita are valoarea prognostica a analizei cromozomale in transplantarea culturii celulare pacientilor. Este bine cunoscut faptul ca, si populatiile de celule foarte maligne poseda cariotip normal sau fara modificari evidente, si ades celulele tumorale poseda modificari genetice ascunse, de regula clonale [13, 18]. Cauza poate fi activitatea mitotica joasa, insertiile mici (submicroscopice), ce determina vizualizarea la analiza microscopica doar a metafazelor normale. Astfel, concluzia despre calitatea culturii celulare cu cariotip normal poate fi facuta numai dupa analiza molecular-genetica.
Analiza molecular-genetica. Statistica epidemiologica a permis de a determina, ca in medie pentru transformarea celulei normale in una tumorala sint necesare de la 3 pina la 7 evenimente spontane independente. Ca si tote celulele ce se divid intens in organism, celulele stem sufera 109 mutatii spontane pe nucleotid, ce constituie aproximativ 10-5 greseli pe gena in fiecare generatie [15]. Timp de 24 ore in celula umana au loc de la 5000 pina la 10000 depurinizari. Inacelasi timp, resturile citozinei si adeninei pot fi supuse dezaminarii spontane, cu o frecventa de aproximativ 100 cazuri pe genom timp de 24 ore [20]. Se considera, ca sistemul de reparare completamente face fata problemei de acumulare a greselilor in regiunile codificatoare ale genelor. Dar in cazul leziunilor anumitor verigi sistemele de reparare a celulei devin vulnerabile la actiunea unor agenti fizici si chimici. Dividerile limitate a asa celule-mutante si activitatea sistemului enzimelor de reparatie permit sustinerea practic nemodificata a particularitatilor culturii in general, cu exceptia mutatiilor, ce contribuie la o supravietuire mai buna si influenteaza dividerea celulara. Este necesar de evidentiat urmatorul aspect deosebit de important - in organism celulele mutante sint eliminate de sistemul imun, pe cand in culturile celulare acest mecanism este prezent.
Cresterea clonelor CS in cultura si aparitia mutatiilor depinde de multi factori, in primul rind de conditiile de cultivare, componenta mediului, alegerea factorilor de proliferare, care sunt si principalele cauze ale instabilitatii genetice a culturii celulare [16, 18].
Pentru analiza genomului celulelor, crescute in cultura, propunem utilizarea urmatoarelor modalitati de abordare, fiecare din ele independent evidentiaza modificarile in ADN-ul celular, starea celulei si partial poate servi ca marker al instabilitatii genetice a culturii.
O proprietate importanta a celulei neoplazice o constituie expresia oncogenelor si inactivarea supresorilor tumorali, ce duc la diminuarea abilitatii de a induce apoptoza, instabilitate genetica, blocarea diferentierii celulare, stimularea angiogenezei, disparitia imbatrinirii replicative sau imortalitatea celulei.
Un anumit interes il prezinta telomeraza - enzima, care reconstruieste telomerul scurtat. Este demonstrat, ca telomerii celulelor somatice se scurteaza atit in procesul ontogenezei in vivo, ait si in timpul cultivarii in vitro. Gena telomerazei este situata pe bratul scurt al cromozomului 5, si modificarea expresiei acestei gene este legata de reconstructiile in interiorul cromozomului, ce au loc in timpul cultivarii. Totodata, scurtarea telomerului constituie nu numai un indiciu al dividerilor celulare, dar si al proceselor mutationale, deoarece telomerii scurti declanseaza imbatrinirea ca raspuns la stresul oxidativ si mutatiile nereparate. Deoarece reactivarea telomerazei constituie caracteristica universala a celulelor tumorale (85%), masurarea nivelului activitatii telomerazei este important in determinarea aparitiei crizei, ce se caracterizeaza prin cresterea instabilitatii genetice a celulelor [23].
La momentul actual sint identificate citeva zeci de gene, inactivarea caror duce la aparitia celulei cancerogene. Majoritatea din ele, reglind ciclul celular, apoptoza sau reparatia ADN-ului, previn acumularea mutatiilor in celule. La markerii molecular-genetici ai cresterii tumorale si progresiei urmeaza de atribuit mutatiile punctiforme in regiunile codificatoare si reglatoare ale genelor, amplificarea oncogenelor, pierderea anumitor alele si locusurilor genelor in urma deletiei si reconstructiilor cromozomiale, modularea expresiei genelor la nivelul transcriptiei si translatiei.
Unele din cele mai interesante exemple de dereglare genetica servesc mutatiile punctiforme a urmatoarelor familii de gene:
Ras - protooncogene - mutatiile se depisteaza in codonii 12, 13, 61 a genelor K-ras, N-ras, H-ras, corespunzator.
p53 - supresorul tumoral multifunctional - mutatiile sint prezentate in esenta de misens-mutatii, cu o frecventa mai mare in codonii 175, 245, 248, 249, 273, 282 (asa numitele puncte fierbinti). Inca o particularitate a mutatiilor p53 in celulele tumorale o constituie faptul, ca ele spre deosebire de mutatiile altor supresori tumorali frecvent sint heterozigote.
Rolul deosebit al modificarilor genetice, adica modificari in structura genelor, este indubitabil. In ultimii ani s-a acumulat material, ce ne vorbeste despre aceea, ca un rol nu mai putin important in fenomenul instabilitatii genomului il joaca modificarile epigenetice, deci, modificari ce nu ating structura interna a genelor, dar determina dereglarea activitatii lor, care de asemenea induc modificari genetice. O trasatura caracteristica a celulelor transformate in vitro o constituie dereglarea echilibrului metilarii ADN-ului. Disechilibrul se manifesta prin hipermetilarea aberanta a zonelor promotoare a genelor, implicate in procesul de oncogeneza si micsorarea nivelului metilarii celeilalte parti a genomului. Metilarea ADN-ului reprezinta un biomarker pretios pentru diagnosticarea precoce a cancerogenezei. Un sir intreg de gene, implicate in cancerogeneza, se inactiveaza prin metilare - p14, p15, p16, p53, p56, NF-kB, Rb, c-myc,Arf, Wnt7 etc. Determinarea nivelului expresiei mentionate anterior constituie un marker suplimentar al aprecierii starii celulei. Astfel, este evidenta importanta corelasiilor dintre modificarile genetice si epigenetice in celule, transformate in timpul cultivarii.
Imbatrinirea celulei este legata de scurtarea telomerului, datorita pierderii activitatii telomerazei, si stoparea ciclului celular. Pe parcursul cultivarii celulelor, intr-un moment anumit inevitabil apare "criza" (stoparea) ciclului celular (faza M1). Recent in celulele umane a fost depistat fenomenul ocolirii spontane a "crizei" stoparii ciclului celular si scurtarea cromozomului. Mecanismele "ocolirii" acestui proces inevitabil determina dobindirea imortalitatii (pe fondalul telomerilor scurtati), aparitia aberatiilor cromozomiale si cancerogenezei. In final, acumularea mutatiilor cromozomiale inevitabil induce apoptoza (faza M2). Logic ar fi fost de presupus existenta unui atare fenomen si in CS mature, capabile sa se divida de cca 20-30 ori si sa existe in cultura pina la un an. Particularitatea imortalitatii direct este legata de lungimea telomerului si caracteristica pentru CS embrionare si cancerogene. Activitatea telomerazei in CSM umane, in opinia unui sir de autori, este nedectabila [10]. A fost aratat, ca in timpul expansiei CSM umane in vitro, se observa scurtarea telomerului, ce posibil este legat de ocolirea fazei M1.
Figura 2 reflecta comportarea celulelor si relatia reciproca intre imbatrinirea celulara, apoptoza si cancer.
Este necesar de mentionat, ca exista dovezi, ca CS, obtinute de la donatorii maturi sunt cu mult mai sensibile fata de transformarile genetice, legate de virsta donatorului. Sunt demonstrate corelatii directe intre virsta donatorului si calitatea culturii celulare obtinute. Astfel, este necesar de a efectua evaluarea nu numai a celulelor cultivate ale donatoruluui, dar si a ADN-lui din singele lui, pentru a stabili prezenta mutatiilor in celulele organismului. Lipsa modificarilor in singele periferic va releva caracterul de novo al mutatiei.
O directie de perspectiva este stabilirea markerilor specifici a CSM, care va permite separarea populatiei curate de celule fara cultivarea prealabila. Astfel, se vor crea premisele evitarii riscului oncotransformarii celulelor datorita eliminarii etapei de cultiver.
Actualmente are loc acumularea intensa a cunostintelor teoretice si practice pentru utilizarea CS in diferite domenii ale medicinei. In centrele medicale mari ale universitatilor de prestigiu din lume s-au inceput aplicarea clinica a CS pentru tratarea diferitor maladii (infarctului miocardic, bolii Parkinson), care conform aprecierii specialistilor FDA, va fi deosebit de intensa in medicina regenerativa nu mai devreme de anul 2010.
Relatia reciproca intre imbatrinirea celulara, apoptoza si cancer in stresul oxidativ [16].
in vitro in vivo
![]()

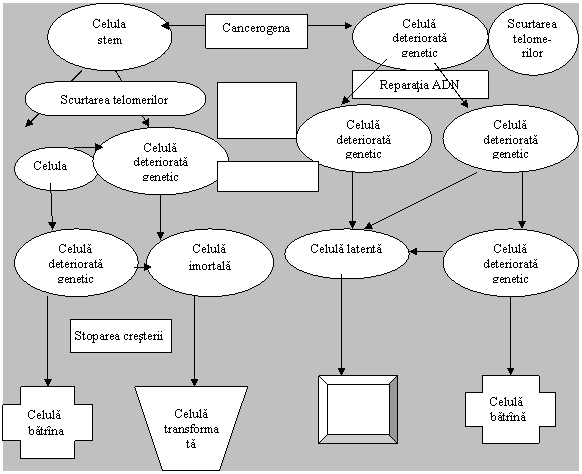
Figura 2
Concluzii
Problema corespunderii imbatrinirii celulare in vitro este principial importanta, intrucit se presupune, ca imbatrinirea replicativa (celulara) insasi duce la sporirea sensibilitatii fata de cancerogeneza. Liniile CS, sustinute in vitro, sint expuse modificarilor genetice si epigenetice si, in consecinta, trebuie atit monitorizate minutioase in timpul cultivarii, cit si supuse unei analize detaliate in timpul utilizarii in vivo in scopuri terapeutice.
Datele obtinute impun necesitatea studierii potentialului cancerigen al culturilor celulare inaintea aplicarii clinice a protocoalelor terapiei celulare. Urmatoarele metode sunt imperative:
1. Cariotiparea citogenetica a celulelor pentru studierea ploidiei, prezenta aberatiilor cromozomiale.
2. Analiza-molecular genetica.
3. Descrierea imunofenotipica a celulelor - determinarea CD133++, CD30+ a celulelor.
Bibliografie
1. Ababii I., Ciobanu P., Esanu N.,Topor B., Nacu V. Actualitati si perspective in transplantarea celulara. Curierul Medical, nr.3 (285), 2005, p.42 - 47.
2. Alvarez_Dolado, M., Pardal, R., Garcia Verdugo, J.M., Fike, J.R., Lee H.O., Pfeffer, K., Lois, C., Morrison, S.J., and Alvarez_Buylla, A. Nature, 2003, 425(6961): 968-973.
3. Hauss R , Lange C , Weissinger E M , Kolb H J et al Evidence of peripheral blood-derived, plastic-adherent CD34 (-/low) hematopoietic stem cell clones with mesenchymal stem cell characteristics. Stem Cells, 2000; 18: 252-260
4. Nacu V., Topor B., Borovic E. si al. Referitor la celulele mezenchimale stem., Analele Stiintifice USMF "Nicolae Testemitanu", 2003, v. I: 74-79.
5. Nygren, J.M., Jovinge, S., Breitbach, M., Sawen, P., Rоll, W., Hescheler, J., Taneera, J., Fleischmann, B.K., and Jacobsen, S.E.W. Nat. Med., 2004, 10(5): 494-501.
6. Patel A., Groopman J.D., Umar A. DNA methylation as a Cancer-Specific Biomarker. Ann. N.Y. Acad. Sci., 2003, 983: 286-297.
7. Pittenger M.F., Mackay A.M., Beck S.C., et. al. Multilineage Potential of Adult Human Mesenchymal Stem Cells. Science 1999, 284: 143-147.
8. Prockop D. J. Marrow stromal cells as stem cells for nonhematopoietic tissue. Science, 1997, 276 (4): 71.
9. Rubio D., Garcia-Castro J., Martin M., etc. Spontaneous Human Adult Stem Cell Transformation. Cancer Res 2005; 65:(8): 3035 - 3039.
10. Анисимов В.Н. Молекулярные и физиологические механизмы старения. "Наука", 2003, стр.468.
11. Геномные изменения эмбриональных стволовых клеток человека при длительном культивировании. Клеточная трансплантологии и инженерия, 2005; 2: 16-17.
12. Заридзе Д.Г. (ред.) Канцерогенез. "Медицина", 2003, стр.575 .
13. Макеев О.Г., Буханцев В.А. и другие. Исследование генетической нестабильности в краткосрочных культурах аутологичных фибробластов. Материалы "Актуальные вопросы тканевой и клеточной трансплантации". 2007, стр. 81-82
14. Онищенко Н.А. Патологическая физиология и эксперим терапия 2004 4, 2-11.
15. Онкогенный потенциал СD 133+. Клеточная трансплантологии и инженерия. 2005, 1, стр. 9-11.
16. Романов Ю.А., Стволовые клетки в современной медицине: настоящее и будущее. Материалы Конфeренции "Новые информационные технологии в медицине, биологии, фармакологии и технологии". 2006, стр. 89 - 92.
17. Семенков В. Ф., Ковальчук Л. В. Биологические механизмы старения иммунной системы и современные подходы к их коррекции. Успехи современной биологии, 2005, том 125, 5, стр. 446 - 465.
18. Сингер М., Берг П. Гены и геномы. "Мир", 1998, т. 1, стр. 370.
19. Ткемаладзе Дж. В., Чичинадзе К. Н. Биохимия, 2005, том 70, вып. 11, стр. 1566 - 1584.
20. Тодоров И., Тодоров Г. Стресс и старение и их биохимическая коррекция. "Наука", 2003, стр. 480.
21. Хейфлик Л. Биохимия, 1997, 62(11), стр. 1380-1393.
22. Чертков И.Л., Дризе Н.И. Терапевтический архив, 2004 7, 5-11.
23. Эллиот В., Эллиот Д. Биохимия и молекулярная биология. "Наука", 2002, стр. 444.