
|
|
|
STRUCTURA ATOMULUI SI REZULTATELE SPECTROSCOPIEI
1. Modelul atomic a lui Rutherford
O serie de fapte experimentale au pus in evidenta existenta, in edificiul atomic, al purtatorilor de sarcina. Nucleul nu mai putea fi considerat indivizibil si deci fizicienii au inceput sa construiasca modele atomice, care sa explice faptele experimentale acumulate.
In scopul validarii unor modele simple propuse s-au realizat o serie de experiente de imprastiere a particulelor rapide prin substanta. Astfel, in 1911, Rutherford a studiat imprastierea particulelor nuclee de heliu prin folii metalice subtiri. Observatiile experimentale au aratat ca numarul de particule scade cu unghiul de imprastiere, dar nu devine zero nici pentru un unghi de imprastiere de 180°. Acest experiment duce la concluzia ca atomul este format dintr-un nucleu care concentreaza aproape toata masa atomului si care contine sarcinile pozitive (sarcina totala fiind Z.e) si electroni, particule cu sarcina negativa, ce graviteaza in jurul nucleului. Rutherford construieste astfel modelul planetar al atomului in care electronii se rotesc in jurul nucleului la fel ca planetele in jurul Soarelui.
Considerand un atom cu un singur electron periferic (atomi hidrogenoizi) forta electrica ce se exercita intre nucleu si electron va fi:
![]()
unde ![]() este permitivitatea
electrica a vidului.
este permitivitatea
electrica a vidului.
Teoria clasica a electromagnetismului arata ca orice sarcina electrica in miscare accelerata emite radiatie electromagnetica. Energia electronului ar trebui in acest caz sa scada rapid si electronul ar cadea pe nucleu, fapt infirmat de observatiile experimentale.
Tot de neexplicat pentru fizica clasica este si mecanismul emisiei si absobtiei energiei de catre atomi. La inceputul secolului existau numeroase observatii experimentale realizate de catre spectroscopisti care au condus la concluzia ca fiecare element are un spectru caracteristic de linii de emisie. Aceste linii prezinta o serie de regularitati remarcabile. Astfel se stia, pentru spectrul hidrogenului, ca inversul lungimii de unda a radiatiilor este dat de formula lui Balmer generalizata:
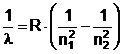 (3.22)
(3.22)
unde n1 si n2 sunt numere intregi pozitive (n2 > n1), iar R este constanta lui Rydberg cu valoarea R=109677,7 cm-1.
Din relatia anterioara pentru:
n1 = 1 si n2 = 2, 3, se obtie seria Lyman, situata in domeniul ultraviolet;
n1 = 2 si n2 = 3, 4, se obtie seria Balmer, situata in domeniul vizibil;
n1 = 3 si n2 = 4, 5, se obtie seria Paschen, situata in domeniul infrarosu;
n1 = 4 si n2 = 5, 6, se obtie seria Brackett, situata in domeniul infrarosu;
n1 = 5 si n2 = 6, 7, se obtie seria Pfund, situata in domeniul infrarosu.
De
asemenea, pentru ![]() se obtine limita
fiecarei serii. Prin serie spectrala se intelege totalitatea
liniilor spectrale ce prezinta anumite regularitati in ceea ce
priveste succesiunea si distributia intensitatii lor.
se obtine limita
fiecarei serii. Prin serie spectrala se intelege totalitatea
liniilor spectrale ce prezinta anumite regularitati in ceea ce
priveste succesiunea si distributia intensitatii lor.
La atomii cu mai multi electroni situatia este mai complicata, dar si in acest caz frecventele radiatiilor emise se pot exprima prin diferenta a doi termeni spectrali:
![]()
unde a si b sunt parametrii ce se schimba de la element la element. Relatia de mai sus se numeste regula de combinare Rydberg - Ritz.
In conformitate cu fizica clasica, lumina emisa de atomi se datoreaza miscarii periodice a electronilor, iar frecventele acestor radiatii sunt multiplii frecventelor miscarilor periodice a electronilor. Aceasta afirmatie este in dezacord cu datele experimentale acumulate.
2. Modelul atomic al lui Bohr
Pentru explicarea spectrelor experimentale obtinute si inlaturarea instabilitatii modelului Rutherford al atomului, in 1913, N. Bohr formuleaza doua ipoteze referitoare la atom, construind modelul ce ii poarta numele. Ipotezele lui Bohr sunt bazate pe faptele experimentale acumulate in spectroscopie. Postulatele lui Bohr sunt:
I. Energia unui atom nu poate lua decat valori ce fac parte dintr-un sir discret, caracteristic fiecarui atom. In aceste stari atomul nu emite si nici nu absoarbe radiatie.
Starile permise poarta numele de stari stationare, iar energiile asociate acestor stari se numesc nivele de energie ale atomului.
II. Emisia sau absobtia luminii are loc numai atunci cand atomul sufera o tranzitie de la o stare stationara de energie Ei la o alta stare stationara de energie Ef. Energia radiatiei emise sau absorbite este:
![]() (3.23)
(3.23)
Postulatele formulate de Bohr introduc deci cuantificarea energiei atomului, existenta starilor stationare si faptul ca tranzitiile intre starile stationare sunt la originea emisiei si absorbtiei de energie, concepte ce nu au echivalente, si sunt chiar in contradictie cu legile fizicii clasice.
Postulatele lui Bohr nu permit calculul energiilor starilor stationare si nici nu explica formula Balmer. In acest scop Bohr introduce o ipoteza suplimentara afirmand ca orbitele stationare sunt caracterizate prin faptul ca momentul cinetic orbital (momentul impulsului electronului - m v r) este cuantificat. Astfel:
![]() (3.24)
(3.24)
Ca urmare, din conditia de stabilitate pe orbita a electronului, rezulta:
![]() (3.25)
(3.25)
Folosind relatia (3.24) se obtine:
![]()
de unde:
![]() (3.26)
(3.26)
Relatia (3.26) arata ca razele orbitelor electronilor unui atom sunt direct proportionale cu patratul numarului cuantic principal n.
Utilizand relatia (3.25) energia cinetica a electronului este:
![]()
si cum energia potentiala a electronului in campul electric creat de nucleu poate fi scrisa:
![]()
deci energia totala este:
![]() (3.27)
(3.27)
semnul - din expresia anterioara indicand faptul ca electronul este legat in atom (pentru a-l extrage se consuma un lucru mecanic). Inlocuind (3.26) in (3.27) se obtine:
![]() (3.28)
(3.28)
Energia fotonului emis sau absorbit devine:
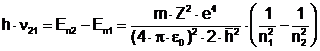
sau exprimand prin inversul lungimii de unda:
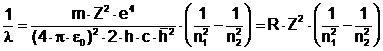 (3.29)
(3.29)
cu R - constanta Rydberg data de relatia:
![]() (3.30)
(3.30)
Se constata deci ca modelul atomic al lui Bohr conduce la obtinerea relatiilor deduse din observatiile spectroscopice si inlatura instabilitatea legata de modelul atomic a lui Rutherford.
Pornind de la relatia (3.30) s-a calculat valoarea lui R. Valoarea obtinuta R=10973730 m-1, este putin diferita de cea rezultata din datele experimentale. Aceasta diferenta provine din faptul ca nucleul atomic a fost considerat fix. Introducand in relatiile anterioare in locul masei electronului masa redusa:
![]()
unde M este masa nucleului, se obtine
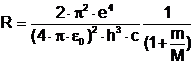 (3.31)
(3.31)
Cu aceasta corectie valorile obtinute sunt intr-o buna concordanta cu cele experimentale.
Cu toate realizarile sale, modelul Bohr ramane insuficient pentru explicarea tuturor faptelor experimentale acumulate. Modelul nu permite calcului intensitatii liniilor spectrale si nici obtinerea de informatii asupra spectrelor atomilor cu mai muti electroni. In plus modelul este unul semiclasic deoarece impune cuantificarea momentului cinetic orbital, dar legile de miscare a electronului sunt tot cele clasice.
3. Experienta Franck - Hertz
Pentru confirmarea directa a existentei starilor stationare, deci a faptului ca energia atomului nu poate varia continuu, s-au realizat o serie de experiente, celebra ramanand experienta Franck si Hertz (1913).
Dispozitivul experimental folosit consta intr-un balon de sticla vidat in care au fost introdusi vapori ai unui element oarecare. Balonul are un catod K, o grila G si un anod A (figura 3.6).
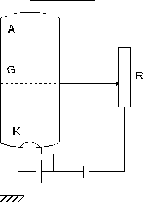
Fig. 3.6
Electronii obtinuti prin emisie din catod vor fi accelerati in spatiul dintre catod si grila obtinandu-se practic un fascicul monoenergetic. Acestia vor ciocni atomii vaporilor elementului introdus in balon. Variind tensiunea de accelerare se traseaza caracteristica curent tensiune. Conform figurii 3.7 se constata ca variatia curentului cu tensiunea nu este continua ci prezinta maxime echidistante.
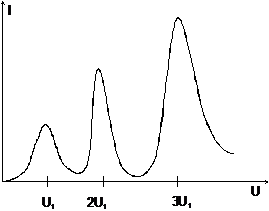
Fig. 3.7
Rezultatul poate fi interpretat astfel:
-
electronii sunt imprastiati elastic, atunci cand energia
cinetica a lor este mai mica decat o valoare caracteristica
atomilor gazului bombardat ![]() ;
;
-
atunci cand energia cinetica a electronilor atinge valoarea
caracteristica ![]() se constata
ca electronii pierd din energie, iar atomii emit o radiatie de
frecventa
se constata
ca electronii pierd din energie, iar atomii emit o radiatie de
frecventa ![]() ;
;
-
la cresterea in continuare a energiei electronilor se constata o
noua descrestere a energiei electronilor imprastiati
atunci cand energia lor initiala este un multiplu al energiei ![]() , precum si existenta altor valori caracteristice;
, precum si existenta altor valori caracteristice;
- energiile caracteristice sunt marimi importante ale atomilor ce pot fi legate de spectrul de energii permise.
In concluzie experienta lui Franck si Hertz dovedeste direct ca energia atomului este cuantificata.