
|
|
|
Relatii matematice intre marimile termodinamice
In multe probleme de chimie fizica
este necesara stabilirea relatiilor dintre diferitele marimi
termodinamice. Stabilirea directa a acestor relatii este, in general,
dificila. Este suficient sa se remarce ca, pentru cele opt
marimi termodinamice (U, H, S, F, G,
p, V, T), sunt posibile ![]() derivate partiale
de ordinul intai si un numar mult mai mare de relatii intre ele.
derivate partiale
de ordinul intai si un numar mult mai mare de relatii intre ele.
Din aceasta cauza se recomanda utilizarea uneia din urmatoarele metode:
a) Metoda Bridgeman foloseste o tabela de expresii care permit determinarea derivatelor de ordinul intai in termeni de trei marimi masurabile experimental:
![]() ,
, 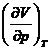 si
si ![]()
folosind relatia pur formala:
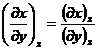 (XIV.54)
(XIV.54)
unde x, y, z reprezinta trei din cele opt marimi termodinamice.
Exemplul
20. Sa se calculeze, prin metoda
Bridgeman, coeficientul Joule-Thomson 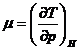 .
.
Rezolvare:
Din tabela XIV.1 se obtine:
![]()
![]()
de unde:
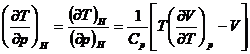
Tabela XIV.1 Tabela Bridgeman
![]()
![]()
![]()
![]()
![]()
![]()
![]()
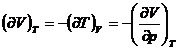
![]()
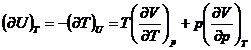
![]()
![]()
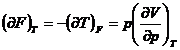
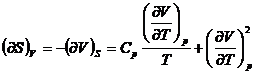
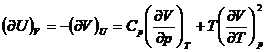
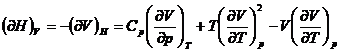
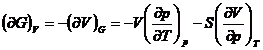
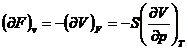
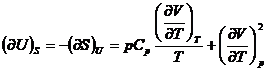
![]()
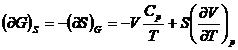
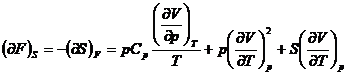
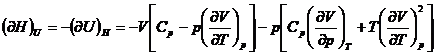
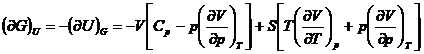
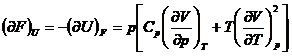
![]()
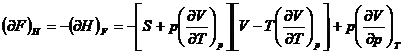
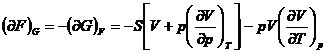
b) Metoda Shaw este un procedeu sistematic pentru determinarea relatiilor termodinamice si se bazeaza pe folosirea determinantilor functionali (iacobiani):
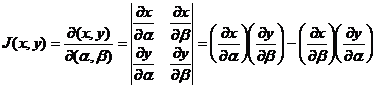 (XIV.55)
(XIV.55)
unde x, y sunt doua variabile dependente
si ![]() sunt doua
variabile independente.
sunt doua
variabile independente.
Proprietatile importante ale iacibianului sunt:
![]() (XIV.56)
(XIV.56)
![]() (XIV.57)
(XIV.57)
![]() (XIV.58)
(XIV.58)
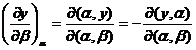 (XIV.59)
(XIV.59)
Din ultimele doua ecuatii rezulta:
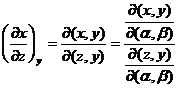 (XIV.60)
(XIV.60)
O diferentiala totala:
dx = Mdy + Mdz
se poate scrie sub forma:
J(x,![]() ) = MJ(y,
) = MJ(y,![]() ) + NJ(z,
) + NJ(z,![]() ) (XIV.61)
) (XIV.61)
Intr-adevar:
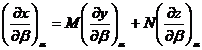
sau
![]()
Exemplul
21. Sa se
calculeze prin metoda Shaw coeficientul Joule-Thomson 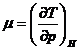 .
.
Rezolvare:
Potrivit ecuatiilor (XIV.58, XIV.59 si XIV.60) rezulta:
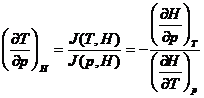
unde ![]() si
si
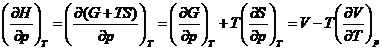
Prin urmare:
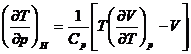
sau
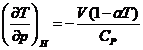
Exemplul
22. Sa se
stabileasca expresia derivatei ![]() .
.
Rezolvare:
Considerand ca variabile independente p si T, se obtine:
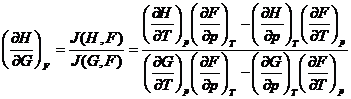
Din ecuatiile cunoscute sau usor de stabilit:
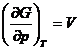 ;
; ![]()
![]()
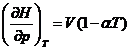 (v. exemplul
precedent)
(v. exemplul
precedent)
![]()
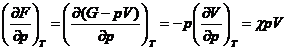
rezulta astfel:
![]()
La folosirea metodei Shaw, pentru comoditatea calculului, se recomanda folosirea tabelei XIV.2, in care intervin patru variabile independente p, V, T, S si determinantii functionali definiti prin relatiile:
a = J(V,T) = -J(T,V)
b = J(p,V) = -J(V,p)
c = J(p,S) = -J(S,p)
l = J(p,T) = -J(T,p)
n = J(V,S) = -J(S,V)
Intre a, b, c, l si n exista relatia:
![]() (XIV.62)
(XIV.62)
Tabela XIV.2 Tabela Shaw
y x
p
V
T
S
U
H
F
G
![]()
![]()
p
0
b
l
c
Tc-pb
Tc
-Sl - pb
-Sl
Tc
pb
V
-b
0
c
n
Tn
Tn-Vb
-Sa
-Sa-Vb
Tn
0
T
-l
-a
0
b
Tb + pa
Tb-Vl
Pa
-Vl
Tb
-pa
S
-c
-n
-b
0
pn
-Vc
Sb + pn
Sb-Vc
0
-pn
U
Tc + pb
-Tn
-Tb - pa
-pn
0
-TVc-p(Tn-
-Vb)
T(Sb + pn)
+ pSa
T(Sb-Vc)+
+(Sa+Vb)
-pTn
- Tpn
H
-Tc
-Tn + Vb
-Tb + Vl
Vc
TVc + p(Tn - Vb)
0
T(Sb + pn) - V(Sl + pb)
T(Sb-Vc)-VSl
VTc
-Tpn+
Vbp
F
Sl + pb
Sa
-pa
-Sb - pn
-T(Sb + pn) - pSa
-T(Sb+pn)
+V(Sl+pb)
0
SVl+
P(Sa+Vb)
-STb-pTn
Spa
G
Sl
Sa + Vb
Vl
- Sb + Vc
-T(Sb - Vc) - p(SaVb)
-T(Sb-
-Vc)+VSl
-SVl -
-p(Sa + Vb)
0
-STb-
-pTn
Spa+
+Vpb
Qrev
-Tc
-Tn
-Tb
0
pTn
VTc
STb + pTn
STb-VTc
0
-Tpn
Wd,rev
-pb
0
pa
pn
Tpn
Tpn-Vpb
-Spa
-Spa-Vpb
Tpn
0
Exemplul 23. Sa se verifice ca J(T,S) = J(p,V).
Rezolvare:
Ecuatia se poate scrie sub forma evident verificata:
![]()
deoarece
![]() (v. (XIV.38))
(v. (XIV.38))
Exemplul
24. Sa se verifice ecuatiile 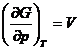 si
si ![]() .
.
Rezolvare:
Conform ecuatiei (XIV.58) si cu ajutorul tabelei XIV.2, se obtine imediat:
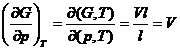
si
![]()
observand ca valorile iacobianului de la numarator, respectiv de la numitor, se gasesc la intersectia coloanei si randului respectiv.
Exemplul
25. Sa se calculeze expresia derivatei ![]() in termeni de
marimi masurabile.
in termeni de
marimi masurabile.
Rezolvare:
Conform ecuatiei (XIV.58) si a tabelei XIV.2, se obtine:
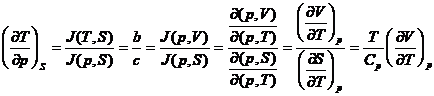
Exemplul
26. Sa se calculeze ![]() , alegand ca variabile independente p si T.
, alegand ca variabile independente p si T.
Rezolvare:
Se foloseste relatia:
![]()
si cu ajutorul tabelei XIV.2 se obtine:
![]()
Pentru a elimina pe n = J(V,S) se multiplica cu l si se tine seama de relatia (XIV.62):
![]()
Rezulta:
![]()
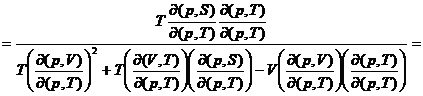
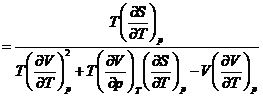
Deoarece 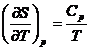 , se obtine:
, se obtine:
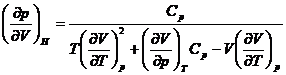
Pentru un gaz perfect:
![]() ,
, 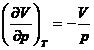 si
si ![]()
PROBLEME
1. Sa se utilizeze presiunea si volumul, respectiv entropia si temperatura, ca variabile independente pentru reprezentarea grafica a unui ciclu constituit din vaporizarea unui lichid la presiune constanta, o detenta adiabatica si vaporizare, o condensare izoterma si o comprimare adiabatica. Sa se calculeze lucrul si caldura in acest proces ciclic.
*2. Sa se stabileasca semnificatia fizica a subtangentei izobarei, respectiv izocorei, in diagrama T-S.
*3. Sa se indice cateva metode de calcul a temperaturii de zero absolut.
4. Caldura de ardere a metanului este -212,95 ![]() . Sa se indice cateva metode pentru obtinerea
lucrului mecanic prin combustia acestui gaz si sa se compare
randamentele diferitelor metode imaginate.
. Sa se indice cateva metode pentru obtinerea
lucrului mecanic prin combustia acestui gaz si sa se compare
randamentele diferitelor metode imaginate.
5. Sa se calculeze lucrul minim necesar pentru pulverizarea a 1 g apa, la 20 oC, in picaturi cu un diametru mediu de 100 mμ. (In acest caz, variatia de entalpie libera este egala cu variatia energiei superficiale).
6. Presupunand ca n1 moli toluen si n2 moli xilen se amesteca fara efect termic si fara variatie de volum, formand o solutie in care fractiile molare sunt x1 si x2, sa se calculeze ΔU, ΔH si ΔS si lucrul dat de procesul de amestecare.
7. La presiunea de 22,8 atm apa fierbe la 220 oC. Sa se calculeze fractiunea maxima din caldura absorbita la aceasta temperatura, care se transforma in lucru mecanic intr-o masina termica avand un cazan la 22,8 atm si un condensator la 45 oC.
8. Sa se calculeze lucrul mecanic minim necesar unei masini frigorifice care transporta o calorie de la 0 la 25 oC.
9. Sa se arate ca, pentru procesul de detenta in vid a unui gaz perfect, cresterea de entropie este mai mare decat cea calculata pe baza caldurii absorbite.
10. Sa se verifice ca procesul de amestecare a doua cantitati de apa de temperaturi diferite este insotit de o scadere a energiei libere a sistemului.
11. Pentru inlocuirea apei in masinile termice s-a propus bifenilul sau un amestec bifenil-bifenileter. Sa se analizeze avantajele si dezavantajele pe care le prezinta aceste substante fata de apa si mercur.
12. Sa se arate ca, pentru apa la 4 oC
(densitate maxima), ![]() .
.
13. Sa se arate ca, daca doua faze ale unui sistem eterogen nu sunt la echilibru, o substanta tinde sa treaca din faza in care potentialul chimic respectiv este mai mare in faza in care potentialul chimic este mai mic.
14. Volumul unui mol de azot la 0 oC este 10 l (starea 1). In starea 2, aceeasi cantitate de azot ocupa 20 l la 100 oC. Intre cele doua stari sunt posibile o infinitate de transformari. Considerand urmatoarele doua transformari:
a) destindere izoterma la 0 oC si incalzire la 100 oC;
b) incalzire la volum constant de la 0 la 100 oC si destindere izoterma, sa se compare valorile numerice ale marimilor ΔU, ΔH, W, Q, ΔS si sa se interpreteze rezultatele.
15. Sa se calculeze variatia de entropie pentru un mol gaz ideal, care trece de la 0 oC si 1 atm la 100 oC si 2,5 atm.
16. Capacitatea calorica molara a CO2 la presiune constanta este:
![]()
Sa se calculeze variatia de entropie pentru procesul de racire a unui mol CO2 la presiunea constanta, de la 100 la 0 oC. Utilizand acest rezultat, sa se calculeze capacitatea calorica molara medie a CO2 intre 0 si 100 oC.
17. Sa se calculeze variatia de entropie pentu 1 mol ![]() care trece din starea 1,
gaz la temperatura de fierbere si 1 atm, in starea 2, solid la
temperatura de cristalizare si presiunea de 1 atm.
care trece din starea 1,
gaz la temperatura de fierbere si 1 atm, in starea 2, solid la
temperatura de cristalizare si presiunea de 1 atm.
18. Capacitatea calorica molara la presiune constanta a MnO2 in intervalul 298-780 oC este data de ecuatia:
![]()
Sa se arate ca:
![]()
19. Sa se calculeze ΔG la 100 oC pentru 1 mol apa, daca presiunea creste cu 1 atm. (Se va considera apa lichida incompresibila).
20. Temperatura unui gaz ideal creste de la 25 la 250 oC. Sa se calculeze variatia de presiune a gazului, necesara unei variatii nule de entropie intr-un asemenea proces.
21. O masina termica functioneaza cu doua surse de caldura identice, dar cu temperaturi diferite T1 si T2. Schimbul de caldura este izobar si fara a provoca transformari de faza. Sa se arate ca lucrul maxim obtinut este dat de expresia:
![]()
22. Intre doua surse de caldura identice avand temperatura initiala T1 functioneaza o masina frigorifica care scade temperatura uneia dintre surse la T2 (izobar, fara transformari de faza. Sa se arate ca lucrul minim necesar functionarii masinii este:
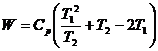
23. Intr-un vas Dewar, care contine 5 kg apa la 30 oC, se introduce 1 kg gheata la -10 oC. Sa se calculeze variatia de entropie a procesului de amestec.
24. Intr-un vas Dewar se amesteca 100 g apa la 10 oC
cu 200 g apa la 40 oC. Sa se calculeze variatia de
entropie si de entalpie libera a procesului de egalizare a temperaturii,
considerand entropia unui mol de apa la 25 oC, ![]() si caldura
specifica a apei
si caldura
specifica a apei ![]() .
.
25. Un litru gaz perfect la 0 oC si 1 atm este destins izoterm.
a) Sa se calculeze volumul final necesar pentru o crestere a
entropiei cu ![]() ;
;
b) Temperatura gazului considerat este adusa la 100 oC,
la volumul constant, si apoi gazul este destins izoterm. Sa se
calculeze volumul final pentru o crestere a entropiei de ![]() ;
;
c) Temperatura gazului initial este adusa la 100 oC, la presiune constanta. Sa se calculeze volumul.
Gazul se destinde izoterm la 100 oC pana la volum
corespunzator la o crestere a entropiei de ![]() . Sa se calculeze acest volum.
. Sa se calculeze acest volum.
d) Sa se interpreteze rezultatele a, b, c in termeni de probabilitate.
26. Sa se calculeze ΔU, ΔH, ΔS, W, Q, ΔG si ΔF la destinderea izoterma a unui mol de gaz perfect la 25 oC de la 10 la 100 l.
*27. Sa se calculeze ΔU,
ΔH, ΔS, W, ΔG si ΔF, presiunea si temperatura finale la comprimarea
adiabatica pana la 1 l a 10 l H2, la 0 oC
si 1 atm, considerand ![]() si
si ![]() .
.
28. Sa se calculeze ΔU, ΔH, ΔS, W, Q, ΔG si ΔF la procesul de topire a unui mol de gheata la 0 oC (1 atm).
29. Reactia zincului cu ionii de cupru se conduce izoterm in trei moduri:
a) se introduce zinc intr-o solutie de azotat de cupru;
b) se construieste o pila, de exemplu:
![]()
care se descarca pe o rezistenta foarte mica;
c) pila din (b) se descarca pe o rezistenta alimentata cu o tensiune foarte apropiata de f.e.m. a pilei si de semn contrar.
In cele trei experiente se masoara caldura schimbata de pila. Sa se stabileasca procesul in care variatia de entropie este data de raportul caldura schimbata: temperatura.
30. Sa se calculeze ΔG, ΔH si ΔS pentru procesul de cristalizare a apei subracite la -5 oC.
31. Se amesteca adiabatic doua cantitati egale de apa (m grame), dar de temperaturi diferite T1 si T2. Sa se calculeze variatia de entropie a sistemului izolat.
32. La formarea AgCl din elemente, in conditii standard,
variatia de entalpie libera este ![]() si caldura
de reactie este
si caldura
de reactie este ![]() la 18 oC.
Sa se calculeze variatia de entropie corespunzatoare. Sa se
calculeze variatia de entalpie libera pentru o crestere de 10
oC a temperaturii, presupunand ca
la 18 oC.
Sa se calculeze variatia de entropie corespunzatoare. Sa se
calculeze variatia de entalpie libera pentru o crestere de 10
oC a temperaturii, presupunand ca ![]() este o constanta.
este o constanta.
33. Variatia de entalpie libera ΔG a unui proces este ![]() la 25 oC
si
la 25 oC
si ![]() la 35 oC.
Sa se calculeze ΔH si
ΔS pentru procesul efectuat la
30 oC.
la 35 oC.
Sa se calculeze ΔH si
ΔS pentru procesul efectuat la
30 oC.
34. Presiunea de vapori a mercurului la 160 oC este 4,19 mm col. Hg. Sa se calculeze variatia de entalpie libera (in ergi) pentru procesul de comprimare izoterma a unui mol de mercur de la starea de vapori in echilibru cu lichidul la 160 oC, in starea de vapori la 1 atm si 160 oC.
35. Sa se calculeze variatia de entalpie libera pentru procesul de trecere a unui mol de benzen la 25 oC din lichidul pur intr-o solutie ideala care contine 1 mol benzen la 4 moli substanta straina.
36. Un sistem este constituit din n lichide diferite, necompresibile,
cu capacitati calorice ci si temperaturi ![]() (i = 1, 2 n).
(i = 1, 2 n).
Sa se calculeze temperatura finala si lucrul dat de sistem, prin egalarea temperaturilor, fara schimb de caldura cu exteriorul.
37. Sa se arate, prin evaluarea variatiei entalpiei libere, ca din cele trei procese de mai jos, primul corespunde sensului natural.
![]() (100 oC)
(100 oC)
![]() (100 oC)
(100 oC)
![]() (100 oC)
(100 oC)
*38. Sa se calculeze ![]() pentru procesul
NaCl(s) → NaCl (aq; m = 6,12), stiind ca concentratia m =
6,12 corespunde saturatiei la 25 oC.
pentru procesul
NaCl(s) → NaCl (aq; m = 6,12), stiind ca concentratia m =
6,12 corespunde saturatiei la 25 oC.
*39. Sa se arate ca variatia de entropie la dizolvarea NaCl(s) → NaCl (aq; m = 6,12) este aproximativ egala cu unitatea (u.e.) la 25 oC. Sa se calculeze ΔS pentru acelasi proces la 40 oC (v. problema precedenta).
40. Sa se arate ca entropia partial molara intr-o
solutie tinde catre +![]() cu cresterea dilutiei.
cu cresterea dilutiei.
41. Considerand pila care functioneaza pe baza reactiei:
Ag(s) + HgCl(s) = AgCl(s) + Hg(l)
si care are
f.e.m. E = 0,0455 V la 25 oC, sa se calculeze ΔG, ΔS si ![]() .
.
42. O anumita pila galvanica, in care reactia
chimica decurge fara variatie de volum (![]() ) are f.e.m. E = 1 V.
) are f.e.m. E = 1 V.
Daca pila este utilizata la punerea in functiune a unui motor, diferenta de potential dintre electrozii pilei este 0,9 V. Daca randamentul motorului este 90%, sa se calculeze lucrul schimbat de sistemul constituit din motor si pila, pentru fiecare coulomb care trece prin circuit, si sa se calculeze variatia de entalpie libera in pila pentru un coulomb.
43. Daca pila (considerata mai sus) este incarcata cu un generator, potentialul dintre electrozi este 1,1 V. Sa se calculeze lucrul dat pilei si variatia de entalpie libera in pila pentru un coulomb.
*44. O pila galvanica functioneaza la
temperatura si presiune constante. Reactia chimica din
pila are loc cu o variatie de voulm ΔV la trecerea a z![]() . Sa se arate ca
. Sa se arate ca ![]() .
.
*45. Sa se stabileasca expresia potentialului chimic a
componentului 2 intr-o solutie binara daca ![]() .
.![]()
*46. Sa se verifice ecuatia:
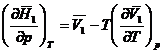
*47. Sa se arate ca:
![]() ,
, ![]() si
si ![]()
*48. De asemenea, sa se arate ca:
![]() ,
, ![]() si
si ![]()
*49. Sa se verifice ca:
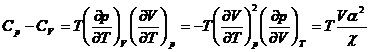
*50. Sa se verifice urmatoarele ecuatii pentru gazul perfect:
![]() ;
; ![]() ;
; 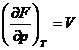 ;
; ![]()
*51. Sa se demonstreze ecuatiile generale:
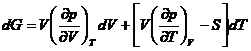
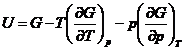
*52. Sa se verifice ecuatia (XIV.62) din text.
*53. Sa se arate ca:
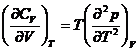
*54. Sa se arate ca:
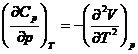
*55. Sa se demonstreze ecuatiile:
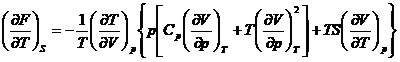
si
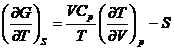
*56. Pentru o anumita substanta la 25 oC si 1 atm se dau urmatoarele date:
![]() ,
, 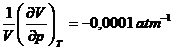 si
si ![]()
Sa se calculeze 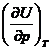 la aceasta temperatura si presiune.
la aceasta temperatura si presiune.
*57. Pentru apa la 25 oC (intre 0 si 1000 atm):
![]()
![]()
S[ se calculeze lucrul de comprimare izoterma la 25 oC pentru 1 mol apa de la 1 la 1000 atm si ΔU, ΔH, ΔF, ΔG si ΔS in acest proces (v. exemplul 16).
58. Sa se arate ca semnul variatiei coeficientului de dilatatie cu presiunea, la temperatura constanta, este contrar semnului variatiei coeficientului de compresibilitate izoterma cu temperatura, la presiune constanta. Se poate generaliza aceasta constatare?
*59. Pentru un mol benzen la T = 298 se indica:
![]() ;
; ![]() si
si ![]()
Sa se calculeze ridicarea de temperatura a benzenului daca presiunea creste brusc cu 1 atm. Valoarea experimentala este 0,024 oC.
Indicatie. Se va folosi relatia:
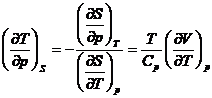
*60. Pentru benzen intre 5 si 80 oC (v. exemplul 16 si problema 59):
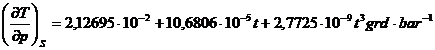
si
![]() (t in oC)
(t in oC)
Pe baza ecuatiei cunoscute (v.exemplul 16), 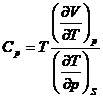 , sa se calculeze Cp
pentru benzen, in Joule si
, sa se calculeze Cp
pentru benzen, in Joule si ![]() , la 20, 50, 80 oC si sa se compare cu
valorile din tabele.
, la 20, 50, 80 oC si sa se compare cu
valorile din tabele.
*61. La presiune obisnuita coeficientul de dilatatie α si caldura specifica cp a apei au urmatoarele valori:
t oC
0
10
20
30
![]()
-6
7,8
20
30
![]()
1,009
1,002
0,9988
0,9975
t oC
40
50
60
![]()
37,5
46
52,3
![]()
0,9974
0,9977
0,9987
Volumul specific al apei in acelasi domeniu de presiune este dat de ecuatia:
![]()
a) Sa se stabileasca ecuatia incalzirii adiabatice
a apei pentru o crestere a presiunii cu 1 atm, la diferite temperaturi,
si sa se compare cu ecuatia experimentala ![]() .
.
b) La presiunea de 500 atm, incalzirea adiabatica este data de ecuatia:
![]()
Valorile coeficientilor de dilatatie si volumele specifice ale apei la diferite temperaturi pentru acest domeniu de presiune sunt:
t oC
0
10
20
30
40
50
60
![]()
9,2
27,3
40,3
46
50
![]()
0,9775
0,9800
0,9775
0,990
0,996
Sa se calculeze valorile caldurii specifice in acest domeniu de presiune (500 atm).
62. La 200 K coeficientul de dilatatie al mercurului solid este ![]()
Coeficientul de compresibilitate izoterma este ![]() , volumul molecular este
, volumul molecular este ![]() ,
, ![]() .
.
Sa se calculeze Cp-CV, CV pentru mercurul solid la 200 K.
63. Iodul solid are la 20 oC un coeficient de
dilatatie liniara de![]() si un coeficient de compresibilitate izoterma de
si un coeficient de compresibilitate izoterma de ![]() .
.
Sa se calculeze Cp-CV
si CV pentru ![]() , daca
, daca ![]() si densitatea
este
si densitatea
este ![]() .
.
64. Intre 0 si 10 oC, volumul specific si caldura specifica (la presiune constanta) a apei la presiunea atmosferica sunt date de ecuatiile:
![]()
![]()
Coeficientul de compresibilitate izoterma:
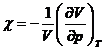 este
este ![]()
a) Sa se calculeze Cp si CV pentru t1 = 0 oC si t2 = 10 oC.
b) Sa se calculeze valorile derivatelor partiale![]() si
si ![]() la 0 oC
si presiunea atmosferica.
la 0 oC
si presiunea atmosferica.
c) In general, volumul specific al apei trebuie exprimat sub forma: ![]() , unde a, b, c sunt
functii de presiune.
, unde a, b, c sunt
functii de presiune.
Sa se calculeze marimea 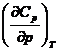 la p = 1atm si 0
oC.
la p = 1atm si 0
oC.
*65. Valoarea aproximativa a presiunii interne a azotului este ![]() la 1 atm si 0
oC. Sa se calculeze α si sa se arate, in procente,
abaterea de la relatia
la 1 atm si 0
oC. Sa se calculeze α si sa se arate, in procente,
abaterea de la relatia ![]() , considerand
valabila legea Boyle-Mariotte.
, considerand
valabila legea Boyle-Mariotte.
66. Doua rezervoare contin gaze diferite in aceleasi conditii.
a) Sa se arate ca variatia de entropie la interdifuziunea a j moli de gaz (1) si 2 j moli gaz (2) este:
![]()
b) Sa se calculeze variatia de entropie pentru j = 0; 0,5; 1; 1,5; 2. Sa se reprezinte grafic.
*67. Un fir de otel de 10 m lungime are o densitate de ![]() , caldura specifica
, caldura specifica ![]() , coeficientul de dilatatie liniara
, coeficientul de dilatatie liniara ![]() , modulul Young
, modulul Young ![]() CGS si un
diametru de 2 mm. Temperatura mediului este de 300 K.
CGS si un
diametru de 2 mm. Temperatura mediului este de 300 K.
a) Sa se calculeze alungirea firului la temperatura constanta pentru o tractiune de 50 kg;
b) Considerand ca tractiunea decurge reversibil si firul este izolat termic, sa se calculeze variatia temperaturii firului.
*68. Firul de otel considerat in problema precedenta este
rasucit. Constanta de torsiune este ![]() ,
, ![]() si
si ![]() .
.
a) Sa se calculeze cuplul aplicat firului la temperatura constanta pentru o rasucire de 10 rad.
b) Presupunand rasucirea reversibila si adiabatica sa se calculeze variatia de temperatura a firului.
69. Sa se reprezinte grafic procesul de incalzire la volum constant, in diferite perechi de coordonate p, V, T, U, H, S.
70. Entalpia de formare a solutiei solide NaCl(1) - NaBr(2) se determina din diferenta dintre caldura de dizolvare in apa a solutiei solide si caldura de dizolvare a componentelor pure.
Experienta stabileste expresia entalpiei de formare a unui
mol solutie solida: ![]() (x = fractia
molara), valabila intre 0 si 350 K. Considerand ca expresia
entropiei de amestec corespunde solutiei ideale, sa se calculeze
variatia de entalpie libera la formarea unui mol solutie
solida cu o compozitie
(x = fractia
molara), valabila intre 0 si 350 K. Considerand ca expresia
entropiei de amestec corespunde solutiei ideale, sa se calculeze
variatia de entalpie libera la formarea unui mol solutie
solida cu o compozitie ![]() la 100 K.
la 100 K.