
|
|
|
Principiul al treilea al termodinamicii
Producerea temperaturilor joase, sub 100 K, prezinta atat un interes tehnic cat si unul fundamental. In 1906, fizicianul olandez K. Onnes a descoperit supraconductivitatea mercurului aflat la temperaturi foarte scazute. In acelasi an, fizicianul german W. Nernst formula pricipiul al treilea al termodinamicii.
Se stia, de asemenea, ca functiile termodinamice pot fi determinate pana la o constanta aditiva. Astfel, entropia intr-un proces reversibil are variatia elementara
![]()
de unde prin intergare, se obtine
![]()
Rezulta ca entropia este o marime definita pana la o constanta aditiva. Datorita faptului ca valoarea sa absoluta intervine in masuratori experimentale, aceasta trebuie determinata exact, lucru imposibil de realizat pe baza primelor doua principii ale termodinamicii.
![]() (1.40)
(1.40)
adica S=S0= constant, la zero absolut, S0 fiind o constanta ce nu mai depinde de parametrii de stare.
Planck formuleaza principiul al treilea al termodinamicii sub forma:
In cazul sistemelor omogene condensate, entropia tinde catre o valoare limita nula, cand temperatura tinde catre zero absolut.
Limitarea formularii Nernst - Planck a principiului al treilea la sistemele condensate omogene este determinata de limitele de aplicabilitate ale ecuatiilor de stare.
Formula
lui Boltzmann permite interpretarea statistica a principiului al treilea
al termodinamicii astfel: la zero absolut, probabilitatea termodinamica ![]() =1, adica unei stari termodinamice macroscopice a
sistemului ii corespunde o singura stare microscopica, incat, in mod
natural, S=0.
=1, adica unei stari termodinamice macroscopice a
sistemului ii corespunde o singura stare microscopica, incat, in mod
natural, S=0.
1. Consecintele principiului al treilea al termodinamicii
1.1. Anularea capacitatilor termice si a coeficientilor termoelastici
In paragrafele anterioare am dedus expresiile diferentialei entropiei la volum si respectiv temperatura constante:
![]()
Integrand cele doua expresii anterioare intre 0 si T obtinem:
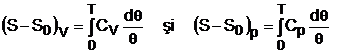
Pentru ca integralele sa aiba valori finite asa cum au membrii din stanga a relatiilor anterioare este necesar ca, valorile capacitatilor termice sa se anuleze atunci cand T tinde la 0 K.
Pentru coeficientii termoelastici se pot stabili expresiile:
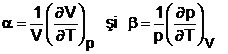
cum insa
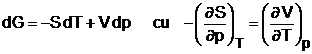

rezulta pentru si expresiile:
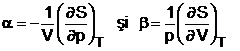 (1.41)
(1.41)
Din relatiile (1.41) se constata ca si coeficientii termoelastici tind la zero atunci cand T tinde spre 0 K.
1.2. Imposibilitatea atingerii temperaturii de 0 K
Pentru a demonstra imposibilitatea atingerii lui zero absolut se considera racirea unui gaz supus susccesiv la compresii izoterme si destinderii izentrope (fig. 1.2) reprezentate intr-o diagrama T; S. In diagrama T - S toate izocorele trebuie sa treaca prin origine deoarece, conform celui de-al treilea principiu S (T; V ) -> 0 cand T -> 0. Se observa ca desi destinderea adiabatica are loc intre aceleasi volume V1 si V2 variatia temperaturii este din ce in ce mai mica pe masura ce temperatura descreste spre zero absolut. Acest fapt arata ca temperatura de 0 K nu poate fi atinsa printr-un numar finit de astfel de procese. Astfel principiul al III-lea al termodinamicii interzice atingerea temperaturii de 0K.

Fig. 1.2