
|
|
|
PRIMUL PRINCIPIU AL TERMODINAMICII
Principiul a fost enuntat in 1845 de catre medicul german J.R. von Mayer. Principiul se refera la conservarea energiei proceselor mecanice si termice in sisteme inchise:
Enunt: pentru orice sistem inchis, se poate defini o functie de variabilele de stare extensive, numita energie E, care este conservativa atat timp cat sistemul nu schimba energie cu mediul exterior sau cu un alt sistem termodinamic.
Variatia energiei unui sistem material, intre doua momente t1 si t2 poae fi pusa sub forma:
E = Ep+Eprod (1.12)
unde Ep este energia schimbata de catre sistem prin suprafata ce-l delimiteaza, si Eprod este energia produsa. Cum nu exista productie de energie totala, Eprod =0, deci E = Ep. Existenta unei productii de energie totala in sistem ar conduce la posibilitatea creearii unui perpetuum mobile de prima speta.
Sub forma locala (diferentiala) relatia (1.12) se scrie:
![]()
Este de remarcat faptul ca dE este diferentiala totala a functiei de stare care este energia, iar Ep nu este o diferentiala totala ci o forma diferentiala.
Se poate defini energia interna U, intrinsec asociata sistemului, prin relatia:
U = E- (Ec-Ep,ext)
unde Ec este energia cinetica macroscopica, iar Ep,ext este energia potentiala asociata fortelor exterioare ce deriva dintr-o energie potentiala.
Energia interna este o functie de stare, deci o diferentiala totala exacta. Energia interna contine doua tipuri principale de contributii: energia cinetica microscopica, care este suma energiilor cinetice a tuturor particulelor componente si energia potentiala asociata tuturor fortelor interne ce se exercita intre particulele sistemului.
1. Schimbul de energie: lucrul mecanic si caldura
Pentru un sistem inchis exista doua tipuri de schimburi de energie : primul este prin lucru mecanic, iar al doilea este prin caldura.
Lucrul mecanic primit de sistem prin suprafata ce-l delimiteaza, din partea fortelor ce se exercita asupra acestei suprafete, este datorat fortelor exterioare macroscopice de contact.
In formularea de mai sus prin caldura vom intelege schimbul de energie ce trebuie adaugat lucrului mecanic primit de sistem pentru a putea scrie bilantul energetic:
Q = Ep - W (1.13)
sau sub forma diferentiala:
Q = Ep - W
Introdusa astfel, caldura apare ca avand origine microscopica. Este de remarcat ca asemenea lucrului mecanic, caldura apare nu ca o energie ci ca o forma de schimb de energie. Caldura si lucrul mecanic sunt functii de proces, deci nu sunt diferentiale totale exacte.
Pentru a sesiza diferenta dintre caldura si lucrul mecanic, vom considera un model constituit din N particule independente, plasate intr-o cutie cubica de latura L. Nivelele de energie ale unei particule sunt date de expresia (aceasta va fi justificata ulterior):
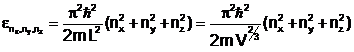 (1.14)
(1.14)
Lucrul mecanic corespunde unei variatii a volumului V al sistemului. Daca V scade, din relatia (1.14) se constata ca nivelele de energie se distanteaza. Daca V creste, nivelele se apropie (fig. 1.1). O variatie a volumului sistemului este acompaniata de o variatie a energiei sistemului. Un transfer de energie mecanica se traduce printr-o schimbare a nivelelor de energie, fara schimbarea modului de ocupare a nivelelor cu particule.

Fig. 1.1
Presupunem acum ca volumul ramane constant. Nivelele de energie sunt fixe si nu are loc un schimb de energie mecanica. Pot avea loc schimbari in modul de ocupare a nivelelor energetice ale particulelor. Aceasta schimbare se traduce printr-o variatie de energie a sistemului ce corespunde unui schimb de caldura.
2. Forma explicita a primului principiu al termodinamicii
Explicitand energia si schimburile energetice intre doua momente t1 si t2, primul principiu al termodinamicii se scrie:
(Ec+Ep,ext+U) = W+ Q (1.15)
sau sub forma diferentiala:
(Ec+Ep,ext+U) = W+ Q
Daca in bilantul energetic neglijam energia cinetica si energia potentiala datorata campurilor de forte externe (aproximatie in general valabila) forma primului principiu se reduce la:
U = W + Q (1.16)
Daca evolutia sistemului termodinamic este ciclica, energia revine la valoarea initiala dupa un ciclu. Rezulta ca:
E = W + Q = 0
Acest rezultat se afla la baza experientei lui Joule ce permite calculul echivalentului mecanic al caloriei prin transformarea completa a lucrului mecanic in caldura. Experienta consta in a furniza lucru mecanic unei cantitati de apa, ceea ce duce la cresterea temperaturii apei. Sistemul este lasat apoi sa cedeze caldura pana revine la temperatura initiala. Se constata ca raportul dintre caldura si lucru mecanic este o constanta ce nu depinde decat de unitatile de masura folosite.
3. Expresia locala a bilantului energetic
Bilantul energetic local intre momentele t si t +d t se scrie:
d
E= Q + W unde ![]() si e=ec+ep,ext+u
si e=ec+ep,ext+u
marimile notete cu litere mici fiind marimi masice si densitatea.
Lucrul mecanic primit de catre fluidul aflat in volumul V, delimitat de suprafata inchisa S, intre t si t+d t, este:
![]()
unde ![]() este versorul normalei
exterioare. Utilizand teorema Ostrogradski:
este versorul normalei
exterioare. Utilizand teorema Ostrogradski:
![]() (1.17)
(1.17)
unde ![]() este vectorul curent
volumic de lucru mecanic. Semnul minus apare deoarece lucrul mecanic este
primit de sistem, iar
este vectorul curent
volumic de lucru mecanic. Semnul minus apare deoarece lucrul mecanic este
primit de sistem, iar ![]() este orientat spre
exterior.
este orientat spre
exterior.
Caldura
primita de fluid, intre momentele t si t + d t poate fi
exprimata prin vectorul curent volumic termic ![]() :
:
![]() (1.18)
(1.18)
Folosind (1.17) si (1.18) bilantil local al energiei totale se scrie:
![]()
din care se poate deduce imediat ecuatia locala de conservare a energiei:
![]() (1.19)
(1.19)