
|
|
|
DICROISMUL CIRCULAR
1. Lumina polarizata liniar si circular
O unda luminoasa elementara, sub forma unui pachet, este emisa la dezexcitarea unui atom, care se comporta analog unui dipol electric oscilant. Vectorul camp electric al undei elementare este orientat de-a lungul axei dipolului. Datorita orientarii haotice a dipolilor elementari ce constituie o sursa luminoasa extinsa, toate directiile de oscilatie ale vectorului luminos sunt egal probabile. Caracteristica de unda a radiatiei luminoase este data de oscilatii perpendiculare pe directia de propagare (vector de oscilatie), in toate planurile, asfel incat, pe sectiune, vectorii de oscilatie ocupa toate diametrele posibile ale unui cerc. Spre deosebire de lumina emisa direct de o sursa, lumina polarizata se caracterizeaza prin oscilatia undelor luminoase intr-un singur plan. Lumina nepolarizata s-ar putea asemui cu un cilindru, pe cand cea polarizata cu o lama (figura 1.a).
Orice unda elementara este polarizata liniar (oscilatiile vectorului camp electric au loc numai intr-un plan ce contine directia de propagare) - figura 1.b, iar o suprapunere aleatorie de unde elementare constituie lumina nepolarizata (lumina naturala) - figura 1.c.
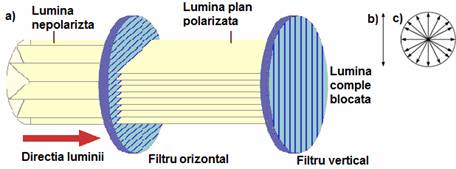
Fig. 1.a) Relatia dintre lumina polarizata si nepolarizata si proiectia vectorului electric pentru b) lumina polarizata liniar si c) lumina nepolarizata
Lumina naturala este lumina nepolarizata deoarece vectorul camp electric poate oscila intr-un numar infint de planuri ce trec prin axa Ox care constituie directia de propagare.
In lumina circular polarizata vectorul camp electric are o lungime constanta dar se roteste de-a lungul directiei de propagare. Astfel se formeaza un helix in timp ce se propaga. Daca este un helix spre dreapta se spune ca lumina este polarizata circular spre dreapta (engl. right circular polarised = RCP) (figura 2.a) iar daca helixul este spre stanga se numeste lumina circular polarizata spre stanga (engl. left circular polarised = LCP) (figura 2.b).
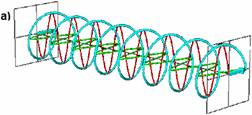
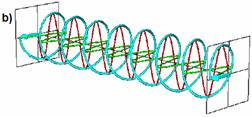
Fig. 2. Lumina circular polarizata spre dreapta (RCP) (a) si spre stanga (LCP) (b)
Lumina liniar polarizata (engl. liniar polarised = LP) este polarizata intr-o anumita directie, adica marimea vectorului camp electric oscileaza intr-un plan, similar unei unde sinusoidale. Toate starile de lumina liniar polarizata poate fi considerata ca suma a doua stari liniar polarizate in unghi drept una fata de cealalta si de obicei raportata fata de observator ca lumina polarizata vertical (figura 3.a) sau lumina polarizata orizontal (figura 3.b).
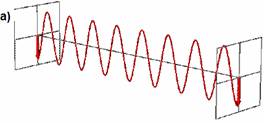

Fig. 3. Lumina liniar polarizata vertical (a) si orizontal (b)
"Dicroism" este un cuvant provenit din Grecia Antica care inseamna "doua culori", deoarece proba de analizat are o culoare daca este iluminata cu radiatie polarizata spre dreapta (RCP) si o culoare diferita daca este iluminata cu o radiatie polarizata spre stanga (LCP).
Ca la orice fenomen de absorbtie a radiatiei aparitia dicroismului circular (CD) este legata de prezenta anumitor grupari chimice capabile sa absoarba radiatia incidenta de o anumita lungime de unda, adica un cromofor. Acest cromofor trebuie sa aiba proprietatea speciala de a absorbi diferit radiatia polarizata spre dreapta si cea polarizata spre stanga, adica trebuie sa fie asimetric in comportamentul la absorbtie. Cromoforii chirali precum si cei legati de un centru chiral indeplinesc aceasta conditie.
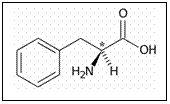 O
molecula ce nu are plan de simetrie sau un centru de inversie este o molecula chirala, de
ex. fenilalanina. Aceste molecule au imagini in oglinda nesuperpozabile.
Cei doi izomeri sunt aproape identici chimic dar interactioneaza
diferit cu lumina polarizata si cu molecule chirale.
O
molecula ce nu are plan de simetrie sau un centru de inversie este o molecula chirala, de
ex. fenilalanina. Aceste molecule au imagini in oglinda nesuperpozabile.
Cei doi izomeri sunt aproape identici chimic dar interactioneaza
diferit cu lumina polarizata si cu molecule chirale.
Asimetria poate fi generata de:
- molecule chirale cum ar fi scheletul peptidic al proteinelor,
- molecula nechirala atasata covalent de o molecula chirala (de ex. catenele laterale ale amino acizilor aromatici) sau
- o molecula nechirala intr-un mediu asimetric (de ex. un cromofor legat de o proteina)
Daca o radiatie liniar polarizata este trecuta printr-o solutie a unei molecule chirale aceasta va roti intr-o anumita directie planul luminii polarizate. Acest efect se numeste "rotatia optica" a fascicolului liniar polarizat la trecerea printr-o proba chirala si se masoara cu un polarimetru. Masurarea (variatiei) rotatiei optice ca functie de lungimea de unda sta la baza spectroscopiei bazate pe dispersia rotatiei optice (engl. optical rotation dispersion = ORD).
Asemanator, la lungimi de unda la care lumina poate fi absorbita de o molecula chirala, lumina circular polarizata spre stanga (LCP) si cea polarizata spre dreapta (RCP) vor fi absorbite in masura diferita. De ex. un cromofor chiral poate absorbi 90% din lumina RCP si 88% din lumina LCP. Acest efect se numeste dicroism circular (engl. circular dichroism = CD)
Spectrele ORD sunt dispersive iar spectrele CD sunt absorbtive. Cele doua fenomene sunt legate prin asa numitele transformari König-Kramers.
Spectroscopia bazata pe dicroism circular masoara diferenta dintre absorbtia de catre un compus optic activ a radiatiei LCP fata de radiatia RCP in functie de lungimea de unda, de obicei in regiunea UV-Viz.
Principiul dicroismului circular (DC)
Campul electric al unui fascicol de lumina determina o deplasare a sarcinii cand interactioneaza cu o molecula, in timp ce campul magnetic determina o rotatie a sarcinii. Aceste doua miscari combinate dau o deplasare elicoidala cand radiatia se ciocneste cu o molecula.
Lumina circular polarizata este ea insasi "chirala", fiind compusa din doua componente polarizate circular opus (adica cantitati egale de lumina polarizata spre stanga si spre dreapta) avand aceeasi faza si amplitudine. Proiectia amplitudinilor combinate perpendicular pe directia de propagare da o linie.
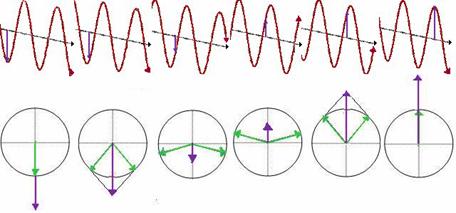
Compunerea vectorului camp electric ↑ din doi vectori ↑ de intensitate egala corespunzatori luminii LPC si RCP
Intr-un experiment de CD o solutie optic activa este iradiata cu lumina circular polarizata care interactioneaza cu molecule chirale cand una dintre cele doua componente ale radiatiei este absorbita mai mult ca cealalta. Aceasta diferenta de absorbtie se masoara in functie de lungimea de unda obtinandu-se spectrul CD al probei. Amplitudinea componentei absorbite mai mult va fi mai mica decat cea a componentei absorbite mai putin. Drept urmare, in acest caz, proiectia amplitudinii rezultate duce la o elipsa si astfel datorita interactiei cu molecula, in timpul propagarii vectorul camp electric descrie o traiectorie eliptica.
De remarcat ca directia de propagare nu s-a modificat. Aparitia elipticitatii se numeste DICROISM CIRCULAR.
Din regulile de descompunere a vectorilor se observa si ca in acest caz vectorul rezultat nu se mai situeaza in acelasi plan de polarizare. Desi dicroismul circular nu este acelasi lucru cu rotatia optica, acolo unde exista CD trebuie sa existe si rotatie si ele sunt direct legate printr-o transformare Kronig-Kramer.
Modificarea rotatiei optice cu lungimea de unda se cheama dispersia rotatiei optice (ORD). ORD este de fapt elipticitatea rezultata din absorbtia luminii liniar polarizate de catre cromofori chirali. ORD a fost inlocuita de spectroscopia bazata pe dicroism circular.
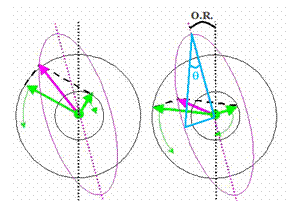 Raportul dintre axa mica si axa mare a elipsei
este prin definitie tangenta unghiului q, numit elipticitate,
in timp ce unghiul O.R. se numeste rotatie
optica. Elipticitatea este o consecinta directa a
prezentei dicroismului circular si elipticitatea este direct
proportionala cu dicroismul circular prin relatia:
Raportul dintre axa mica si axa mare a elipsei
este prin definitie tangenta unghiului q, numit elipticitate,
in timp ce unghiul O.R. se numeste rotatie
optica. Elipticitatea este o consecinta directa a
prezentei dicroismului circular si elipticitatea este direct
proportionala cu dicroismul circular prin relatia:
q= 32,98 CD
Pentru a elimina dependenta de grosimea celulei si de concentratia analitului se poate utilize elipticitatea molara definita ca
![]() unde C este concentratia molara a
substantei absorbante iar l lungimea drumului optic. Factorul 100 se
datoreaza exprimarii l in cm.
unde C este concentratia molara a
substantei absorbante iar l lungimea drumului optic. Factorul 100 se
datoreaza exprimarii l in cm.
Deducerea elipticitatii
La o lungime de unda data: DA = AL - AR
DA reprezinta diferenta dintre absorbanta in lumina polarizata spre stanga, AL, si absorbanta in lumina polarizata spre dreapta, AR, si este marimea care se masoara de obicei.
Aceasta poate fi exprimata aplicand legea Beer: DA = (eL eR) l C
unde eL si eR reprezinta coeficientii molari de absorbtie ai radiatiei LCP respectiv RCP; C este concentratia molara a substantei absorbante iar l lungimea drumului optic. De eL eR
De se numeste dicroism circular molar, reprezinta diferenta dintre coeficientul molar de absorbtie al radiatiilor polarizate spre stanga si spre dreapta (adica diferenta de absorbtie pentru o solutie 1 M intr-o cuva de 1cm) si la aceasta marime se face de obicei referire cand se vorbeste de CD al unei substante.
Desi se masoara DA, din motive istorice majoritatea masurarilor de CD se raporteaza in grade de elipticitate. Oricum, fiecare marime respecta legea Lambert-Beer. Instrumentele CD moderne au o precizie de miligrade.
In general, dicroismul circular este mic, astfel ca
tgq, elipticitatea, poate
fi aproximata ca q in radiani.
Relatia dintre elipticitate, q, si elipticitatea molara, [q], este: ![]()
In literatura exista o serie de moduri de a exprima CD al unei probe. Cele mai uzuale unitati din literatura curenta sunt
elipticitatea medie reziduala (deg.cm2.dmol-1) si
diferenta dintre coeficientii molari de absorbtie, De, (1/M cm sau L mol -1 cm-1)
CD molar [1/(M cm)]
Elipticitatea molara, [q],este legata de diferenta dintre coeficientii molari de absorbtie prin relatia: [q]=3298De
Pentru a calcula elipticitatea molara trebuie cunoscute lungimea de strat (cm), concentratia probei (mol/L sau g/L) si masa moleculara. Daca proba este o proteina aceasta este privita ca o solutie de aminoacizi si in locul masei moleculare se utilizeaza masa reziduala medie (masa moleculara medie a aminoacizilor pe care ii contine).
Absorbtia relativa crescuta a luminii polarizate circular spre stanga duce la semnale CD pozitive, in timp ce semnalele CD negative sunt rezultatul absorbtiei mai intense a luminii polarizate circular spre dreapta.
Aspecte experimentale legate de masurarile prin CD
Efectul concentratiei probei asupra semnalelor CD
Intensitatea semnalelor CD respecta legea Beer fiind proportionale cu concentratia speciei active
Concentratia optima de proteina este functie de grosimea de strat a cuvei folosite. Ca o regua generala absorbanta totala a celulei, tamponului si a proteinei sa fie intre 0,4 si 1,0. Tteoretic, valoarea optima este 0,87. Pentru o celula cu grosimea de strat l = 0,01 cm, aceasta absorbanta corespunde unei concentratii de proteina de aproximativ 0,1-0,5 mg/mL.
Calibrarea instrumentelor si a cuvelor
Calibrarea instrumentului este necesara cel putin o data la 2 luni dar de asemenea trebuie efectuata cel putin o data cu fiecare pereche de cuve cu drum optic scurt. Odata stabilita calibrarea cuvelor aceasta nu mai trebuie repetata.
Pentru calibrarea spectrometrelor de CD se pot utiliza urmatoarele standarde:
-cel mai uzual standard este acidul (+)-10-camforsulfonic (CSA) care in apa la o concentratie de 1mg/mL intr-o cuva cu l=1mm prezinta un pic la 192,5 nm cu intensitatea negativa de 62 mdeg (5,0 milliabsorbanta) si unul la aproximativ 290,5 nm cu o intensitate de 31 mdeg (2,36 milliabsorbanta). Raportul intensitatilor CD la aceste lungimi de unda ar trebui sa fie in jur de -2,00 (de la -2,40 la -2,00), dar imbatranirea lampii de Xe (sau unele probleme in setarea instrumentului) il pot scadea la -1,90.
Tabelul . Proprietatile CD ale acidului (+)-10-camforsulfonic acid (CSA) in apa
|
|
Valoarea, M-1cm-1 |
Valoarea deg cm2 dmol-1 |
|
e285nm |
34,5 |
|
|
q]290,5nm |
|
-7,800 |
|
q]290,5nm |
|
-15,600 |
|
Raport (192,5/290,5)nm |
|
2,000 |
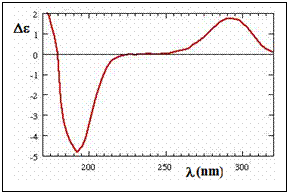
Spectrul CD molar al acidului (+)-10-camforsulfonic (CSA) in apa (1 mg/mL, cuva de 1 mm)
- (S)-(+)-pantolactona
-tartrat de nichel [amestec 1:1 0,36 M tartrat de sodiu si 0,24 sulfat de nichel (II)] este utilizat ca standard pentru regiunea IR apropiat.
Limitari experimentale
Spectrele CD utilizate pentru stabilirea structurii secundare a proteinelor sunt legate de absorbtia legaturilor amidice care are loc la lungimi de unda situate in UV de vid (λ<200 nm). In afara probei, in acest domeniu spectral absorb si oxigenul si unele solutii tampon.
- Pentru eliminarea oxigenului se lucreaza in atmosfera de azot.
- Tamponul borat sau cel continand saruri de amoniu sunt adesea utilizate pentru a stabili domeniul optim de pH pentru experimentele de CD. Unele experimente de CD au fost efectuate doar in apa.
Ideal, se lucreaza cu solutii de tampon foarte diluate 10-50 mM tampon si in UV indeparat se utilizeaza grosimi de strat foarte mici (b=0,1 mm)
In spectroscopia bazata pe dicroism circular in UV-indepartat se pot utiliza si solventi organici ca metanol, etanol, trifluoretanol (TFE) si hexafluoroisopropanol (HFIP). Acestia din urma au avantajul de a induce fromarea anumitor structuri ale proteinei, de exemplu la unele induce formarea a-helixului iar la altele a conformatiei b, care in conditii apoase normale nu sunt prezente. Oricum, solventi organici uzuali ca acetonitril, tetrahidrofuran si cloroform sunt incompatibili cu masurarile de CD in UV-indepartat.
Informatii analitice generate de spectrele CD
In general, CD prezinta benzi de absorbtie produse de orice molecula optic activa. Prin urmare molecule de importanta biologica prezinta dicroism circular datorita moleculelor dextrogire (de ex. unele zaharuri) sau levogire (de ex. unii aminoacizi) continute de acestea.
CD a avut succes limitat in studiul carbohidratilor datorita dificultatilor experimentale legate de masurarile CD din domeniul UV de vid unde derivatii nesubstituiti ai acestor compusi prezinta benzi CD. Hidratii de carbon substituiti care prezinta benzi la lungimi de unda mai mari au fost determinati cu succes.
Structura secundara genereaza un CD specific moleculelor continute. Astfel a-helixul proteinelor si helixul dublu al acizilor nucleici au caractersitici CD reprezentative pentru structurile lor.
Cele trei structuri secundare (aranjamentul spatial local al aminoacizilor) comune (a - helix, conformatia b = conformatia in foaie pliata si structura aleatoare) dau spectre CD distincte in UV indepartat (170-260 nm) (figura ). La aceste lungimi de unda cromoforul este legatura peptidica iar semnalul apare daca aceasta se afla intr-un mediu regulat, pliat.
Cromoforii proteinelor pot fi impartiti in trei clase: legatura peptidica, catenele laterale ale amino acizilor, orice grupare prostetica.
Tranzitia cu cea mai joasa energie in cromoforul peptidic este o tranzitie n → p* observata la 210-220 nm cu intensitate foarte slaba (emax 100). Se compara spectrele CD si UV ale poli-L-lizinei care in functie de pH poate avea trei forme de structura secundara. Aceasta tranzitie apare in forma a-helicoidala a polimerului ca un mic umar aproape de 220 nm ca o coada a unei puternice benzi de absorbtie cu centrul la 190 nm. Acesta banda intensa responsabila pentru absorbanta legaturii peptidice este o tranzitie p →p* (emax 7000).
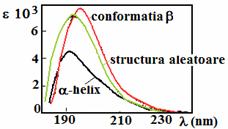
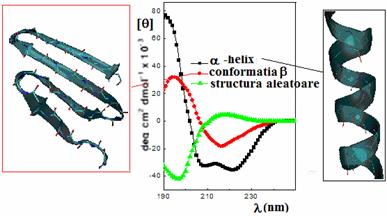
Spectru de absorbtie (a) si spectrul CD (b) al poli-L-lizinei. Conformatia de structura secundara datorata ordinii la distanta in cromoforul amida si spectrele CD (centru) ale elementelor structurale ale unei proteine. In dreapta: scheletul unei peptide (de ex. poli-L-lizina) sub forma de a-helix; in stanga:conformatia sub forma de foaie b
Utilizand CD, aceste tranzitii diferite sunt evidentiate mai clar (nu s-a putut stabili structura secundara din simple spectre UV).
Spectrul CD in UV apropiat (250-350 nm) da informatii despre structura tertiara a proteinelor. Semnalele din aceasta regiune se datoreaza orientarii diplolilor si naturii mediului inconjurator al fenilalaninei, tirozinei, cisteinei (sau a puntilor disulfura S-S) sau triptofanului. Spre deosebire de spectrul CD din UV indepartat, cel din UV apropiat nu poate fi atribuit niciunei structuri 3D
Semnalele din regiunea 250-270 nm sunt atribuibile resturilor de fenilalanina, semnalele din domeniul 270-290 nm sunt atribuibile tirozinei iar cele de la 280-300 nm se pot atribui triptofanului. Legaturile disulfura dau nastere la semnale slabe largi pe intregul domeniu UV-apropiat.
Intensitatea semnalelor este mult mai mica decat a celor obtinute in UV-indepartat.
Suplimentar fata de regiunea UV deasemenea se pot obtine si in VIZ informatii structurale despre proteinele continand cromofori (de ex. hem)
Spectrele CD din domeniul vizibil sunt produse doar cand un ion metalic este intr-un mediu chiral, astfel ca ionii metalici liberi in solutie nu sunt detectati. Astfel spectroscopia CD in domeniul vizibil studiaza interactiile metal-proteina si se pot obtine usor dependenta de pH si stoechiometria.
Aplicatii
Majoritatea moleculelor biologice sunt molecule chirale, de ex. 19 din cei 20 aminoacizi comuni sunt chirali, precum si ADN, ARN ceea ce la face adecvate pentru analiza prin CD acestea constituind si principala aplicatie a tehnicii.
Exemple specifice:
1. se poate determina daca proteina este pliata si daca da, i se caracterizeaza structura secundara, tertiara si familia structurala careia ii apartine.
2. se pot compara:- structurile unei proteine obtinute din diferite surse,
- structuri pentru diferiti mutanti ai aceleasi proteine
- doua macromolecule sau aceeasi molecula in diferite conditii determinandu-se daca au structuri similare.
Acest lucru se poate utilizeaza pentru:
- a se determina daca o proteina mutant s-a pliat corect comparativ cu un tip salbatic;
- analiza produselor biofarmaceutice pentru a determina daca compusul biofarmaceutic este in conformatia activa pliata corect
- a demonstra daca o proteina nou purificata este pliata corect dupa schimbari in procesul de fabricatie (de ex. o imbunatatire a unei etape a procesului, de ex purificare; sau schimbarea locului de productie).
3. studiul stabilitatii conformationale a unei proteine sub stress - stabilitate termica, stabilitate la pH, stabilitate fata de agenti chimici de denaturare - si cum este modificata aceasta stabilitate de natura tamponului sau prin aditia de stabilizatori sau excipienti.
4. determinarea influentei interactiilor proteina-proteina (de ex. formarea complecsilor ligand/receptor sau antigen-anticorp) asupra conformatiei proteinei si evaluarea stabilitatii termice a proteineor individuale in complex; daca exista modificari ale conformatiei acestea vor genera un spectru care difera de suma componentelor individuale.
Spectroscopia CD comparativ cu alte tehnici de biologie structurala:
-CD furnizeaza informatii structurale mai putin specifice decat cristalografia de raze X sau RMN. Oricum, CD este o metoda rapida si necesita doar o cantitate mica (mg) de proteina, de ex. o singura glanda de matase a paianjenului produce suficient material pentru un set de experimente si nici o procesare extensiva de date.
- concentratia proteinei si tamponarea pot fi cele fiziologice;
-CD poate fi utilizata pentru a investiga un numar mare de conditii cum ar fi solvent, temperatura, pH, salinitate si prezenta diferitilor cofactori.
-proteina este studiata in solutie-ceea ce nu este posibil in cristalografia de raze X ea fiind astfel complementara metodelor care studiaza starea solida. Pe de alta parte acest lucru constituie o limitare deoarece, in stare nativa multe proteine sunt inglobate in membrane iar solutiile continand structuri membrane adesea difuzeaza puternic radiatia. Uneori CD se masoara in filme subtiri.