
|
|
|
Criterii generale de echilibru si stabilitate
O conditie necesara pentru posibilitatea de transformare este data de ecuatia (XIV.1), care poate fi scrisa sub forma:
![]() (XIV.14)
(XIV.14)
(pentru transformarile posibile se pastreaza numai semnul inegalitatii, iar egalitatea corespunde transformarilor reversibile). Echilibrul exista evident pentru orice transformare imaginabila, compatibila cu conditiile fixe date, daca conditia de mai sus nu este indeplinita, adica:
![]() (XIV.15)
(XIV.15)
in care ![]() se refera la o
transformare virtuala infinit de mica in starea sistemului. In cazul
cand conditiile fixe sunt exprimate prin ecuatii si nu prin
inegalitati, evident ca in relatia (XIV.15) trebuie
mentinut numai semnul egalitatii. Introducand caldura
necompensata si considerand
se refera la o
transformare virtuala infinit de mica in starea sistemului. In cazul
cand conditiile fixe sunt exprimate prin ecuatii si nu prin
inegalitati, evident ca in relatia (XIV.15) trebuie
mentinut numai semnul egalitatii. Introducand caldura
necompensata si considerand ![]() , ecuatia (XIV.15) capata formele:
, ecuatia (XIV.15) capata formele:
![]() (XIV.16a)
(XIV.16a)
![]() (XIV.16b)
(XIV.16b)
![]() (XIV.16c)
(XIV.16c)
![]() (XIV.16d)
(XIV.16d)
care permit stabilirea conditiilor de echilibru.
Ecuatia (XIV.16a) arata ca, la echilibru, la S si V constante, U este minim:
![]() ;
; ![]() (XIV.17)
(XIV.17)
pentru V si U constante, S este maxim:
![]() ;
; ![]() (XIV.18)
(XIV.18)
pentru U si S constante,V este minim:
![]() ;
; ![]() (XIV.19)
(XIV.19)
In mod asemanator se obtin conditiile de echilibru din ecuatiile (XIV.16b), (XIV.16c) si (XIV.16d) :
![]() ;
; ![]() (minim) (XIV.20)
(minim) (XIV.20)
![]() ;
; ![]() (maxim)
(XIV.21)
(maxim)
(XIV.21)
![]() ;
; ![]() (maxim) (XIV.22)
(maxim) (XIV.22)
![]() ;
; ![]() (minim) (XIV.23)
(minim) (XIV.23)
![]() ;
; ![]() (minim) (XIV.24)
(minim) (XIV.24)
![]() ;
; ![]() (minim) (XIV.25)
(minim) (XIV.25)
![]() ;
; ![]() (minim) (XIV.26)
(minim) (XIV.26)
![]() ;
; ![]() (minim) (XIV.27)
(minim) (XIV.27)
![]() ;
; ![]() (maxim) (XIV.28)
(maxim) (XIV.28)
Din ecuatia (XIV.15), pentru ![]() , se obtine (v. si ecuatia XIV.5):
, se obtine (v. si ecuatia XIV.5):
![]() ;
; ![]() (maxim) (XIV.29)
(maxim) (XIV.29)
Exemplul
14. Sa se
calculeze Q, W, ![]() S,
S, ![]() U,
U, ![]()
![]() F si
F si ![]() la vaporizarea unui
mol benzen la temperatura normala de fierbere.
la vaporizarea unui
mol benzen la temperatura normala de fierbere.
Rezolvare:
In exemplul XIV.4, pentru procesul ![]() (T = 353,2 K; p = 1 atm),
s-a obtinut
(T = 353,2 K; p = 1 atm),
s-a obtinut ![]() S = +20,8 u.e Caldura schimbata este:
S = +20,8 u.e Caldura schimbata este:
![]()
iar lucrul de presiune este:
![]()
Se calculeaza variatia energiei interne:
![]()
a energiei libere:
![]() F =
F = ![]() U - T
U - T![]() S = W = -700 cal · mol-1
S = W = -700 cal · mol-1
si a entalpiei libere:
![]() (echilibru)
(echilibru)
Exemplul 15. Presiunile de vapori ale ghetii si apei la -15 oC sunt 1,257, respectiv 1,439 mm.col Hg. Sa se calculeze entalpia libera de topire a ghetii la aceasta temperatura.
Rezolvare:
Calculul variatiei de entalpie libera trebuie facut pe baza unui proces reversibil asociat. Considerand urmatoarea schema de transformare reversibila 1, 2, 3:
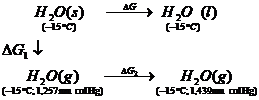
se obtine ![]() (variatia de
entalpie libera nu depinde de drumul urmat). ΔG1 si ΔG3
sunt nule (echilibru), iar pentru transformarea celei de-a doua
reversibila (v. exemplul XIV.12), se obtine:
(variatia de
entalpie libera nu depinde de drumul urmat). ΔG1 si ΔG3
sunt nule (echilibru), iar pentru transformarea celei de-a doua
reversibila (v. exemplul XIV.12), se obtine:
![]()
Valoarea pozitiva a variatiei de entalpie libera indica procesul nenatural.
Sensul procesului natural corespunde cristalizarii apei lichide (subracite), adica procesul natural este invers topirii.