
|
|
|
Identificarea substantelor medicamentoase de natura anorganica se face pe baza reactiilor specifice cationilor si anionilor, dupa incadrarea in grupele analitice.
Vor fi tratati numai ionii medicamentosi.
Analiza cationilor
Pentru punerea in evidenta a cationilor se aplica initial separarea in grupe (conform tabelului).
Tabelul 2.1 Incadrarea cationilor in grupe analitice
|
Nr.grupei |
Reactivul de grupa |
Ionii care reactioneaza |
Culoarea precipitatului |
|
I |
|
|
alb |
|
II |
|
|
negru brun galben portocaliu |
|
III |
|
|
alb negru roz |
|
IV |
|
|
alb |
|
V |
|
|
Fiecare cation prezinta reactii specifice |
I.) Grupa I
Din aceasta grupa fac parte compusii medicamentosi ai argintului, mercurului (I) si plumbului.
A) Reactii generale
1.) Reactia cu acidul clorhidric
Ionul clorura precipita cu ionii Ag+,Hg22+ si Pb2+ precipitate albe cu aspect si solubilitate diferita, reactie ce serveste atat pentru incadrarea in grupa cat si pentru identificarea fiecarui cation:
Me2+ + 2Cl- MeCl2
Me+ + Cl- MeCl
Tehnica:
-0,02g substanta se trateaza cu 2 ml H2O, se aciduleaza cu HNO3 dil.(R) si solutia se trateaza cu 2 picaturi HCl (R); se formeaza un precipitat alb. Precipitatul obtinut se solubilizeaza la incalzire in cazul plumbului.
La tratare cu exces de reactiv se solubilizeaza clorura de argint si clorura de plumb.
La tratare cu amoniac se solubilizeaza clorura de argint si clorura de plumb, iar clorura mercuroasa se innegreste datorita unei reactii de disproportionare, care duce la formarea cloramidurii de mercur(II) si a mercurului metalic.
Hg2Cl2 + 2NH3 HgClNH2 + Hg + NH4Cl
2.) Reactia cu ioduri alcaline
Ionii Ag+,Hg22+ si Pb2+ precipita cu iodurile alcaline, formand precipitate ce permit pe baza coloratiei diferite, diferentierea lor.
Ag+ si Pb2+ formeaza ioduri galbene, iar in cazul ionului Hg22+ apare un precipitat verde-galbui de iodura de Hg22+, solubila in exces de reactiv cu formarea unui complex si separarea de Hg metalic pe baza unei reactii caracteristice de disproportionare:
Hg22+ + 2I- Hg2I2
Hg2I2 + 2I- [HgI4]2- + Hg
Tehnica:
-0,2 g substanta se trateaza cu 2 ml apa, se adauga 2 ml iodura de potasiu (R) si se formeaza un precipitat galben sau verde-galbui, dependent de natura ionului.
3.)Reactia cu amoniac
Ionii Ag+,Hg22+ si Pb2+ formeaza cu amoniacul diluat (R) un precipitat negru sau alb. Ionii de Ag+,Hg22+ formeaza un precipitat negru (oxid de argint, hidroxid de mercur) solubil in cazul argintului in exces de reactiv; Pb2+ formeaza un precipitat alb (hidroxid de plumb). In exces de amoniac se solubilizeaza oxidul de argint cu formarea hidroxidului diaminoargentic.
Tehnica :
-0,2g substanta se trateaza cu cateva picaturi de amoniac dil.(R); se obtine un precipitat negru sau alb.
II) Grupa a II-a
In aceasta grupa se incadreaza compusii medicamentosi ai Cu, Bi, Hg, As, Sb.
A) Reactii generale
1.) Reactia cu sulfura de sodiu in mediu acid
Sulfura de sodiu in mediu acid precipita cationii din aceasta grupa analitica.
Me2+ + S2- MeS
2Me3+ + 3S2- Me2S3
Tehnica:
-0,10g substanta se dizolva in apa, se aciduleaza cu acid clorhidric conc.(R) pH=1, si se trateaza cu sulfura de sodiu picatura cu picatura. Precipita ionii de arsen si stibiu ca sulfuri de culoare galben-portocalie, ionii de cupru si mercur(II) ca precipitate de culoare neagra .Ionii de bismut precipita ca sulfura de culoare bruna.
Observatii:
a.) Realizarea pH-ului este foarte importanta, deoarece la pH=2,7 precipita si zincul.
b.) Pe baza comportarii diferite a sulfurilor rezultatele fata de reactivul utilizat (sulfura de sodiu, sulfura de amoniu sau polisulfura de amoniu), ele se pot diferentia:
cu sulfura de sodiu (R) in exces se dizolva HgS, As2S3 si Sb2S3, iar Bi2S3 este putin solubil:
HgS + Na2S Na2HgS2
As2S3 + 3Na2S 2AsS3Na3
Sulfurile de cupru si de plumb sunt insolubile.
cu sulfura de amoniu si polisulfura de amoniu se dizolva As2S3 si Sb2S3, iar Bi2S3, CuS, PbS, HgS sunt insolubile:
As2S3 + 2(NH4)2S2 + (NH4)2S 2(NH4)3AsS4
B) Reactii specifice
a.) Ionul Cu2+ - Reactia cu amoniac
Cu2+ formeaza cu amoniacul un precipitat albastru- verzui, cu aspect pulverulent, solubil in exces de reactiv:
CuSO4 + 2NH4OH CuSO4.Cu(OH)2 + (NH4)2SO4
CuSO4.Cu(OH)2 + 6NH3 + (NH4)2SO4 2[Cu(NH3)4]SO4 + 2H2O
Tehnica:
-0,10g substanta se dizolva in 2 ml apa, se adauga picatura cu picatura ammoniac diluat(R), cand apare un precipitat albastru-verzui cu aspect pulverulent. Pprecipitatul format se dizolva in exces de reactiv, iar solutia se coloreaza in albastru.
b.) Ionul Hg2+ - Reactia cu iodura de potasiu
Ionii Hg2+ reactioneaza cu solutia de iodura de potasiu(R) formand un precipitat rosu-caramiziu de iodura de mercur, solubil in exces de reactiv, cu formarea unui complex incolor de tetraiodomercuriat de potasiu:
Hg2+ + 2I- HgI2
HgI2 + 2I- [HgI4]2-
Tehnica:
-0,1g substanta se dizolva in 2 ml apa, se adauga picatura cu picatura iodura de potasiu (R) pana la obtinerea unui precipitat rosu. In exces de reactiv precipitatul se dizolva, iar solutia devine incolora.
c.) Ionul Bi3+
1) Reactia de calcinare
Prin calcinare in tubusor sau pe capac de creuzet, sarurile de bismut se transforma in oxid de bismut de culoare galbena persistenta.
2)Reactia cu iodura de potasiu
Ionul Bi (III), in solutie acida, formeaza la tratare cu o solutie diluata de iodura de potasiu, un precipitat negru care trece in portocaliu in exces de reactiv.
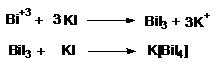
Tehnica:
- 0,1 g substanta se trateaza cu 1 ml acid clorhidric (R), 2 ml apa si se adauga iodura de potasiu (R). Se formeaza un precipitat negru care trece in portocaliu in exces de reactiv.
d.) Ionul As3+ - Reactia cu hipofosfit in mediu acid (Reactia Bougault)
Ionii As3+ sub actiunea hipofosfitilor in mediu acid, sunt redusi la As metalic negru-brun:
4AsCl3 + 3H3PO2 + 6H2O 4As + 3H3PO4 + 12HCl
Tehnica:
-0,05g substanta se trateaza cu 2 ml reactiv hipofosforos (R) si se aduce pe baia de apa in fierbere, unde se lasa 20-30 minute. Apare un precipitat brun. Reactia este pozitiva si in cazul As5+ .
e.) Ionul Sb3+ - Reactia cu pirogalol
Sarurile de stibiu formeaza cu pirogalolul in mediu slab acid un precipitat de culoare alba. Reactia serveste la diferentierea stibiului de arsen.
Tehnica:
-0,1g substanta se dizolva in apa acidulata, se adauga 1 ml pirogalol 2% si apare un precipitat alb.
Observatie: ionul Bi3+ da o combinatie analoaga.
III) Grupa a III-a
Din aceasta grupa fac parte compusii medicamentosi ai Zn, Al, Mn, Cr, Fe.
A) Reactii generale
Cationii din sarurile organice se identifica dupa o prealabila calcinare.
Reactia cu sulfura de amoniu
Cationii grupei a III-a precipita cu sulfura de amoniu in mediu de hidroxid de amoniu si clorura de amoniu , sub forma de sulfuri, cu exceptia Al3+ care precipita sub forma de hidroxid. pH-ul optim pentru precipitare este cuprins intre 8-9.
Tehnica:
-0,1g substanta se dizolva in apa, se adauga clorura de amoniu (R) si amoniac(R) pana la reactie alcalina si se precipita la fierbere cu sulfura de amoniu. Culoarea precipitatului da indicatii asupra elementelor prezente (albe pentru Zn(II) si Al(III) si negre pentru Fe).
B) Reactii specifice
a) Reactii specifice ionilor Zn2+ si Al3+ - Reactia cu hidroxizi alcalini sau de amoniu
Ionii Zn2+ si Al3+ formeaza cu hidroxizii alcalini precipitate albe gelatinoase, solubile in exces de reactiv:
Al3+ + 3HO- Al(OH)3
Al(OH)3 + HO- [Al(OH)4]-
Zn2+ + 2HO- Zn(OH)2
Zn(OH)2 + 2HO- ZnO22- + 2H2O
Tehnica:
-0,2g substanta se dizolva in 2 ml apa, se trateaza picatura cu picatura cu hidroxid de sodiu 10% (R) si se formeaza un precipitat alb gelatinos, solubil in exces de reactiv. In cazul aluminiului, la adaugare de 0,1g clorura de amoniu (R), precipitatul reapare.
Observatie: Co2+ formeaza un precipitat albastru insolubil in alcalii. Ionii Mn2+, Fe2+, formeaza precipitate de culoare alba, foarte sensibile la aer, colorandu-se in brun, iar Fe3+ un precipitat brun roscat . Aceste precipitate se dizolva partial in exces de hidroxid de sodiu (R) si sunt insolubile in amoniac (R).
b) Ionul Zn2+
1) Reactia de calcinare
Prin incalzire pe carbune, in amestec cu carbonati, sarurile de zinc se transforma in oxid de zinc, de culoare galbena la cald si alba la rece.
2) Reactia cu ditizona
Ionii Zn2+ formeaza cu ditizona un complex intern colorat in rosu purpuriu:
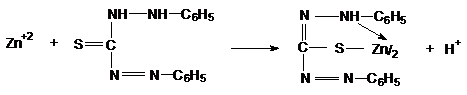
Tehnica:
-pe o sticla de ceas se pun cateva picaturi din solutia sarii de zinc, se adauga o picatura de ditizona si apare o coloratie rosie-purpurie.
3) Reactia cu alizarina S (specifica aluminiului): in prezenta alizarinei S, sarurile de aluminiu formeaza un complex intern de culoare rosie:
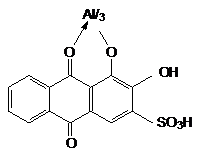
Tehnica:
- o picatura solutie apoasa de sare de aluminiu, acidulata cu acid acetic diluat, se depune pe o hartie de filtru imbibata cu o solutie alizarina S 1 %. Dupa expunerea hartiei la vapori de amoniac apare o coloratie violeta.
c) Ionul Co2+ - Reactia cu piridina si tiocianat de potasiu
Piridina formeaza cu sarurile de Co2+ in prezenta tiocianatilor alcalini un complex intern:
![]()
Tehnica:
-0,05g substanta se dizolva in 2 ml apa, se trateaza cu 0,5g tiocianat de potasiu (R) si se formeaza o coloratie albastra. Se incalzeste la fierbere si se adauga 2 ml piridina. Dupa racire se depune un precipitat roz-cristalin.
Observatie: In prezenta Cu2+ se obtine un precipitat verde.
d) Ionul Mn2+ - Reactia Deniges
Apa de brom in mediu puternic alcalin oxideaza in prezenta urmelor de sulfat de cupru ionul Mn2+ la Mn7+:
2Mn(OH)2 + 5Br2 + 12NaOH NaMnO4 + 10NaBr + 8H2O
Tehnica:
-0,05g substanta se dizolva in 2 ml apa, se trateaza cu 3 ml KOH 4N, apa de brom(R) in exces si 2 picaturi CuSO4 (R). Se incalzeste la fierbere, cand precipita oxidul cupric negru, se lasa in repaus, cand lichidul supernatant se coloreaza in violet.
e) Ionul Fe2+
1) Reactia cu hexacianoferatul (III) de potasiu
Ionii Fe2+ formeaza cu K3[Fe(CN)6] un precipitat albastru voluminous (albastrul lui Turnbull):
3Fe2+ + 2[Fe(CN)6]3- Fe3[Fe(CN)6]2
Tehnica:
-0,1g substanta se dizolva in 1 ml acid clorhidric (R), se adauga cateva picaturi de hexacianoferat (III) de potasiu (R). Se formeaza un precipitat albastru.
2) Reactia cu orto-fenantrolina
Ionii ferosi formeaza cu o-fenantrolina un complex colorat in rosu:
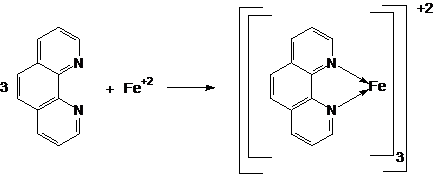
Tehnica:
-0,1g substanta se dizolva in apa usor acidulata, se adauga cateva cristale mici de clorhidrat de hidroxilamina, 1-2 ml solutie de o-fenantrolina 0,5% . Apare o coloratie rosie.
Observatie:Ionul Fe (III) in aceste conditii formeaza un complex de culoare albastra.
f) Ionul Fe3+
1) Reactia cu hexacianoferatul (II) de potasiu
Ionii Fe3+ reactioneaza cu K4[Fe(CN)6] formand un precipitat de hexacianoferat II de Fe III, de culoare albastra (albastru de Berlin sau albastru de Prusia):
4Fe3+ + 3[Fe(CN)6]4- Fe4[Fe(CN)6]3
Tehnica:
-0,1g substanta se dizolva in 2 ml apa, se adauga 3 picaturi K4[Fe(CN)6] (R), apare un precipitat albastru.
Observatie: Ionul Zn2+ formeaza cu acest reactiv un precipitat alb-cristalin, insolubil in acizi minerali, solubil in hidroxizi alcalini.
2) Reactia cu fenolii (acidul salicilic)
Ionii Fe3+ reactioneaza cu gruparile fenolice formand complecsi solubili, colorati diferit. In cazul acidului salicilic se obtine un complex de culoare violet cu structura :
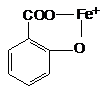
Tehnica :
-0,1g substanta se dizolva in 2 ml apa, se trateaza cu o solutie apoasa de acid salicilic 0,2% si apare o coloratie rosie-violeta.
IV) Grupa a IV-a
In aceasta grupa intra compusii medicamentosi ai Ca, Ba, Sr.
A) Reactii generale
Reactia cu carbonat de amoniu
Carbonatul de amoniu precipita ionii acestei grupe la pH=8-9, sub forma de precipitate albe solubile in acizi minerali si acid acetic:
Me2+ + (NH4)2CO3 MeCO3 + 2NH4+
MeCO3 + 2H+ Me2+ + CO2 + H2O
Tehnica:
-0,02g substanta se dizolva in 1 ml apa, se adauga cateva picaturi de carbonat de amoniu (R), cand se formeaza un precipitat alb.
B) Reactii specifice:
a) Ionul Ca2+
1) Reactia flacarii: sarurile de Ca2+, umectate cu acid clorhidric diluat (R) coloreaza flacara incolora a unui bec de gaz in rosu-caramiziu.
Observatie: Pentru sarurile organice de Ca2+ reactia se efectueaza pe reziduul de la calcinare.
2) Reactia cu oxalatul de amoniu
Ionul Ca2+ precipita cu oxalatul de amoniu un precipitat alb, insolubil in acid acetic atat la rece cat si la cald.
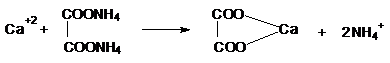
Tehnica:
-0,10g substanta se dizolva in 2 ml acid acetic 30%, se trateaza cu 2-3 picaturi oxalat de amoniu (R); apare un precipitat alb cristalin.
Observatie: Ionul Sr2+ formeaza cu oxalatul de amoniu un oxalat partial solubil in acid acetic, iar ionul Ba2+ un oxalat solubil in acid acetic.
b) Ionul Ba2+
1) Reactia flacarii- sarurile de Ba2+ umectate cu acid clorhidric diluat (R) coloreaza flacara incolora a unui bec de gaz in galben-verde.
2) Reactia cu anionul SO42-
Ionii Ba2+ formeaza cu ionul SO42- un precipitat insolubil in apa si acizi concentrati, solubil numai in acid sulfuric concentrat la fierbere cu formarea sulfatului acid de bariu. Ba2+ + SO42- BaSO4
BaSO4 + H2SO4 Ba(HSO4)2
Tehnica:
-0,2g substanta se dizolva in 2 ml apa, se trateaza cu cateva picaturi acid sulfuric diluat (R). Apare un precipitat cristalin, insolubil in acizi minerali, solubil in acid sulfuric (R) la fierbere.
Observatie: Ionul Ca2+ formeaza un precipitat partial solubil in apa, solubil in acizi minerali. Ionul Sr2+ formeaza un precipitat solubil in acizi minerali diluati.
c) Ionul Sr2+
Reactia flacarii:- sarurile de Sr2+ umectate cu acid clorhidric diluat (R) coloreaza flacara unui bec de gaz in rosu -carmin.
V) Grupa a V-a
Din aceasta grupa fac parte compusii medicamentosi ai Li, Na, K, Mg, NH4. Acesti cationi nu prezinta un reactiv general de grupa. Fiecare cation va fi identificat prin reactiile sale specifice.
a) Ionul Li+
1) Reactia flacarii: -sarurile de Li+ coloreaza flacara incolora a unui bec de gaz in rosu-carmin.
2)Reactia cu fosfat disodic
Ionul Li+ formeaza cu fosfatul disodic in prezenta hidroxizilor alcalini la cald, un precipitat alb de fosfat neutru de litiu:
3Li+ + HPO42- + HO- Li3PO4 + H2O
Tehnica:
-0,2g substanta se dizolva in 2 ml acid clorhidric diluat (R), se adauga picatura cu picatura hidroxid de sodiu 10% (R) pana la reactie alcalina si se trateaza cu 1 ml fosfat de sodiu (R). Se incalzeste la fierbere, cand se formeaza un precipitat alb-cristalin.
Observatie: reactia are loc si pentru ionul Mg2+ dar in prezenta sarurilor de amoniu.
b) Ionul Na+
1) Reactia flacarii - Ionul Na+ coloreaza flacara incolora a unui bec de gaz in galben intens. Reactia este foarte sensibila.
2)Reactia cu hexahidroxostibiat (V) de potasiu
In mediu neutru sau slab alcalin, ionii de Na+ formeaza cu acest reactiv un precipitat alb microcristalin:
Na+ + [Sb(OH)6]- Na[Sb(OH)6]
Tehnica:
-0,05g substanta se dizolva in apa, se adauga cateva picaturi de hexahidroxostibiat de potasiu, cand apare un precipitat alb microcristalin. Reactia este favorizata prin frecarea peretilor eprubetei cu o bagheta.
Observatie: Aceasta reactie este data si de Mg2+ .
c) Ionul K+
1) Reactia flacarii: ionii K+ coloreaza flacara incolora a unui bec de gaz in violet.
2)Reactia cu acid tartaric
Ionul K+ formeaza cu acidul tartric un precipitat alb cristalin de tartrat acid de potasiu, usor solubil in acizi minerali si hidroxizi alcalini, dar insolubil in acid acetic:

Tehnica:
-0,2g substanta se dizolva in 2 ml apa, se adauga 0,5g acetat de sodiu (R) si 4 ml acid tartric (R). Se formeaza un precipitat alb cristalin, favorizat prin frecarea peretilor eprubetei cu o bagheta.
Observatie: este important sa fie in exces ionul tartaric deoarece un exces de ioni K+ formeaza sarea dipotasica a acidului tartric, solubila.
Reactia este data si de ionul NH4+.
b) Ionul NH4+
1)Reactia cu hidroxizi alcalini
Hidroxizii metalelor alcaline descompun sarurile de amoniu punand in libertate ammoniac, care poate fi pus in evidenta prin miros sau prin albastrirea unei hartii de turnesol.
NH4+ + HO- NH3 + H2O

Tehnica:
-0,10g substanta se dizolva in 1 ml apa si se trateaza cu 2 ml hidroxid de sodiu 10 % (R). Se incalzeste usor, cand se degaja vapori de amoniac. Daca deasupra eprubetei se tine o hartie rosie de turnesol se observa colorarea acesteia in albastru. La fel se intampla si cu hartia indicator universal care va indica domeniul de pH bazic in prezenta amoniacului.
2)Reactia cu reactivul Nessler (tetraiodomercuriatul (II) depotasiu in mediu alcalin)
Ionul amoniu formeaza cu tetraiodomercuriatul (II) de potasiu in mediu alcalin un precipitat rosu-brun.
NH4+ + KOH NH3 + K+ + H2O
Tehnica:
-0,10g substanta se dizolva in 2 ml apa, se adauga 1 ml hidroxid de sodiu 10% (R) si 0,10 ml reactiv Nessler. Apare o coloratie sau un precipitat rosu-brun.
c) Ionul Mg2+
1) Reactia cu hidroxizi alcalini
Ionii Mg2+ formeaza cu hidroxizii alcalini un precipitat alb, solubil in acizi minerali, acid acetic si clorura de amoniu.
Mg2+ + 2HO- Mg(OH)2
Tehnica:
-0,2g substanta se dizolva in apa, se trateaza cu 0,5 ml hidroxid de sodiu 10% (R), apare un precipitat alb.
Observatie: Aceasta reactie diferentiaza Mg2+ de ceilalti cationi ai grupei a V-a.
2)Reactia cu hidrogenofosfatuldisodic
Ionii Mg2+, in prezenta tamponului amoniacal, formeaza cu fosfatul acid de sodiu un precipitat alb cristalin de fosfat de magneziu si amoniu, solubil in acizi minerali si acid acetic.
Mg2+ + HPO42- + NH3 MgNH4PO4
Tehnica:
-0,2g substanta se dizolva in 1 ml apa, se adauga 1 ml clorura de amoniu (R), 1 ml monohidrogenfosfat de sodiu (R) si amoniac diluat (R) pana la reactie alcalina. Se formeaza un precipitat alb cristalin.