
|
|
|
Catalizatorii metalici suportati sub forma unor cristalite foarte mici (cu particule mai mici de 0.3 nm) sint o clasa foarte importanta de catalizatori heterogeni cu aplicatii in catalizarea reactiilor de hidrogenare, dehidrogenare, oxidare, izomerizare, reformare si hidrogenarea CO [1-4]
Activitatea catalitica specifica a platinei suportate, care poate varia pentru unele reactii prin citeva ordine de marime, a fost studiata ca functie de marimea particulelor metalice
[5-7], de metoda de preparare [8]sau de support [9,10]. In incercarea de a intelege mai bine factorii care afecteaza comportarea lor catalitica, au fost luate in considerare dimensiunea particulelor, factori geometrici si electronici, dar explicatia reala a efectului acestora asupra activitatii catalitice ramine neclara. Unele studii asupra Pt/TiO2 sau pe alti oxizi din grupa a V-a au condus la speculatii interesante privind rolul interactiilor electronice intre metal si support in timpul chemosorbtiei [11-13]. Conform rezultatelor publicate de Lewis [14], caracteristicile de absorbtie de raze X ale unor cristalite foarte mici de platina (14-26 Ĺ), suportate pe Al2O3, dupa un tratament de reducere, au fost similare cu cele ale cristalelor mari de platina, prezentind benzile caracteristice 6s, 6p si 6d ale platinei metalice. Pentru catalizatorii calcinati, cu o concentratie mica a platinei pe suport, s-a pus in evidenta prezenta unei faze complexe bidimensionale (Pt- Al2O3-Cl sau PtO2- Al2O3), care interactioneaza puternic cu suportul [14,-16]
Au fost studiate schimbari cantitative in proprietatile electronilor d ale platinei in functie de suport si de conditiile de reducere pentru catalizatori de platina cu un grad inalt de dispersie [17] . Prin folosirea unei tehnici speciale de a determina cantitativ numarul de stari d neocupate cu ajutorul spectroscopiei de absorbtie de raze X s-a aratat ca platina in Pt/SiO2 este complet redusa dupa 200oC si nu prezinta alte schimbari masurabile la temperaturi mai mari. In schimb, Pt/Al2O3 (1%Pt) prezinta inca o deficienta electronica semnificativa dupa reducerea la 200oC,deficienta care este eliminata prin reducerea la 500oC. In cazul acestei probe, proprietatile electronice si proportia medie de transfer de electroni catre suport este puternic dependenta de temperatura de reducere cu hidrogen; proprietatile electronice ale acestui catalizator sint substantial diferite de cele ale Pt/SiO2 dupa reducerea la 200oC, dar diferentele devin mult mai mici dupa reducerea la 500oC. Deficienta relativa in electroni in presenta hidrogenului (in raport cu platina metalica) a fost evaluata la 0.06 si 0.09 electroni/atom de Pt pentru Pt/SiO2 si respectiv Pt/Al2O3 ca urmare a reducerii la 200oC, iar aceasta deficienta se reduce la 0.03 prin reducerea la 500oC, ceea ce sugereaza ca atunci cind platina este depusa pe un support de alumina isi conserva o stare de oxidare mai stabila la incalzire. Deficienta electronica aparenta este intretinuta de prezenta hidrogenului; intr-adevar, degazarea prin vidare la temperatura ridicata pentru indepartarea hidrogenului chemosorbit duce la eliminarea acestei deficiente dupa reducerea la temperatura inalta.
S-a aratat ca functie de cantitatea de platina depusa pe support, pe linga faza dispersata care interactioneaza cu suportul de alumina, mai apare o faza separata de oxid de platina, a carei cantitate creste cu cresterea cantitatii globale de platina[16]. Masuratorile TPR au aratat ca in timp ce PtO2 bulk se reduce la ~25oC,, in cazul platinei suportate reducerea decurge distinct la 25 si respective 190oC (pentru 7,4% Pt) si respective intre 180 si 310oC la o viteza de incalzire de 8oC/min pentru cazul unui catalizator cu 0.78% Pt., ceea ce indica faptul ca alumina interactioneaza mult mai puternic cu platina si acest lucru este oglindit si in proprietatile catalitice specifice ale celor doi catalizatori. Astfel, Pt/SiO2 este de aproape 10 ori mai activa (asa cum rezulta din evaluarea activitatii specifice) decit Pt/Al2O3 in oxidarea NH3 [18]. Aceasta dovedeste ca deoarece alumina pare sa aiba o influenta semnificativa asupra platinei, tipuri diferite de alumina si conditii de pretratament diferite vor influenta comportarea specifica a platinei suportate. Acest lucru demonstreaza prezenta unei interactii semnificarive intre metal si support, atunci cind acesta din urma este un oxid nereductibil; problema intelegerii acestei interactiuni este de fapt corelata cu problema mai larga privind natura interactiilor observate pentru oxizi reductibili, cum ar fi TiO2 [11-13]
Problema devine mai complexa atunci cind suportul insusi este un amestec de oxid nereductibil (Al2O3) si respectiv un oxid reductibil, cu proprietati semiconductoare (ex SnO2);aceasta deoarece alumina pura este ea insasi capabila sa activeze legaturi hidrogen-hidrogen, hidrogen-carbon sau carbon-carbon, cu eficienta diferita. Astfel, echilibrarea orto-para H2 se realizeaza la temperatura azotului lichid [19], activarea C-H in reactii de izomerizare este efectiva chiar la temperatura camerei [20], iar activarea C-C pentru izomerizarea catenelor se petrece la 330oC [21]. Capacitatea aluminelor de a dispersa fazele metalice este insa dublata de dezavantajul unei interactii puternice intre metal si suport, in special la incarcari mici cu faza metalica.
Ionii de aluminiu in cristalul de g-Al2O3 ocupa pozitii octahedrice sau tetraedrice intre ionii de oxygen impachetati dens. Acesti ioni sint responsabili de starile acceptoare locale in banda interzisa si, presupunind ca sint steric accesibili moleculelor in faza gazoasa, ei pot actiona ca centri acizi Lewis. Ionii de aluminiu de pe suprafata se deosebesc prin aciditatea lor. Taria legaturii Al3+-O2- trebuie sa fie mai mare in tetraedrul [AlO4] decit in octaedrul AlO6, iar sarcina pe oxigen, d corespunzator mai mica. Indepartarea unui ion de oxigen din sfera de coordinatie a aluminiului tetraedric da un centru Lewis mai acid in raport cu cel octaedric[22]. De aceea, la interactia CO cu ioni de aluminiu coordinativ nesaturati care ocupa vacanta tetraedrica (tip I), va avea loc un transfer electronic mai mare de la atomul de carbon la ion, decit in cazul echivalent pozitiei octaedrice (tip II). Aceasta duce la o legatura mai puternica in primul caz si deci la o deplasare a adsorbtiei sale catre frecvente mai mari[22].
Informatii similare se pot obtine si prin adsorbtia de amoniac. Acesta se adsoarbe pe gamma alumina atit molecular, cu formarea unei legaturi coordinative, cit si disociativ, in forma gruparilor amidice. Aparitia NH2- si OH- este legata de existenta pe suprafata a unui sir de centri electrofili si nucleofili de tipul Al3+O2-. In alumina cu Na, se observa doar formarea legaturilor coordinative, grupari amida nu se observa, de aici se deduce ca s-au blocat centri de tip I
La interactia propenei cu Na/alumina, in spectrul IR apar maxime de absorbtie ce se deosebesc putin de cele ale propenei in gaz., si de asemenea se remarca aparitia unor grupari OH (la frecventa de 3750 si 3680 cm-1), care probabil poseda proprietati bazice (tinind seama de tratamentul alcalin).. Toate se indeparteaza prin evacuare la 20oC, iar maximele de abs. coresp OH se reduc mult.
Diferitele alumine de tranzitie sint clasificate dupa raportul intre ionii de aluminiu in pozitii octaedrice si respective tetraedrice si prin densitatea impachetarii ionilor de oxygen. Sarcina de suprafata in oxizii de aluminiu este neutralizata de grupari hidroxil atasate, concentratia lor fiind dependenta de tipul de alumina
Aceste grupari leaga precursorul metallic din care se obtine faza metalica. Este de dorit ca sa se minimizeze dimensiunea particulelor metalice, pentru a obtine numarul maxim de atomi de metal (faza activa) expusi interactiei cu reactantii. Tipul de precursor de suprafata care se formeaza va depinde de tipul de grupari OH disponibile pe suprafata aluminei, si de compusul metallic folosit ca precursor.
Suprafata aluminei prezinta atit grupari OH bazice (grupari OH coordinate la capat cu un ion Al3+) ca si gupari de tip acid Bronsted.. Protonii acidici sint legati de ioni de oxygen in punte. Aciditatea lor depinde de cum se interconecteaza atomii de oxygen cu ionii de aluminiu si cu citi asemenea ioni are loc legarea in punte[23]. Pentru prepararea Pt/Al2O3, ionul de platina poate fi cuprins fie in combinatii ce contin anionul [PtCl4]2- fie in [Pt(NH3)4]+; cum la valoarea de pH la care alumina nu se dizolva si complecsii de Pt sint stabili numarul gruparilor OH bazice e mult mai mare decit numarul gruparilor acide, este de dorit pentru a obtine o buna dispersie a platinei sa se lucreze cu complexul PtCl42-.
Revenind la cazul cind alumina contine si alt component, ca de exemplu oxidul de staniu, s-a constatat ca sisemele bimetalice (cu Pt-Sn) au activitate catalitica superioara, si s-au facut multe speculatii pentru a se explica acest fenomen, abordindu-se mai multe variante, si anume:
1. Explicatii bazate pe argumente structurale
2. Explicatii ce iau in considerare posibilitatea imbunatatirii dispersiei si
stabilizarea fazei metalice datorita prezentei celui de al doilea component.
Nu este insa clara forma sub care staniul este prezsent pe suport (metalica sau ionica), ca si influenta prezentei platinei asupra acestei forme.De asemenea, schimbarile ce pot aparea in matricea de alumina datorita prezentei staniului nu au fost inca sufficient studiate Acest lucru s-a studiat in particular pentru hidrogenarea hidrocarburilor halogenate, o problema de interes environmental., deoarece acesti compusi formeaza legaturi de hydrogen cu grupari hidroxil de suprafata care sint modificate prin prezenta staniului [23].
S-au studiat proprietatile acido-bazice ale sistemului Sn-alumina, pentru o serie de
probe cu un rapoarte molare Sn/Al intre 0 si 1 obtinute prin coprecipitare. Studiul s-a facut prin spectroscopie in IR, folosind adsorbtia de piridina (ca molecula bazica) pe probe degazate la 10-3 Pa, la 400oC. In aceste conditii, spectrele in IR. Contin grupari OH " libere" sau legate prin punti de hydrogen, pe linga specii moleculare de apa (in concentratie mica). Schimbarile in intensitatile benzilor de adsorbtie pot fi luate ca o masura a schimbarii in concentratiile gruparilor OH. Folosindu-se procedeul normalizarii benzilor in raport cu intensitatea gruparilor acide (deoarece prezenta Sn schimba transmitanta probei) s-a aratat ca in timp ce intensitatea gruparilor bazice ramine aproximativ constanta,, numarul gruparilor OH neuter creste semnificativ(0.4-1) prin cresterea continutului de Sn in alumina [23].
Adsorbtia de piridina a pus in evidenta benzi caracteristice adsorbtiei pe centrii
acizi Lewis (benzi la 1613-1625,15751494 si 1451 cm-1.In probelle sarace in dioxid de staniu, exista confirmarea atit pentru existenta centrilor acizi Lewis puternici, cit si pentru centri acizi Lewis slabi; pe masura cresterii continutului de staniu, banda responsabila de adsorbtia pe centri acizi Lewis tari dispare. Deoarece speciile de tip piridinium nu au fost identificate, aceasta arata absenta unor centri Bronsted de tarie suficienta pentru a protonna piridina, dar acest lucru nu exclude existenta unor centri acizi Bronsted slabi [24]. Absenta centrilor Bronsted puternici este confirmata de lipsa de reactivitate pentru dehidrogenare/hidrogenare n reactia de cracare a cumenului, activitatea preponderenta in reactia alcoolului izopropilic fiind cea de deshidratare. Aceasta activitate scade cu cresterea continutului de staniu.Deoparece s-ar parea ca numarul centrilor de adsorbtie difera foarte putin, s-a sugerat [23] ca prezenta staniului modifica taria acceptoare a centrilor acizi Lewis. Calculul mecano-cuantic al aciditatii Lewis pe suprafata g-Al2O3 a aratat ca ionii de aluminiu care ocupa pozitiile tetraedrice actioneaza ca centri acizi Lewis mai puternici decit ionii de aluminiu coordinati octaedric
La adsorbtia comuna a propenei si CO s-a observat stabilirea unui echilibru pe suprafata intre complecsii CO si al propenei, ceea ce indica participarea ionilor de tip II in stabilizarea propenei, in forma unui complexul a carui caldura de adsorbtie este apropiata de a CO si e cam 2 kcal/mol.. Se poate presupune ca acest complexul se stabilizeaza pe doi centri- ionii de Al3+ si gruparile OH bazice .
La adsorbtia propenei pe g-Al2O3 apar maxime de adsorbtie caracteristice unor forme de adsorbtie mai puternica a propenei. Din date de termodesorbtie se deduce ca pina la 300oC are loc desorbtia a doua forme puternic legate de propena, predominant in forma propenei cu maxime in jur de 140 si 250oC. Adaugarea de propena in celula cu CO duce la micsorarea maximului corespunzator complexului CO cu suprafata, pe seama complexului propenei.. Deci propena mai puternic legata conditioneaza eliminarea CO de pe ionii de aluminiu tip I
La adsorbtia propenei pe suprafata se constata aparitia unor Maxine de adsorbtie specifice gruparilor OH, din care cele de la 3730 si 3685 cm-1 corespund gruparilor OH cu proprietati bazice, iar cel de la 3770- gruparilor slab acide. Din variatiia intensitatii virfurilor specifice in spectrele in IR se deduce marirea concentratiei de grupari OH bazice pe seama adsorbtiei disociative a unei parti din molecula de olefina . Pe baza asemanarii intre bazicitatea amoniacului (pKa=34) si a propenei (pKa= 35), pare natural ca pentru aceasta din urma se realizeaza complecsi de suprafata asemanatori. S-a presupus [22] ca complecsii propenei (caracterizati de un anumit tip de maxime- 1600 cm-1 si 1575 cm-1) sint stabilizati pe perechile de centri ionici Al3+(tetra) -O cu tarii diferite Adsorbtia disociativa e sustinuta si de absenta in spectrul EPR a semnalului propenei ads la t joasa si la 20oC Adsorbtia propenei la 20oC conduce la aparitia in spectrele de reflexie difuza a unui vf slab, la 260.(???)., care creste cu cresterea temperaturii pina la 100oC. Ca urmare a capacitatii centrilor dubli acido-bazici ai suprafetei aluminei sa adsoarba disociativ apa, care poseda protoni mai mobili (pKa=16) decit propena, se observa blocarea cu aceasta a centrilor de stabilizare a complecsilor puternic legati ai propenei. Concentratia acestor specii se micsoreaza cu scaderea temperaturii de deshidratare a aluminei. Pe proba evacuata la 200oC ca si pe Na/alumina acesti complecsi nu se formeaza..Se stie ca - prin tratare alcalina se schimba activitatea catalitica a aluminei ptr reactia de izomerizare[25]. De aici se deduce ca complecsii puternic legati participa la izomerizare si transformarea ulterioara....
2. Rezultate experimentale
2.1. Catalizatorul Pt/Al2O3
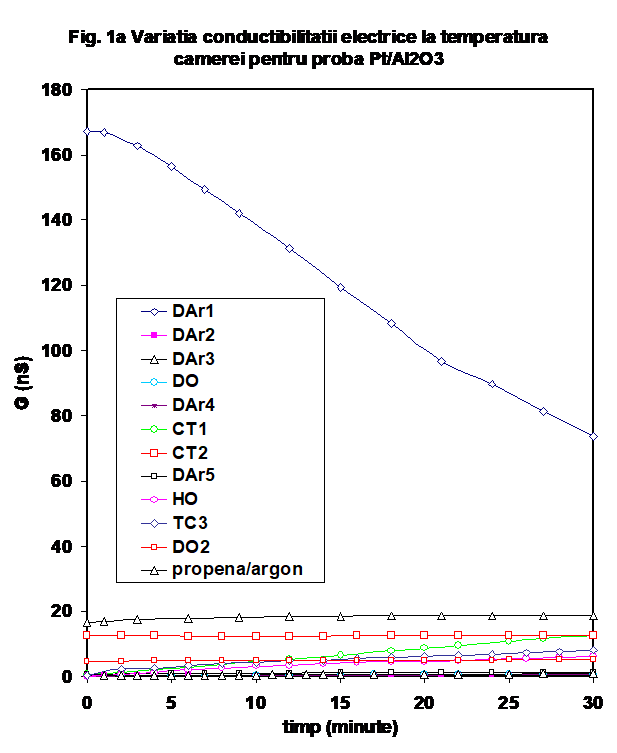
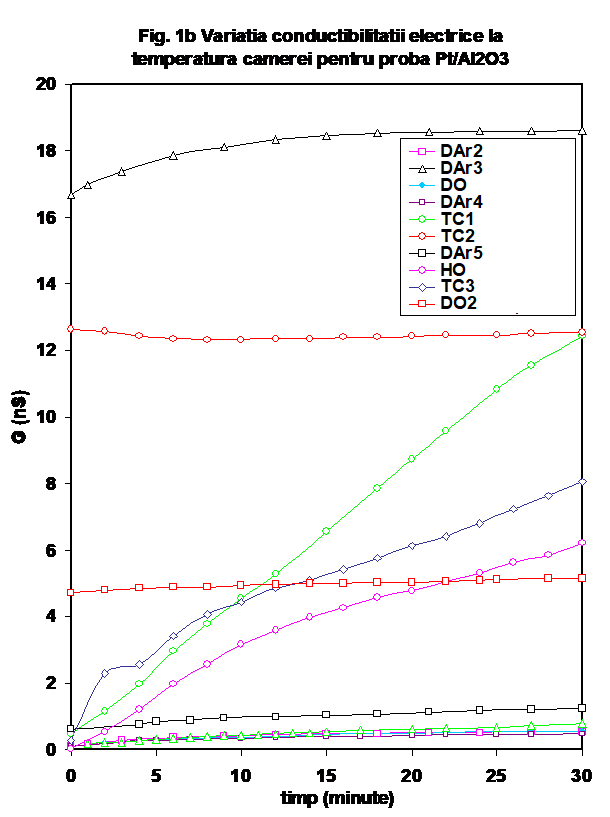
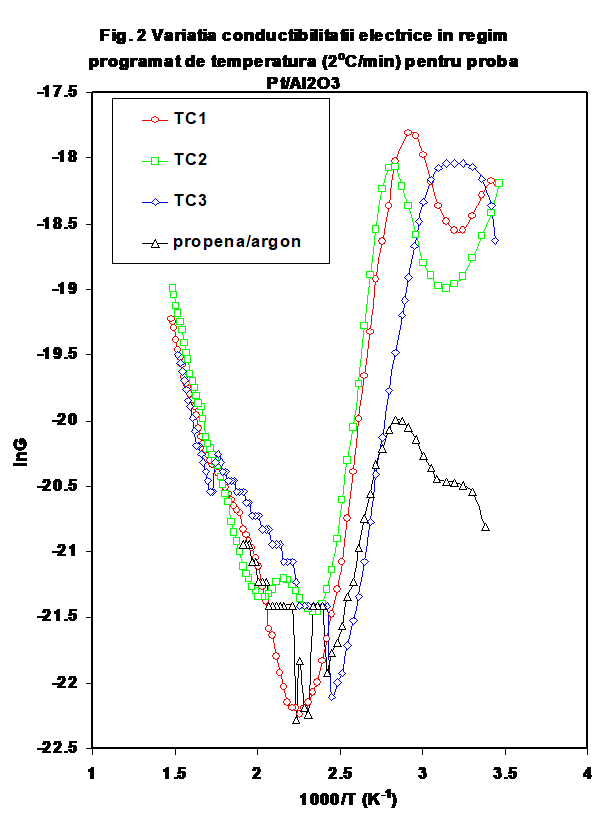
Catalizatorul obtinut prin depunerea unui procent de 0.4 % Pt pe suportul de g-Al2O3 (Oxid C, Degussa) a fost testat urmind un protocol similar celui expus mai sus . Comportarea sa este mult diferita de cea a suportului de alumina [ 26], si una din diferentele majore este aceea ca dupa primul ciclu de incalzire-racire in inert uscat, conductibilitatea probei in domeniul de temperatura joasa apare mult diminuata (Figura 1a si b si Figura 2). La incalzire se constata ca valorile conductibilitatii sint diferentiate intre ele in principal la temperaturi joase, curbele avind forma specifica de U, cu in minim localizat in jur de 170oC. Marimea valorilor de temperatura joasa depinde de natura atmosferei (oxidanta sau reducatoare), o scadere puternica fiind evidenta in cazul unui tratament cu oxygen uscat (Figura 2).
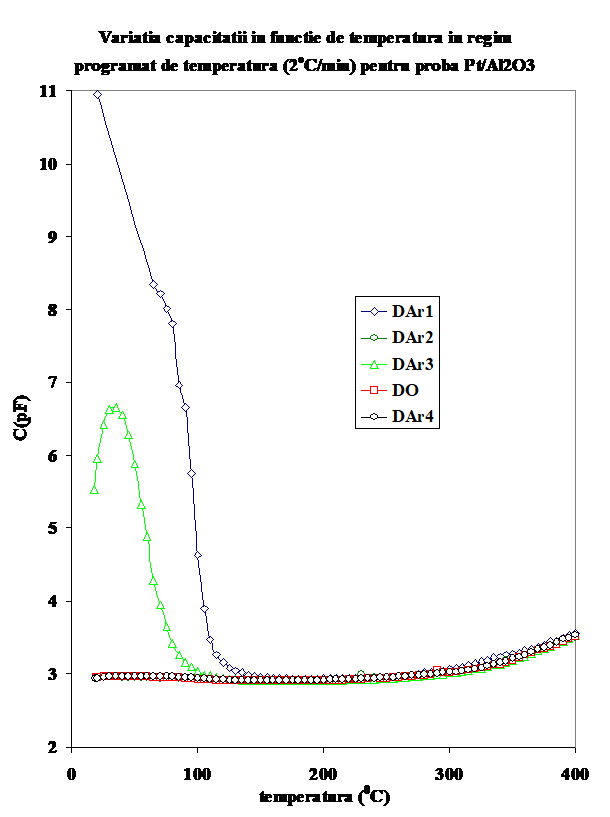
De remarcat ca in timpul testului catalitic, conductia creste brusc chiar de la temperatura camerei si efectul se mentine si la reluarea testarii (vezi curbele CT-1 si respectiv CT-2 in Figurile 1a si b); acest efect este legat de prezenta simultana a propenei si oxigenului, intrucit in cazul cind aceste gaze sint adsorbite separate, valorile conductiei sint considerabil mai mici la temperatura camerei si prin incalzire in domeniul de temperatura joasa (Figurile 1). Ca o observatie particulara, in cazul acestor masuratori curbele conductiei functie de temperatura indica doua maxime in zona de temperatura joasa (figura 2), maxime ce se regasesc in cazul tratamentului in oxigen umed, dar nu si in cazul amestecului propena-argon, ceea ce sugereaza ca unul intre ele este reprezentat de o specie adsorbita ce implica oxygen. Prin comparatie, conductia masurata prin incalzirea la temperatura joasa este mai mica in cazul CT-3, care este efectuat dupa preadsorbtia de apa cu oxygen, si usor mai mare in testul catalytic 2 (ce reprezinta repetarea TC-1 in experimental urmator (fara spalarea in argon a suprafetei probei). (Figura 3). Prin comparatie, valorile capacitatii la incalzirea probei in diferite atmosfere este practice insensibila la atmosfera peste 150oC (Figura 4.)
2.2. Probele Pt-SnO2/Al2O3
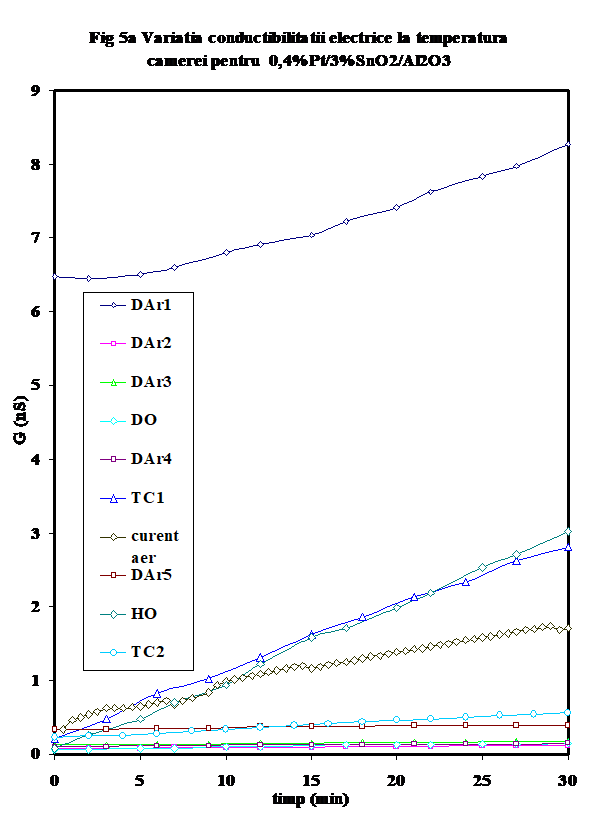
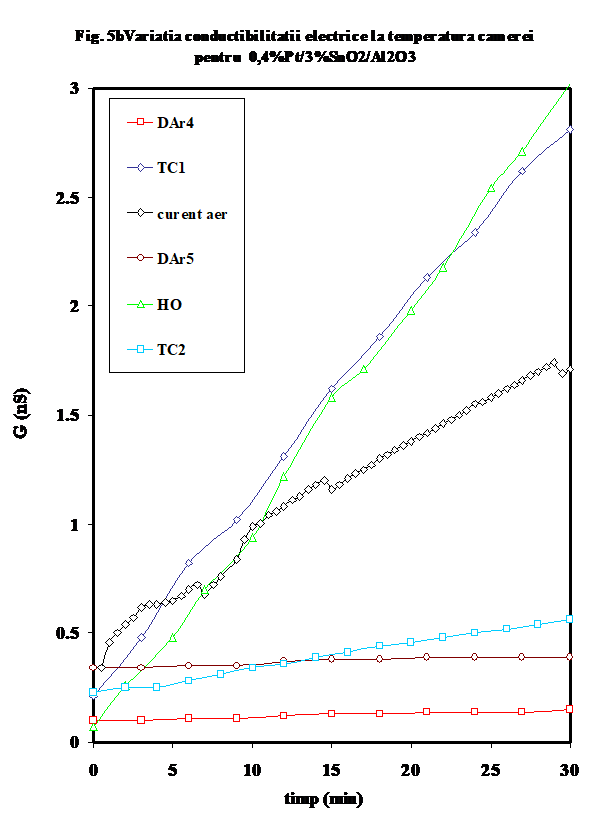
2.2.1. Proba ce contine 0.4%Pt/3%SnO2/g-Al2O3 prezinta o crestere a conductiei prin fluxarea in inert la temperatura camerei, o comportare opusa perechii sale fara platina (adica proba A1 prezentata anterior . Aceasta tendinta se mentine in toate masuratorile la temperatura camerei, cu deosebirea ca dupa efectuarea primului ciclu de incalzire-racire,
valorile initiale sint mult mai coborite, fiind practic identice in ciclurile DAr-2,3-4 ca si in DO (Figura 5 G-RT ptr Pt/Sn3/Al).
Remarcabil este faptul ca acest efect este legat de prezenta platinei si a SnO2 in stare oxidata, dupa cum se poate observa din faptul ca in prezenta amestecului de reactie (care contine hidrocarbura cu un caracter reducator), conductia este mult mai mare
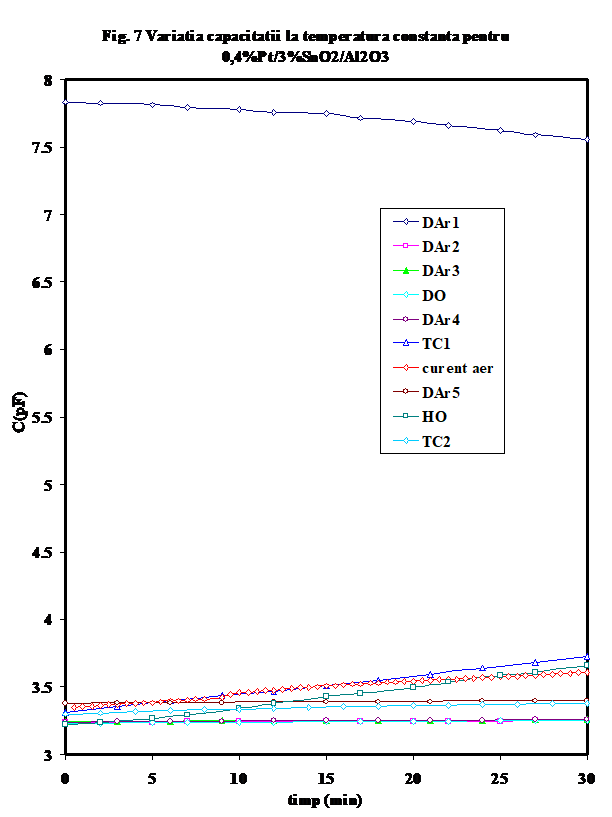
Prin comparatie, acest efect este mult mai mic in cazul valorilor capacitatii, desi ele prezinta aceeasi tendinta.
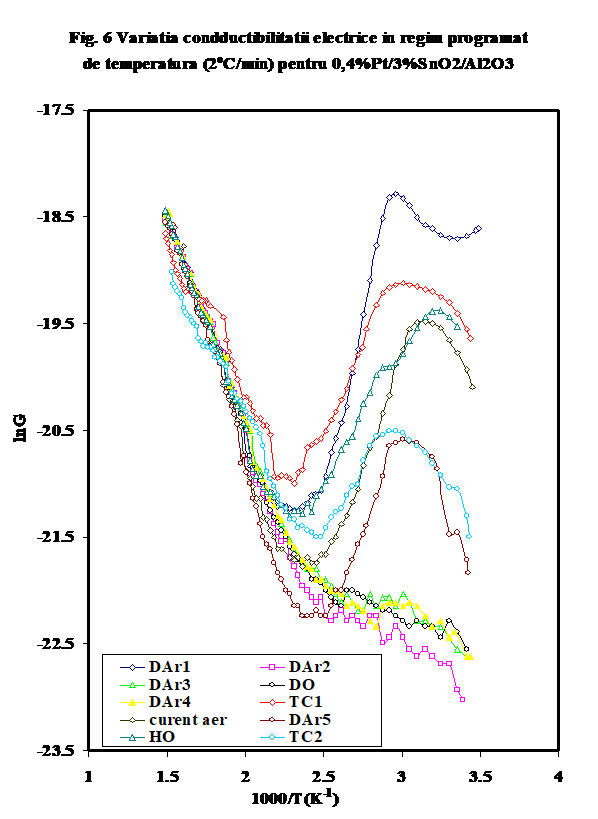
Curbele de variatie a conductibilitatii electrice ca urmare a incalzirii in diferite atmosfere se pot imparti in doua categorii distincte:
(i)- variatia conductiei in mediu uscat, sau ca urmare a deshidratarii (curbele DAr-2,3,DO, DAr-4) au o forma de L, prezentind practic doua valori pentru energia de activare a conductiei, ceea ce indica activarea a doua tipuri diferite de purtatori in functie de domeniul de temperatura (Figura 6,lnG_1/T)
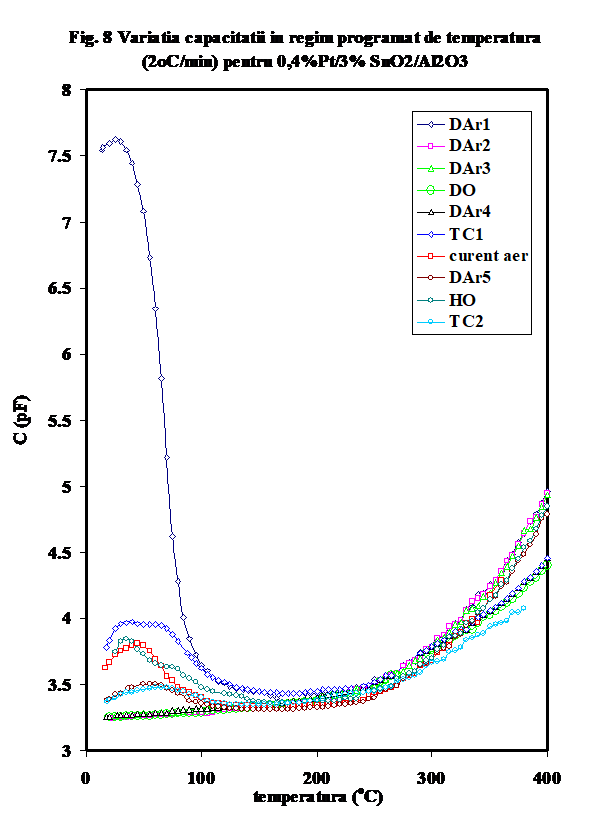
(ii) -in prezenta unor donori de protoni (hidrocarbura, sau oxygen umed), curbele prezinta forma caracteristica (in U) mentionata de noi in cazul aluminei sau a probelor de SnO2/g-Al2O3 (Figura 6), cu un minim a carui pozitie pe scara de temperaturi este cu atit mai jos cu cit deshidratarea/ pierderea speciilor adsorbite molecular este mai avansata si a carui valoare Gmin a fost propusa de noi ca indicativa pentru gradul relativ de deshidratare [25- noi Appl. Surf.Sci.] Aparent, testul catalitic in amestec propena aer (tc-1) efectuat pe proba oxidata si uscata produce o reducere avansata a suprafetei, insotita de cresterea conductiei protonice (vezi Figura 6, tc-1). Oxidarea ulterioara in current de aer determina eliminarea unora din speciile superficiale, fara insa a restaura comportarea initiala, asa cum rezulta si din masuratoarea ulterioara in curent de argon (DAr-5). Tratamentul in oxigen umed are un efect aproape similar testului catalitic, dar la valori mai mici ale conductiei, indicind in acest caz o mai puternica influenta a oxigenului . Tratamentul ulterior cu amestec ce contine propena indica o reactivitate mult mai mica in raport cu prezenta hidrocarburii. (atentie, sa verific daca amestecul 2 este 1;10..). In Figura 7 este prezentata variatia capacitatii electrice la temperatura camerei, iar in Figura 8 sint prezentate curbele de variatie a capacitatii cu temperatura in aceleasi conditii. Se vede usor ca efectele cele mai importante se observa pina 100oC si peste 300oC .
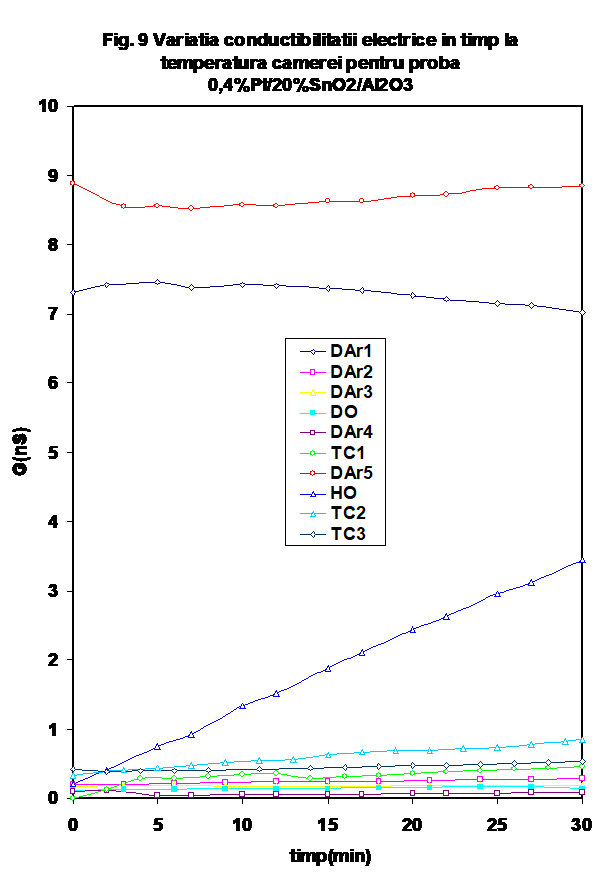
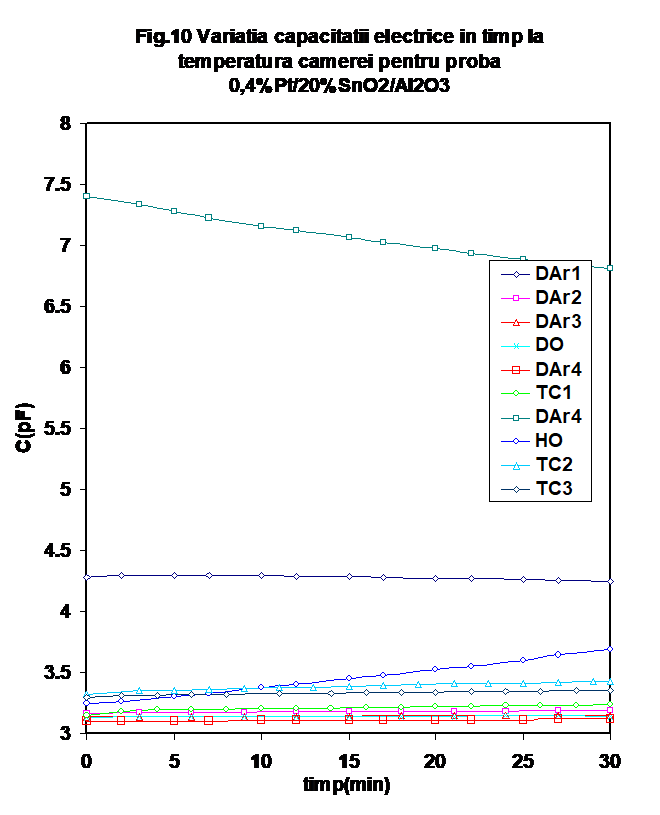
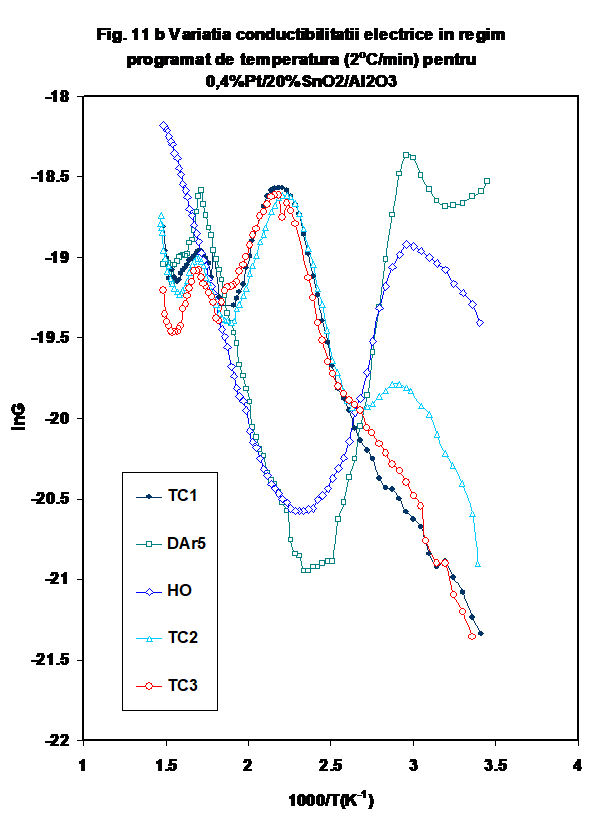
2.2.1. Proba 0.4%Pt/20%SnO2/g-Al2O3 prezinta in general o comportare similara a conductantei prin fluxarea in diferite atmosfere la temperatura camerei (Figura 9). DE remarcat insa faptul ca valoarea conductiei masurate dupa testul catalytic este remarcabil de ridicata (Figura 9, DAr-5). Variati capacitatii in timp, la temperatura camerei este prezentata in Figura 10. si reproduce aceeasi tendinta.
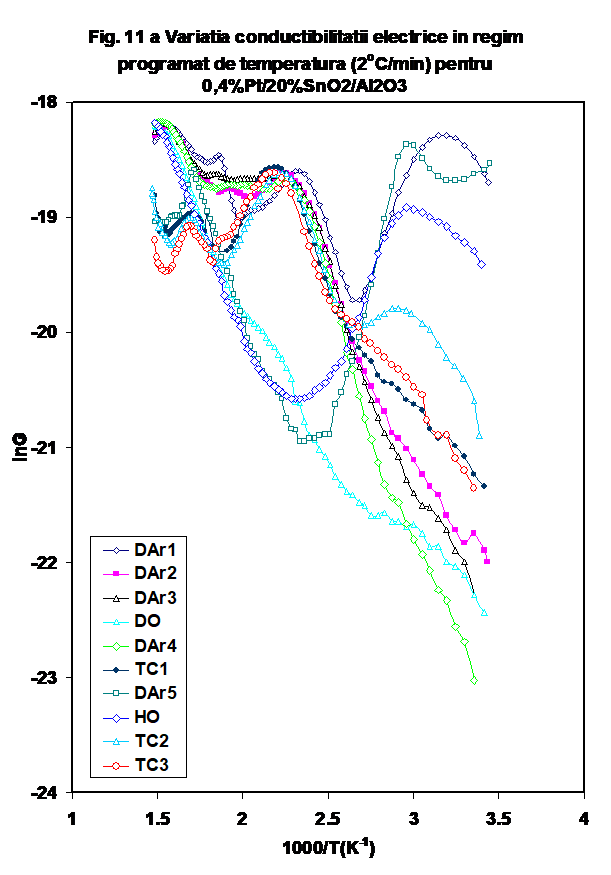
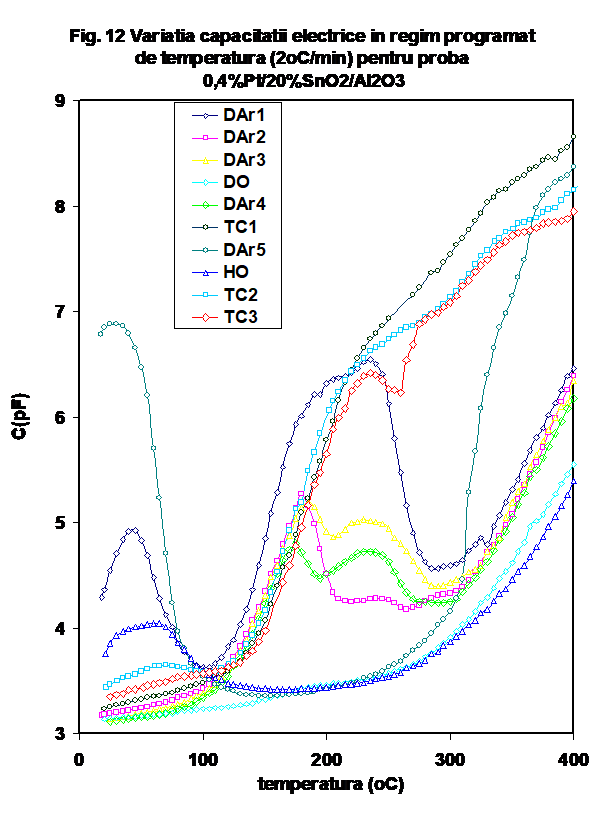
Reprezentarea Arrhenius a variatiei conductanrtei cu temperatura prezinta un pattern mai deosebit. Astfel, forma in U pusa in evidenta la prima incalzire in inert uscat nu se mai regaseste in ciclurile ulterioare, valoarea conductiei la temperatura joasa find mult mai coborita, si reproductibila la incalzirea in DAr-2,3, DO si DAr-4 (Figura 11a) . Insa, in timp ce in ciclul DO valoarea conductiei se mentine coborita si dupa 150oC, in cazul celorlalte cicluri in argon conductia creste abrupt, atingind un maxim la 170oC, dupa care scade usor, raminind insa la valori ridicate. O tendinta similara este pusa in evidenta pentru masuratirile effectuate in amestecul propena-aer (tc-1, tc-2 si tc-3)- Figura 11b, dar valorile obtinute dupa 170oC indica o modificare mai complexa, catre valori nete mai coborite.. Prin comparatie, testul in oxygen umed urmaza tendinta observata in DAr-1. (Figurile 11a si b) . Variatia capacitatii C urmeaza aceeasi tendinta (Figura 12).
2.3.Comparatie intre probele SnO2/Al2O3 si Pt/ SnO2/Al2O3
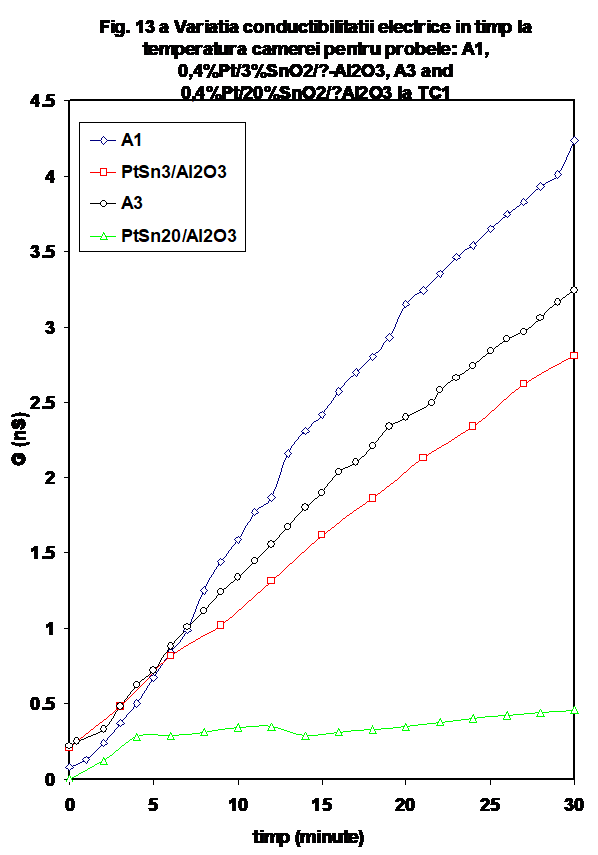
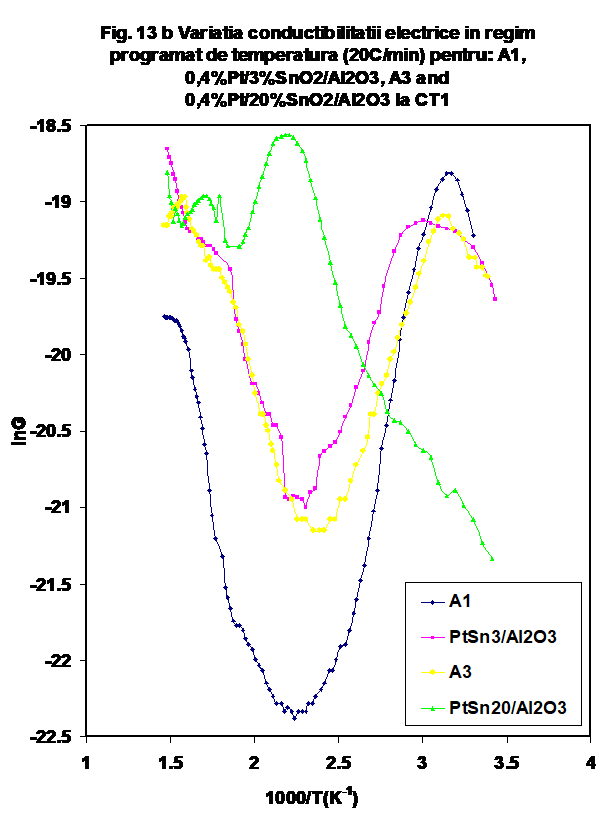
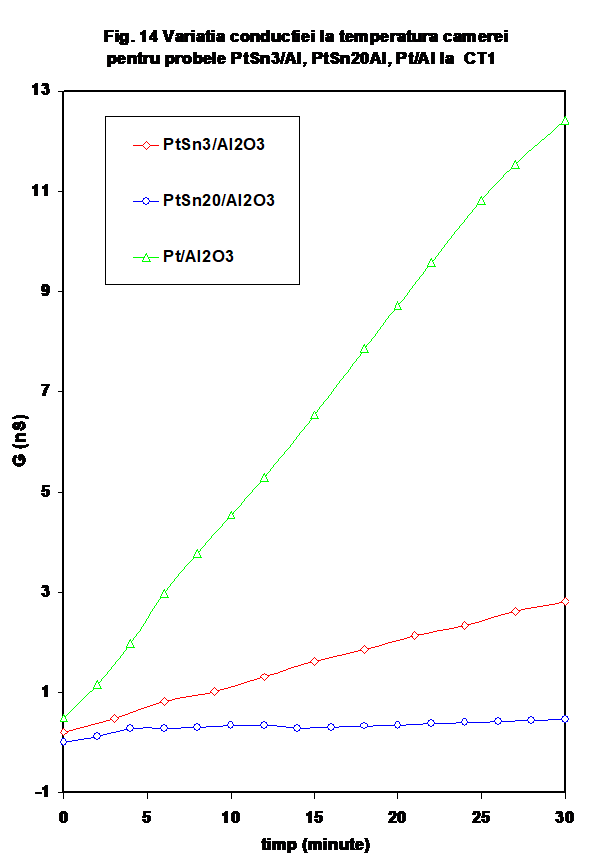
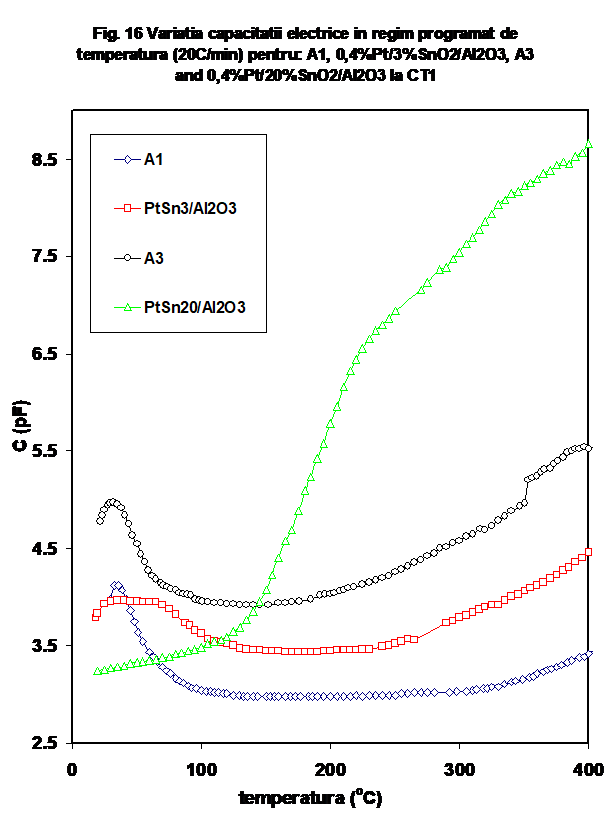
In figura 13 a se prezinta o comparatie intre probele A1 (3% SnO2/Al2O3) A3 (20% SnO2/Al2O3), si echivalentul lor cu platina, la temperatura camerei, iar in Figura 13 b este prezentata aceeasi comparatie pentru variatia conductiei la incalzire. Se poate vedea ca daca la temperatura camerei proba A1 are variatia cea mai mare in timp in amestecul de reactie, iar proba Pt/ 20%SnO2/Al2O3 variatia cea mai lenta, la incalzire ordinea se inverseaza- proba A1 are o scadere dramatica de conductie (care urmeaza comportarea prezentata anterior pentru alumina [26]. Valrile masurate pentru A3 si Pt/ 3%SnO2/Al2O3 sint practice identice, iar proba Pt/ 20%SnO2 /Al2O3 se distinge, asa cum am aratat printr-o variatie mai comple. Valoarea maximului conductiei este localizata exact la temperatura de minim masurata in cazul celorlalte probe.
Cum aceasta din urma reprezinta temperatura la care se finalizeaza desorbtia apei adsorbita molecular, se poate afirma ca in cazul probei Pt/ 20%SnO2/Al2O3 cresterea continua a valorilor G pina la valoarea de maxim de la 170oC poate reprezenta reducerea unui a din componentele sistemului (reducere insotita de cresterea de conductie), urmata de oxidarea unora din speciile reduse, (in mai multe secvente reprezentate de maximele urmatoare) sub actiunea oxigenului din mediul de reactie
Variatia capacitatii la incalzire (Figura 14) indica o comportare mai putin " accidentata", care sugereaza grade diferite de hidratare in cazul primelor 3 probe, ca si o crestere progresiva a constantei dielectrice a sistemului (in cazul ultimei).
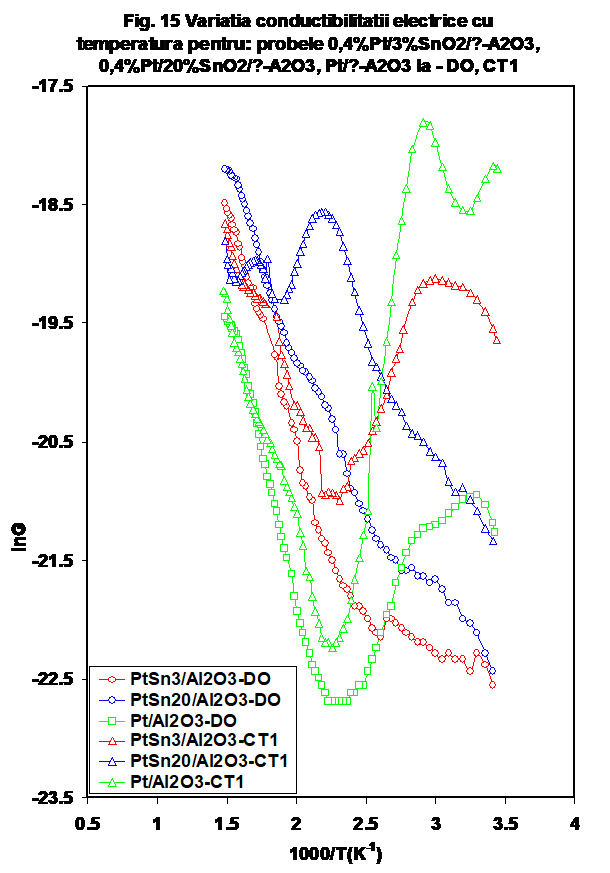
 2.4. Comparatie intre probele Pt/Al2O3, Pt/ 3%SnO2/Al2O3
si Pt/ 20%SnO2/Al2O3
2.4. Comparatie intre probele Pt/Al2O3, Pt/ 3%SnO2/Al2O3
si Pt/ 20%SnO2/Al2O3
. Compararea probelor cu platina (cu sau fara SnO2 din punctual de vedere al variatiei in oxygen, sau in amestec propena-aer indica o comportare relativ similara in DO pentru probele cu dioxid de staniu si diferita in cazul Pt/Al2O3 In amestec de reactie, probele Pt/ Al2O3 si Pt/ 3%SnO2/Al2O3 se comporta oarecum similar (la valori mai ridicate pentru cea din urma) in timp ce Pt/ 20%SnO2/Al2O3 se deosebeste in mod evident (Figura 15).
1. P.B.Weisz, Adv.Catal. 13(1962) 137
2. J.H.Sinfelt, Adv.Chem.Eng., 5 (1964) 37
3. F.G.Ciapetta si D.N.Wallace, Catal.Rev., 5 (1971) 67
4. B.C.Gates, J.R.Katzer si G.C.A.Schuit, " Chemistry of Catalytic Processes", McGraw Hill, N.Y. 1979, cap.3
5. M.Boudart, Adv Catal., 20(1969)153
6. J.E.Benson si M.Boudart, J.Catal., 4 (1965) 704
7. W.F.Taylor, J.H.Sinfelt si D.J.C. Yates, J.Phys.Chem 69 (1965) 3847
8. M.Boudart, A.Aldag, J.E.Benson,N.A.Dougharty, si C.Harkins-Given, J.Catal., 6 (1966)92
9. W.F.Taylor, D.J.C.Yates si J.H.Sinfelt, J.Amer.Chem.Soc., 86 (2996) 1964
10. P.Schoubye, J.Catal.,14 (1969)238
11. S.J.Tauster, C.S.Fung, si R.I.Garten, J.Amer.Chem.Soc., 100(1978)170
12. S.J.Tauster, si S.C.Fung, J.Catal., 55 (1978) 29
13. R.T.K.Baker, E.B.Prestige and R.L.Garten, J.Catal., 59 (1979)293, 390.
14. P.H.Lewis, J.Phys.Chem., 67 (1963)251
15. M.F.Johnson si C.D.Keith, J.Phys.Chem. 67 (1963)200
16. H.C.Yao, M.Sieg., si H.K.Plummer, Jr., J.catal., 59 (1979) 365
17. A.N.Mansour, J.W.Cook Jr., D.E.Sayers, R.J.Emrich, si J.R.Katzer, J.Catal., 89, (1984) 462
18. S.M.Krug, Master Thesis, University of Delaware, Newark, Delaware, 1975.
19. F.H.van Cauwelaert, si W.K.Hall, Trans. Faraday Soc. 66 (1970) 457
20. J.W. Hightower si J.K.Hall, Trans.Faraday Soc.., 60 (1970) 477
21. D.S.Maciver, W.H.Wilmot si J.M.Bridges, J.Catal. 3 (1964) 502.
22. T.A.Gordimova, A.A.Davidov, DAN 245 1979) 635 .
23. P.Kirszensztejn, W.Przystajko si T.N.Bell, Catal.Lett., 18 (1993) 399
24. A.Corma, V.Fornes E.Ortega, J.Catal., 92 (1985) 284
25. H.R.Gerberich and W.K.Hall, J.Catal., 5(1966) 99
26. M.Caldararu. ... Referat de lucrari la contractul 5206/1999
27. Mcaldararu, G.Postole, C.Hornoiu, V.Bratan, M.Dragan si N.I.Ionescu, Appl. Surf.Sci ..