
|
|
|
STRUCTURA TRANSPORTORULUI GLUTAMAT OMOLOG LA Pyrococcus horikoshii
Transportorii glutamați sunt proteine integrate de membrana, ce intervin in preluarea și transportul concentrației de glutamat, din sinapse inspre spațiul intracelular, prin inlocuirea gradienților ionici preexistenți.
In centrul sistemului nervos, transportorii glutamați sunt esențiali pentru dezvoltarea și funcționarea in condiții optime, fiind implicați in atacul cerebral, epilepsie și in alte boli neurodegenerative.
Trimerul transportorului are forma unui bol, cu un camp bazal incarcat cu solvenți, extins de-a lungul bistratului membranar.
Pe suprafața bazala sunt localizate 3 situsuri de legare independente, fiecare dintre acestea susținut de 2 agrafe helicale, HP1 și HP2, intrate prin parțile laterale ale membranei.
Transportul glutamatului este facilitat de mișcarea acestor 2 agrafe, ce permit accesul alternativ prin bistratul membranei.
Sinapsa chimica este punctul central al comunicarii dintre neuronii creierului uman, aceste sinapse au rolul de a media transportul majoritații neurotransmiterilor excitatorii rapide, reprezentand totodata și centrul de inițiere al proceselor de invațare și memorare.
Disfuncții la nivelul acestor sinapse cauzeaza o serie de boli și leziuni ale sistemului nervos, incluzand depresia, schizofrenia și atacul cerebral.
Rapida eliminare a glutamatului din sinapsa este datorata inaltei afinitați, transportorii dependenți de sodiu fiind necesari in neurotransmitere și in prevenirea excitotoxicitații induse de surplusul glutamat.
Cristalul transportorului glutamat de la Pyrococcus horikoshii are o identitate de 37% identica cu transportorul de aminoacizi excitator 2 (hEAAT2).
Mecanismul tipic de transport al glutamatului este cel de acces alternativ, un situs de legare intramembranar este flancat de 2 porții permițand accesul soluțiilor intra și extracelulare la nivelul substratului.
Proteina aflata la nivelul situsului de legare, ce asigura calea de transport este reprezentata de promotorul GltphH7. Probabil cea mai interesanta trasatura a acestei proteine este reaprezentata de bazinul acvatic ce permite legarea ionilor la substrat, aflat la jumatatea stratului membranar.
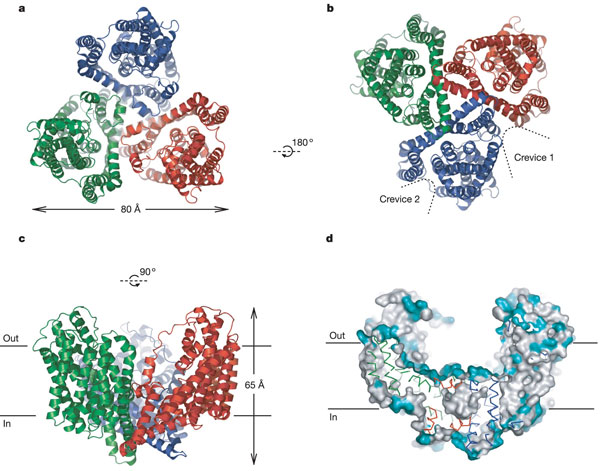
Fig.26. Structura proteinei GltphH7.a. reprezentarea trimerului, vedere extracelulara, b. vedere citoplasmatica a deschiderilor dintre unitați, precum și cea dintre TM1 și TM6, c.vedere asupra trimerului paralel cu planul membranar, d.suprafața secționata a trimerului la nivelul centrului bazinului.
Situsul de legare este situat la aprox. 5Ǻ sub bazin și este prins de varful agrafei HP2 (hairpin).
Imediat sub buzunarul de legare se afla HP1, TM7 și partea C-terminala a TM8, și se presupune ca HP1 formeaza poarta intracelulara deoarece mișcarea coordonata a HP1 cu a TM7 și a parții C-terminale a TM8, ar deschide calea acvatica dinspre situsul de legare spre citoplasma.
Structura GltphH7 reprezinta o stare de legare a transportorului cu ambele porți deschise. Deși porțile HP1 și HP2 au o similaritate structurala, acestea se pare ca aparțin unor contexte proteice diferite, drept urmare schimbarile conformaționale se interpun la deschiderea porților, precum și indicatorii chimici implicați in deschiderea porților, se presupune ca dețin origine distincta.
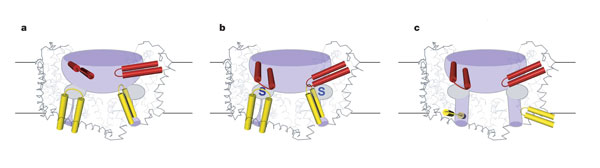
Fig.26. Arhitectura trimerului și mecanismul de transport. Transportorii glutamat au un bazin acvatic larg unde se gasesc cele 3 situsuri de legare. A. HP2 are o conformație deschisa, B. starea de legare a transportorului observat in structura proteinei GltphH7/
Pentru deschiderea porții intracelulare, HP1, se mișca vertical fața de citoplasma și lateral fața de deschidere, de aceea se creaza o cale de transport prin substrat de-a lungul feței polare a TM8 și redirecționeaza regiunea de atașare serica a HP1 accesibila doar citoplasmei.
Cand poarta intracelulara este deschisa, HP2 se mișca spre centrul trimerului, ocupand spațiul predestinat HP1, evitand astfel formarea unui por transmembranar.