
|
|
|
AUTORITATEA NATIONALA SANITARA VETERINARA SI PENTRU SIGURANTA ALIMENTELOR
ORDIN
pentru aprobarea Normei sanitare veterinare ce stabileste metode de analiza
pentru controlul oficial al furajelor privind nivelurile amidonului, proteinei
brute, proteinei brute care poate fi dizolvata de pepsina si acid clorhidric, gosipolului liber si total si cu referire la activitatea pepsinei, precum
si determinarea nivelurilor de tilozina si virginiamicina din furaje
Vazand Referatul de aprobare nr. 70058 din 22.01.2007, intocmit de Directia de control si coordonare a activitatii farmaceutice veterinare din cadrul Autoritatii Nationale Sanitare Veterinare si pentru Siguranta Alimentelor;
Avand in vedere prevederile art. 10 lit. b) din Ordonanta Guvernului nr. 42/2004 privind organizarea activitatii sanitar-veterinare si pentru siguranta alimentelor, aprobata cu modificari si completari prin Legea nr. 215/2004, cu modificarile si completarile ulterioare;
In temeiul art. 3 alin. (3) si art. 4 alin. (3) din Hotararea Guvernului nr. 130/2006 privind organizarea si functionarea Autoritatii Nationale Sanitare Veterinare si pentru Siguranta Alimentelor si a unitatilor din subordinea acesteia,
presedintele Autoritatii Nationale Sanitare Veterinare si pentru Siguranta Alimentelor emite urmatorul ordin:
Art. 1 - Se aproba Norma sanitara veterinara ce stabileste metode de analiza pentru controlul oficial al furajelor privind nivelurile amidonului, proteinei brute, proteinei brute care poate fi dizolvata de pepsina si acid clorhidric, gosipolului liber si total si cu referire la activitatea pepsinei, precum si determinarea nivelurilor de tilozina si virginiamicina din furaje, prevazuta in anexa care face parte integranta din prezentul ordin.
Art. 2 - Autoritatea Nationala Sanitara Veterinara si pentru Siguranta Alimentelor, institutele veterinare centrale si directiile sanitare veterinare si pentru siguranta alimentelor judetene si a municipiului Bucuresti vor duce la indeplinire prevederile prezentului ordin.
Art. 3 - La data intrarii in vigoare a prezentului ordin se abroga Ordinul presedintelui Autoritatii Veterinare si pentru Siguranta Alimentelor nr. 968/2003 pentru aprobarea Normei sanitare veterinare ce stabileste metode de analiza pentru controlul oficial al furajelor privind amidonul, proteina bruta, proteina bruta descompusa de pepsina si acid clorhidric, estimarea activitatii pepsinei, a gossipolului liber si cu referire la identificarea antibioticelor din grupul tetraciclinelor, al clortetraciclinelor, oxitetraciclinelor si tetraciclinelor, a oleandomicinei si a virginiamicinei, publicat in Monitorul Oficial al Romaniei, Partea I, nr. 59 si 59 bis din 23 ianuarie 2004.
Art. 4 - Prezentul ordin transpune prevederile Directivei Comisiei 72/199/CEE ce stabileste metode comunitare de analiza pentru controlul oficial al furajelor publicata in Jurnalul Oficial al Comunitatilor Europene (JOCE) nr. L 123, 29.5.1972, p. 6, asa cum a fost modificata ultima data de Directiva Comisiei nr. 1999/79/CEE, publicata in Jurnalul Oficial al Comunitatilor Europene (JOCE) nr. L 209, 07.8.1999, p. 23
Art. 5 - Prezentul ordin va fi publicat in Monitorul Oficial al Romaniei, Partea I.
Nr. ____________
ANEXA
Norma sanitara veterinara ce stabileste metode de analiza pentru controlul
oficial al furajelor privind nivelurile amidonului, proteinei brute, proteinei
brute care poate fi dizolvata de pepsina si acid clorhidric, gosipolului liber si
total si cu referire la activitatea pepsinei, precum si determinarea nivelurilor
de tilozina si virginiamicina din furaje
Art. 1 - Analizele pentru controale oficiale ale furajelor, in ceea ce priveste nivelurile acestora de amidon, proteina bruta, proteina bruta ce poate fi descompusa de pepsina si acid clorhidric, de gosipol liber sau total si in ceea ce priveste activitatea pepsinei, se efectueaza utilizand metodele descrise de anexa nr. 1.
Art. 2 - Analizele pentru controale oficiale ale furajelor, in ceea ce priveste determinarea nivelurilor de tilozina si virginiamicina din furaje, se efectueaza utilizand metodele descrise de anexa nr. 2.
Art. 3 - Autoritatea Nationala Sanitara Veterinara si pentru Siguranta Alimentelor informeaza Comisia Europeana cu privire la actele normative si prevederile administrative necesare pentru implementarea prezentei norme sanitare veterinare.
Art. 4 - Anexele nr. 1 si 2 fac parte integranta din prezenta norma sanitara veterinara.
ANEXA nr.1
la norma sanitara veterinara
I. DETERMINAREA AMIDONULUI
METODA POLARIMETRICA
1. SCOP SI DOMENIU DE APLICARE
Aceasta metoda se utilizeaza pentru determinarea nivelurilor de amidon si a produselor de degradare a amidonului cu greutate moleculara mare din furaje, in scopul verificarii conformitatii cu Norma veterinara ce stabileste metoda de calcul pentru valoarea energetica a furajelor combinate pentru pasari, aprobata prin Ordinul presedintelui Agentiei Veterinare si pentru Siguranta Alimentelor nr. 17/2004, publicat in Monitorul Oficial al Romaniei, Partea I, nr. 1020 din 4 noiembrie 2004, ce transpune in legislatia nationala Directiva Comisiei 86/174/CEE si cu Norma sanitara veterinara privind circulatia si utilizarea materiilor prime furajere, aprobata prin Ordinul ministrului agriculturii, padurilor, apelor si mediului nr. 507/2003, publicat in Monitorul Oficial al Romaniei, Partea I, nr. 683 din 29 septembrie 2003, ce transpune in legislatia nationala Directiva Consiliului 96/25/CE.
2. PRINCIPIU
Metoda cuprinde doua etape. In prima etapa, proba se trateaza, atunci cand este fierbinte cu acid clorhidric diluat. Dupa clarificare si filtrare, rotatia optica a solutiei trebuie masurata prin polarimetrie.
In a doua etapa, proba trebuie extrasa cu etanol 40%. Dupa acidifierea filtratului cu acid clorhidric, clarificand si filtrand solutia, rotatia optica se masoara ca in prima etapa.
Continutul in amidon al probei se calculeaza facand diferenta dintre cele doua masuratori, multiplicata cu un factor cunoscut.
3. REACTIVI
3.1. Acid clorhidric (w/w) 25%, d: 1,126 g/ml.
3.2. Acid clorhidric (w/v) 1,128%
Concentratia trebuie sa fie controlata prin titrare, utilizand o solutie de hidroxid de sodiu 0,1 mol/litru in prezenta de rosu de metil (w/v) 0,1% in etanol 94% (V/V). 10ml = 30,94 ml de NaOH 0,1 mol/litru.
3.3. Solutie Carrez I: Se dizolva, in apa, 21,9 g acetat de zinc Zn(CH3COO)2. 2H2O si 3g de acid acetic glacial. Se aduce la volum pana la 100 de ml cu apa.
3.4. Solutie Carrez II: Se dizolva in apa 10,6 g de ferocianura de potasiu [K4(Fe(CN)6]. 3H2O. Se aduce la volum pana la 100 de ml cu apa.
3.5. etanol 40% (v/v), d:0,948 g/ml la 200C.
4. APARATURA
4.1. Retorta Erlenmeyer de 250ml cu ajustare de sticla mata standard si cu condensator de reflux.
4.2. Polarimetru sau sacharimetru
5. PROCEDURA
5.1. Prepararea probei
Se marunteste proba pana cand este destul de fina pentru a trece printr-o sita cu ochiuri de 0,5 mm.
5.2. Determinarea rotatiei optice totale (P sau S) (Vezi observatia 7.1)
Se cantaresc 2,5 g din proba maruntita, cu o aproximatie de mg si se plaseaza intr-o retorta gradata de 100 ml. Se adauga 25 ml de acid clorhidric (pct. 3.2), se agita pentru a se obtine chiar distributia probei test si se adauga inca 25 ml de acid clorhidric (pct. 3.2). Se imerseaza retorta in apa fiarta, agitandu-se energic si constant timp de trei minute, pentru a se preveni formarea de flocoane. Cantitatea de apa din baia de apa trebuie sa fie suficienta pentru ca baia sa ramana la punctul de fierbere, atunci cand retorta este introdusa in aceasta.
Retorta nu trebuie sa fie scoasa din baie cat timp se agita. Dupa exact 15 minute, se scoate retorta din baie, se adauga 30 ml de apa rece si se raceste imediat la 200C.
Se adauga 5 ml de solutie Carrez I (pct. 3.3) si se agita timp de 1 minut. Apoi se adauga 5 ml de solutie Carrez II (pct. 3.4) si se agita din nou, timp de 1 minut. Se aduce la volum cu apa, se omogenizeaza si se filtreaza. Daca filtratul nu este perfect clar (fapt ce este rar), se repeta determinarea utilizand o cantitate mai mare de solutii Carrez I si II, de exemplu 10ml.
Se masoara rotatia optica a solutiei intr-un tub de 200 mm cu polarimetru sau cu sacharimetru.
5.3. Determinarea rotatiei optice (P' sau S') a substantelor solubile in etanol 40%.
Se cantaresc 5 g din proba cu o aproximatie de mg, se plaseaza intr-o retorta gradata de 100 ml si se adauga aproximativ 80 ml de etanol (pct. 3.5) (vezi observatia 7.2). Se lasa retorta sa stea timp de o ora la temperatura camerei. In acest timp, se agita puternic de 6 ori, astfel incat proba test este bine amestecata cu etanol. Se aduce la volum cu etanol (pct. 3.5), se omogenizeaza si se filtreaza.
Se picura 50 ml din filtrat (= 2,5 g din proba) intr-o retorta Erlenmeyer de 250 ml, se adauga 2,1 ml de acid clorhidric (pct. 3.1) si se agita cu vigoare. Se echipeaza retorta Erlenmeyer cu un condensator de reflux si se imerseaza acesta din urma intr-o baie de apa fierbinte. Dupa exact 15 minute, se indeparteaza retorta Erlenmeyer din baie, se transfera continutul intr-o retorta gradata de 100 ml, clatindu-se cu putina apa rece si se raceste la 200C. Se clarifica filtratul utilizandu-se solutiile Carrez I (pct. 3.3) si II (pct. 3.4), se aduce la volum cu apa, se omogenizeaza, se filtreaza si se masoara rotatia optica, asa cum s-a indicat la pct. 5.2.
6. Calcularea rezultatelor
Continutul de amidon(%) este calculat dupa cum urmeaza:
6.1. Masurare cu polarimetru
Continut de amidon(%) = 2000(P - P'
[α]![]()
unde:
P = rotatia optica totala in grade
P'= rotatia optica in grade a substantelor solubile in etanol 40% (V/V);
[α]![]() = rotatie optica specifica de amidon pur.
Valorile numerice acceptate conventional pentru acest factor sunt
urmatoarele:
= rotatie optica specifica de amidon pur.
Valorile numerice acceptate conventional pentru acest factor sunt
urmatoarele:
+ 185,9°: amidon din orez
+ 185,4°: amidon din cartofi
+ 184,6°: amidon din porumb
+ 182,7°: amidon din grau
+ 181,5°: amidon din orz
+ 181,3°: amidon din ovaz
+ 184,0°: alte tipuri de amidon si amestecuri de amidon din furaje combinate.
6.2. Masurarea cu sacharimetru
Continut de amidon= ![]()
unde :
S = rotatia optica totala in grade sacharimetrice;
S' = rotatia optica in grade sacharimetrice a substantelor solubile in etanol 40% (V/V);
N = greutatea in grame a sucrozei in 100 ml de apa ce da o rotatie optica de 100 de grade sacharimetrice atunci cand este masurata utilizand intr-un tub de 200 mm. Greutatea variaza dupa cum urmeaza, in conformitate cu tipul de sacharimetru utilizat:
16,29 g pentru zaharimetrele franceze
26,00 g pentru zaharimetrele germane
20,00 g pentru zaharimetrele mixte;
[α]![]() = rotatie optica specifica a amidonului pur
(vezi pct. 6.1).
= rotatie optica specifica a amidonului pur
(vezi pct. 6.1).
6.3. Repetabilitate
Diferenta dintre rezultatele a doua determinari paralele efectuate pe aceeasi proba trebuie sa fie de maximum 0,4, in valoare absoluta, pentru un continut de amidon mai mic de 40% si 1,1%, in valoare relativa, pentru continuturi de amidon de minimum 40%.
7. OBSERVATII
7.1. Daca proba contine mai mult de 6% carbonati, calculati in termeni de carbonat de calciu, acestia trebuie sa fie distrusi prin tratament cu exact cantitatea corespunzatoare de dilutie de acid sulfuric, inainte de determinarea rotatiei optice totale.
7.2. In cazul produselor cu un continut ridicat de lactoza, precum zerul pudra sau laptele praf degresat, se procedeaza dupa cum urmeaza: dupa ce se adauga 80 ml de etanol (pct. 3.5). Se echipeaza retorta cu un condensator de reflux si se imerseaza aceasta din urma intr-o baie cu apa la 500C, timp de 30 de minute. Se lasa sa se raceasca si se continua analiza, asa cum s-a indicat la pct. 5.3.
7.3. In cazul in care urmatoarele materii furajere sunt prezente in cantitate semnificativa in furaje, pot apare interferente atunci cand se determina continutul de amidon prin metoda polarimetrica si, de aceea, pot fi obtinute rezultate incorecte:
a) produse din sfecla (de zahar) cum ar fi pulpa de sfecla (de zahar), melasa de sfecla
(de zahar), pulpa melasata de sfecla (de zahar), borhot de sfecla (de zahar), zahar (de
sfecla),
b) pulpa de citrice,
c) samanta de in; turte de in obtinute prin presare; turte de in rezultate dupa extractie,
d) samanta de rapita; turte de rapita obtinute prin presare; turte de rapita rezultate dupa
extractie; hoaspe de samanta de rapita,
e) samanta de floarea soarelui; turte de floarea soarelui rezultate dupa extractie
samanta de floarea soarelui partial decorticata, extrasa,
f) turte de copra obtinute prin presare; turte de copra rezultate dupa extractie,
g) pulpa de cartof,
h) drojdie deshidratata,
i) produse bogate in inulina (ex. taitei si faina de topinambur);
j) jumari."
II. DETERMINAREA PROTEINEI BRUTE
1. SCOP SI DOMENIU DE APLICARE
Aceasta metoda se utilizeaza pentru determinarea continutului de proteina bruta din furaje pe baza continutului de azot, determinat in conformitate cu metoda Kjeldahl.
2. PRINCIPIU
Proba se digera cu acid sulfuric in prezenta unui catalizator. Solutia acida trebuie alcalinizata cu solutie de hidroxid de sodiu. Amoniacul se distileaza si se colecteaza intr-o cantitate masurata de acid sulfuric, al carui exces este titrat cu o solutie standard de hidroxid de sodiu.
3. REACTIVI
3.1. Sulfat de potasiu
3.2. Catalizator: oxid de cupru (II) CuO sau sulfat de cupru pentahidrat (II), CuSO4 . 5H2O
3.3. Zinc granulat
3.4. Acid sulfuric, ρ20=1,84g/ml.
3.5. Acid sulfuric C(![]() H2SO4) = 0,5 mol/l.
H2SO4) = 0,5 mol/l.
3.6. Acid sulfuric C(![]() H2SO4) = 0,1 mol/l.
H2SO4) = 0,1 mol/l.
3.7. Indicator rosu de metil: se dizolva 300 mg de rosu de metil in 100 ml de etanol, σ = 95 -96% (v/v)
3.8. Solutie de hidroxid de sodiu (poate fi utilizat gradul tehnic) ß = 40g/100ml (m/v :40%).
3.9. Solutie c de hidroxid de sodiu 0,25ml/l.
3.10. Solutie c de hidroxid de sodiu 0,1mol/l.
3.11. Piatra ponce granulata, spalata in acid clorhidric si aprinsa
3.12. Acetanilida ( m.p. = 1140C, N = 10,36%)
3.13. Sucroza (libera de azot).
4. APARATURA
Aparatura potrivita pentru efectuarea digestiei, distilarii si titrarii, in conformitate cu procedura Kjedahl.
5. PROCEDURA
5.1. Digestie
Se cantareste 1g de proba cu o aproximatie de 0,001 g si se transfera in retorta aparatului de digestie. Se adauga 15 g de sulfat de potasiu (pct. 3.1), o cantitate corespunzatoare de catalizator (pct. 3.2) (0,3 pana la 0,4 g de oxid de cupru (II) sau 0,9 pana la 1,2 g de sulfat de cupru pentahidrat(II)), 25 ml de acid sulfuric (pct. 3.4) si cateva granule de piatra ponce (pct. 3.11) si se amesteca. Se incalzeste mai intai retorta cu moderatie, rotindu-se din cand in cand, daca este necesar, pana cand masa de proba s-a carbonizat si spuma a disparut; Se incalzeste apoi mai intens pana cand lichidul fierbe constant. Incalzirea este adecvata daca acidul fiert condenseaza pe peretele retortei. Se previne ca peretii sa devina supraincalziti si ca particule organice sa se lipeasca pe acestia. Cand solutia devine clara si verde deschis, se continua sa se fiarba timp de inca doua ore, apoi se lasa sa se raceasca.
5.2. Distilare
Se adauga cu grija destula apa pentru dizolvarea completa a sulfatilor. Se lasa sa se raceasca si apoi se adauga cateva granule de zinc (pct. 3.3).
Se plaseaza in retorta de colectare a apartului de distilare o cantitate exacta masurata de 25 ml de acid sulfuric (pct. 3.5) sau (pct. 3.6), depinzand de continutul de azot estimat. Se adauga cateva picaturi de indicator de rosu de metil (pct. 3.7).
Se conecteaza retorta de digestie la condensatorul aparatului de distilare si se imerseaza portiunea terminala a condensatorului in lichidul continut in retorta de colectare, la o adancime de cel putin 1cm (vezi observatia de la pct. 8.3). Se toarna incet 100 ml de solutie de hidroxid de sodiu (pct. 3.8) in retorta de digestie, fara a se pierde amoniac. (vezi observatia de la pct. 8.1).
Se incalzeste retorta pana cand amoniacul s-a distilat.
5.3. Titrare
Se titreaza excesul de acid sulfuric in retorta de colectare cu solutie de hidroxid de sodiu (pct. 3.9) sau (pct. 3.10), depinzand de concentratia de acid sulfuric utilizata, pana cand este atins punctul final.
5.4. Test martor
Pentru a se confirma ca reactivii sunt liberi de azot, se efectueaza un test martor (digestie, distilare si titrare), utilizand 1g de sucroza (pct. 3.13) in locul probei.
6. CALCULAREA REZULTATELOR
Continutul in proteina bruta este calculat in conformitate cu urmatoarea formula:
![]()
Unde,
V0 Volumul (ml) de NaOH (pct. 3.9 sau pct. 3.10) utilizat la testul martor.
V1 Volumul (ml) de NaOH (pct. 3.9 sau pct. 3.10) utilizat la titrarea probei.
C concentratia (mol/l) de hidroxid de sodiu (pct. 3.9 sau pct. 3.10)
m masa probei (g)
7. VERIFICAREA METODEI
7.1. Repetabilitate
Diferenta dintre rezultatele a doua determinari paralele, efectuate pe aceeasi proba, trebuie sa fie de maximum:
0,2% in valoare absoluta, pentru un continut de proteina bruta mai mic de 20%;
1,0% relativ la valoarea mai mare, pentru un continut de proteina bruta de la 20% la 40%;
0,4% in valoare absoluta, pentru un continut de proteina bruta de peste 40%.
7.2. Acuratete
Se efectueaza analiza(digestie, distilare si titrare) pe 1,5 pana la 2 g de acetanilida (pct. 3.12), in prezenta a 1g de sucroza (pct. 3.13); 1g de acetanilida consuma 14,8 ml de acid sulfuric (pct. 3.5). Recuperarea trebuie sa fie de cel putin 99%.
8. OBSERVATII
8.1. Aparatura poate fi de tip manual, semi-automat sau automat. Daca aparatura necesita transferul intre fazele de digestie si de distilare, acest transfer trebuie sa fie efectuat fara pierdere. Daca retorta aparatului de distilat nu este echipata cu o palnie, se adauga, imediat, inainte de conectarea retortei la condensator hidroxid de sodiu, turnand incet pe pereti.
8.2. Daca materialul digerat se solidifica, se reincepe determinarea, utilizandu-se o cantitate mai mare de acid sulfuric (pct. 3.4) decat cea specificata anterior.
8.3. Pentru produse cu un continut scazut de azot, volumul de acid sulfuric (pct. 3.6) ce trebuie plasat in retorta de colectare poate fi redus pana la 10 sau 15 ml, daca este necesar, si se aduce la volum cu apa pana la 25 ml.
III. DETERMINAREA PROTEINEI BRUTE DESCOMPUSA DE
PEPSINA SI ACID CLORHIDRIC
1. SCOP SI DOMENIU DE APLICARE
Aceasta metoda se utilizeaza pentru determinarea fractiunii de proteina bruta descompusa de pepsina si acid clorhidric in baza conditiilor definite. Aceasta este aplicabila tuturor furajelor.
2. PRINCIPIU
Proba trebuie incalzita timp de 48 de ore, la 400C, intr-o solutie clorhidrica de pepsina. Suspensia trebuie filtrata, iar continutul in azot al filtratului determinat in conformitate cu metoda pentru determinarea proteinei brute.
3. REACTIVI
3.1. Acid clorhidric, d: 1,125.
3.2. Acid clorhidric, 0,075 N.
3.3. 2,0 U/mg pepsina. Activitatea pepsinei este definita de metoda descrisa de partea a-4-a, a acestei anexe si trebuie sa fie stabilita in conformitate cu acea metoda.
3.4. Aproximativ 0,2% (w/v) solutie proaspat preparata de acid clorhidric (pct. 3.2); Activitate: 400 U/L.
3.5. Emulsie anti-spuma (de ex. silicon).
3.6. Toti reactivii listati la pct. 3 pentru metoda de determinare a proteinei brute.
4. APARATURA
4.1. Baie de apa sau incubator, fixat la 400C ± 10C.
4.2. Aparatura de digestie si de distilare Kjedahl.
5. PROCEDURA
5.1. Prepararea solutiei (vezi observatia 7.2)
Se cantaresc 2 g din proba, cu o aproximatie de mg si se plaseaza intr-o retorta gradata de 500 ml. Se adauga 450 ml de solutie clorhidrica de pepsina (pct. 3.4), incalzita anterior la 400C si se agita pentru a se preveni formarea flocoanelor. Se controleaza ca ph-ul suspensiei sa fie mai mic de 1,7. Se plaseaza retorta intr-o baie de apa sau incubator (pct. 4.1) si se lasa acolo timp de 48 de ore. Se agita dupa 8, 24 si 32 de ore. Dupa 48 de ore se adauga 15 ml de acid clorhidric (pct. 3.1), se raceste pana la 200C, se aduce la volum cu apa si se filtreaza.
5.2. Digestia
Se iau 250 ml de filtrat si se plaseaza in retorta aparatului de distilare (pct. 4.2). Se adauga reactivii necesari pentru digestia indicata in a doua propozitie a pct. 5.1. a metodei pentru determinarea proteinei brute. Se omogenizeaza si se aduce la fierbere. Daca se formeaza orice spuma, se adauga cateva picaturi de emulsie anti-spuma (pct. 3.5). Se continua fierberea cu vigoare pana cand apa s-a evaporat aproape complet. Se reduce caldura si se elimina cu atentie ultimele urme de apa.
Cand solutia devine clara si incolora (sau verde deschis, daca este utilizat un catalizator pe baza de cupru), se continua fierberea timp de inca o ora. Se lasa sa se raceasca.
5.3. Distilare si titrare
Se procedeaza, asa cum s-a indicat la pct. 5.2. si 5.3. ale metodei pentru determinarea proteinei brute.
5.4. Test martor
Se efectueaza un test martor aplicand aceeasi procedura, dar omitand proba ce trebuie analizata.
6. CALCULAREA REZULTATELOR
Se scade volumul de acid sulfuric consumat la testul martor din cel consumat la proba test. 1 ml de acid sulfuric 0,1N corespunde la 1,4 mg de azot.
Se multiplica cantitatea de azot cu factorul 6,25. Se exprima rezultatul ca procent din proba.
Repetabilitate
Diferenta dintre rezultatele a doua determinari paralele, efectuate pe aceeasi proba, trebuie sa fie de maximum:
0,4, in valoare absoluta, pentru un continut mai mic de 20%;
2,0%, in valoare absoluta, pentru un continut peste 20% si nu mai mult 40%;
0,8, in valoare absoluta, pentru un continut de peste 40%.
7. OBSERVATII
7.1. Valorile obtinute prin aceasta metoda nu au conexiune directa cu digestibilitatea in vivo.
7.2. Produsele cu un continut in ulei sau grasime ce depaseste 10%, trebuie mai intai sa fie degresate prin extractie cu eter petrol (B.P. 400C pana la 600C).
IV. ESTIMAREA ACTIVITATII PEPSINEI
1. SCOP SI DOMENIU DE APLICARE
Aceasta metoda se utilizeaza la stabilirea activitatii de pepsina utilizata in determinarea proteinei brute descompusa de pepsina si acid clorhidric.
2. PRINCIPIU
Hemoglobina trebuie tratata cu pepsina, intr-un mediu de acid clorhidric, in baza conditiilor definite. Fractiunea nehidrolizata a proteinei este precipitata in acid tricloracetic. Sunt adaugate filtratului hidroxid de sodiu si reactiv Folin-Ciocalteu. Densitatea optica a acestei solutii trebuie masurata la lungimea de unda de 750 nm, iar cantitatea corespunzatoare de tirozina trebuie citita de pe curba de calibrare.
Definitie: Unitatea de pepsina este definita ca fiind cantitatea din acea enzima ce in baza conditiilor metodei, elibereaza per minut o anumita cantitate din grupele hidroxiaril care, atunci cand intra in contact cu reactivul Folin-Ciocalteu, are o densitate optica corespunzatoare celei la care un μmol de tirozina reactioneaza in aceeasi maniera.
3. REACTIVI
3.1. Acid clorhidric 0,2 N.
3.2. Acid clorhidric 0,06 N.
3.3. Acid clorhidric 0,025 N.
3.4. Solutie 5% (w/v) de acid tricloracetic.
3.5. Solutie de hidroxid de sodiu 0,5 N.
3.6. Reactiv Folin-Ciocalteu.
Se plaseaza 100 g de tungstat de sodiu (Na2WO4 . 2H2O), 25 g de molibdat de sodiu (Na2MoO4 . 2H2O) si 700 ml de apa intr-o retorta cu fundul rotund de 2 litri echipata cu o imbinare standard de sticla mata. Se adauga 50 ml de acid fosforic (d:1,71) si 100 ml de acid clorhidric concentrat (d: 1,19), se conecteaza un condensator de reflux la retorta, se aduce la fierbere si se tine solutia fierband usor timp de 10 ore. Se lasa sa se raceasca, se detaseaza condensatorul de reflux, se adauga 175 g de sulfat de litiu (Li2SO4 . 2H2O), 50 ml de apa si 1 ml de bromura. Se fierbe timp de 15 minute pentru a se elimina excesul de bromura.
Se lasa sa se raceasca, se transfera solutia intr-o retorta gradata de 1litru, se aduce la volum cu apa, se omogenizeaza si se filtreaza. Nu trebuie sa ramana nici o coloratie verzuie. Inainte de utilizare se dilueaza 1 volum de reactiv cu 2 volume de apa.
3.7. Solutie de hemoglobina:
Se cantareste o cantitate de hemoglobina (aproximativ 2g de substrat proteic determinat in conformitate cu Anson) ce corespunde la 354 mg de azot (1) si se plaseaza intr-o retorta de 200 ml echipata cu o imbinare standard de sticla mata.
(1) Se determina continutul in azot prin metoda semi-micro Kjeldahl (continutul teoretic:17,7% de azot).
Se adauga cativa ml de acid clorhidric (pct. 3.2), se conecteaza retorta la pompa de vacuum si se agita pana cand hemoglobina a fost dizolvata complet. Se elibereaza vacuumul si se adauga, in timp ce se agita, acid clorhidric (pct. 3.2), se completeaza pana la 100 ml. Se prepara imediat inainte de utilizare.
3.8. Solutie standard de tirozina:
Se dizolva 181,2 mg de tirozina in acid clorhidric (pct. 3.1) si se completeaza pana la un litru cu acelasi acid (solutie Stick). Se iau 20 ml si se dilueaza pana la 100 ml cu acid clorhidric (pct. 3.1). 1ml din aceasta solutie contine 0,2 μmoli de tirozina.
4. APARATURA
4.1. Baie de apa fixata la 250C ± 0,10C prin ultratermostat.
4.2. Spectrofotometru
4.3. Cronometru, acuratete: 1secunda.
4.4. Ph-metru.
5. PROCEDURA
5.1. Prepararea solutiei (vezi observatia de la pct. 7.1)
Se dizolva 150 mg de pepsina in 100 ml de acid clorhidric (pct. 3.2). Se pipeteaza 2 ml din solutie intr-o retorta gradata de 50 ml si se aduce la volum cu acid clorhidric (pct. 3.3). Ph-ul, controlat cu ph-metru, trebuie sa fie de 1,6 ± 0,1. Se imerseaza retorta intr-o baie de apa (pct. 4.1).
5.2. Hidroliza
Se pipeteaza 5,0 ml de solutie de hemoglobina (pct. 3.7) intr-o eprubeta, se incalzeste intr-o baie de apa la 250C (pct. 4.1), se adauga 1 ml de solutie de pepsina obtinuta ca la pct. 5.1. si se amesteca cu o bagheta de sticla ingrosata la un capat, cu aproximativ 10 miscari inainte si inapoi. Se lasa eprubeta intr-o baie de apa la 250C, exact 10 minute, masurate de la adaugarea solutiei de pepsina (trebuie sa fie respectate cu strictete durata si temperatura). Apoi se adauga 10,0 ml de solutie de acid tricloracetic (pct. 3.4), incalzita anterior la 250C, se omogenizeaza si se filtreaza printr-un filtru uscat.
5.3. Evolutia colorarii si masurarea densitatii optice.
Se pipeteaza 5,0ml de filtrat intr-o retorta Erlenmeyer de 50 ml, se adauga 10,0 ml de solutie de hidroxid de sodiu (pct. 3.5) si, agitandu-se constant, 3 ml de reactiv Folin Ciocalteu diluat (pct. 3.6). Dupa 5 pana la 10 minute, se determina densitatea optica a solutiei cu spectrofotometru la 750 nm in celule de 1 cm impermeabile.
5.4. Test martor
Pentru fiecare determinare se efectueaza un test martor dupa cum urmeaza: Se pipeteaza 5 ml de solutie de hemoglobina (pct. 3.7) intr-o eprubeta, se incalzeste intr-o baie de apa la 250C (pct. 4.1), se adauga 10,0 ml de solutie de acid tricloracetic (pct. 3.4) incalzita anterior la 250C, se omogenizeaza, apoi se adauga 1,0 ml de solutie de pepsina obtinuta la pct. 5.1. Se amesteca cu o bagheta de sticla si se lasa eprubeta in baia de apa (pct. 4.1) la 250C pentru exact 10 minute. Se omogenizeaza si se filtreaza printr-un filtru uscat. Se urmeaza procedura indicata la pct. 5.3.
5.5. Curba de calibrare
Se plaseaza 1,0 , 2,0 , 3,0 , 4,0 si 5,0 ml alicote de solutie standard de tirozina (pct. 3.8), corespunzand la 0,2 , 0,4 , 0,6 , 0,8 , si 1,0 μmoli de tirozina respectiv, in retorte Erlenmayer de 50 ml. Se incheie seriile cu o solutie de referinta libera de tirozina. Se aduce la volum pana la 5 ml cu acid clorhidric (pct. 3.1). Se adauga 10,0 ml de solutie de hidroxid de sodiu (pct. 3.5) si, agitandu-se constant, 3 ml de dilutie de reactiv Folin-Ciocalteu (pct. 3.6). Se masoara densitatea optica, asa cum s-a indicat la ultima propozitie a pct. 5.3. Se traseaza curba de calibrare prin schitarea densitatilor optice corelate cu cantitatile de tirozina.
6. CALCULAREA REZULTATELOR
De pe curba de calibrare se citeste cantitatea de tirozina in µmoli ce corespunde densitatii optice a solutiei colorate, corectata pe baza valorii martor.
Activitatea pepsinei, in µmoli de tirozina la 250C per mg si per minut, se calculeaza utilizand formula:
Unitati per mg (U/mg) = ![]()
unde:
a cantitatea de tirozina in µmoli ce se citeste de pe curba de calibrare;
P greutatea in mg a cantitatii de pepsina adaugata la pct. 5.2.
7. OBSERVATII
7.1. Cantitatea de pepsina ce trebuie dizolvata trebuie sa fie astfel incat, la masurarea fotometrica finala, este obtinuta o densitate optica de 0,35 ± 0,035.
7.2. Doua unitati per mg, obtinute prin aceasta metoda, corespund la: 3,64 miliunitati Anson/mg (µmoli de tirozina/mg . min. la 35,50C) sau 36 400 unitati comerciale/g (µmoli de tirozina/g in 10min. la 35,50C).
V. DETERMINAREA DE GOSIPOL LIBER
1. SCOP SI DOMENIU DE APLICARE
Aceasta metoda se utilizeaza pentru determinarea nivelurilor de gosipol liber, de gosipol total si de substante chimic legate de acesta din samanta de bumbac, faina de samanta de bumbac si brichete de samanta de bumbac si din furaje combinate ce contin aceste substante, atunci cand sunt prezente in cantitate mai mare de 20 ppm.
2. PRINCIPIU
Gosipolul trebuie extras in prezenta 3-aminopropan-1-ol, fie cu un amestec de propan-2-ol si hexan, pentru determinarea gosipolului liber sau cu dimetilformamida, pentru determinarea gosipolului total. Gosipolul este convertit de anilina in gosipol-dianilina, a carei densitate optica este masurata la lungimea de unda de 440 nm.
3. REACTIVI
3.1. Amestec de propan-2-olhexan: se amesteca 60 de parti de volum de propan-2-ol A.R. cu 40 de parti de volum de n-hexan.
3.2. Solvent A: se plaseaza intr-o retorta gradata de 1 litru aproximativ 500 ml de amestec de propan-2-ol-hexan (pct. 3.1), 2 ml de aminopropan-1-ol, 8 ml de acid acetic glacial si 50 ml de apa. Se aduce la volum cu amestec de propan-2-ol-hexan (pct. 3.1). Acest reactiv este stabil timp de o saptamana.
3.3. Solvent B: se pipeteaza 2 ml de 3-aminopropan-1-ol si 10 ml de acid acetic glacial intr-o retorta gradata de 100 ml. Se raceste la temperatura camerei si se aduce la volum cu N, N-dimetilformamida. Acest reactiv este stabil timp de o saptamana.
3.4. Anilina A.R.: Daca densitatea optica a testului martor depaseste 0,022, se distileaza anilina peste praf de zinc, aruncand prima si ultima fractiune de 10% a distilatului. Refrigerat si depozitat intr-o retorta maro cu dop de sticla, acest reactiv se va tine timp de cateva luni.
3.5. Solutie standard A de gosipol: Se plaseaza 27,9 mg de acetat de gosipol intr-o retorta gradata de 250 ml. Se dizolva si se aduce la volum cu solvent A (pct. 3.2). Se pipeteaza 50 ml din aceasta solutie intr-o retorta gradata de 250 ml si se aduce la volum cu solvent A. Concentratia in gosipol a acestei solutii este de 0,02 mg per ml. Se lasa sa stea timp de o ora la temperatura camerei inainte de utilizare.
3.6. Solutie B standard de gosipol: Se plaseaza 27,9 mg de acetat de gosipol intr-o retorta gradata de 50 ml. Se dizolva si se aduce la volum cu solvent B (pct. 3.3). Concentratia de gosipol a acestei solutii este de 0,5mg per ml.
Solutiile standard A si B de gosipol vor ramane stabile timp de 24 de ore, daca au fost ferite de lumina.
4. APARATURA
4.1. Mixer (cu pahar): aproximativ 35rpm.
4.2. Spectrofotometru.
5. PROCEDURA
5.1. Proba test
Cantitatea de proba test utilizata depinde de continutul estimat de gosipol al probei. Este preferabil sa se lucreze cu o proba test mica si cu o parte relativ mare de alicota a filtratului, astfel incat sa se obtina suficient gosipol, pentru ca sa fie posibila masurarea fotometrica precisa. Pentru determinarea de gosipol liber din samanta de bumbac, faina de samanta de bumbac si din brichetele de samanta de bumbac, proba test nu trebuie sa depaseasca 1g. Pentru furaje combinate, aceasta poate fi de maximum 5 g. O parte de alicota de 10 ml din filtrat este corespunzatoare in majoritatea cazurilor. Aceasta trebuie sa contina 50 pana la 100µg de gosipol. Pentru determinarea gosipolului total, proba test trebuie sa fie intre 0,5 si 5g, pentru ca o parte de 2 ml de alicota din filtrat sa contina 40 pana la 200 µg de gosipol.
Analiza trebuie sa fie efectuata la o temperatura a camerei de aproximativ 200C.
5.2. Determinarea de gosipol liber
Se plaseaza proba test intr-o retorta cu gat stramt de 250 ml, fundul retortei fiind acoperit cu sticla pisata. Utilizand o pipeta, se adauga 50 ml de solvent A (pct. 3.2), se astupa retorta si se amesteca timp de o ora cu mixerul. Se filtreaza printr-un filtru uscat si se colecteaza filtratul intr-o retorta cu gatul stramt. Se acopera palnia in timpul filtrarii cu o sticla de ceas. Se pipeteaza parti identice de alicota din filtrat ce contine 50 pana la 100 µg de gosipol in fiecare din cele doua retorte gradate de 25 ml (A si B). Daca este necesar, se aduce la volum pana la 10 ml cu solventul A (pct. 3.2). Apoi se aduce la volum continutul retortei (A) cu amestec de propan-2-ol-hexan (pct. 3.1). Aceasta solutie este utilizata ca solutie de referinta fata de care se masoara solutia probei.
Se pipeteaza 10 ml de solvent A (pct. 3.2) in fiecare din celelalte doua retorte gradate de 25 ml (C si D). Se aduce la volum continutul retortei (C) cu amestec de propan-2-ol-hexan (pct. 3.1). Aceasta solutie este utilizata ca solutie de referinta fata de care se masoara solutia testului martor.
Se adauga 2 ml de anilina (pct. 3.4) in fiecare din retorte (D) si (B). Se incalzeste timp de 30 de minute deasupra unei bai de apa fierbinte, pentru a dezvolta culoarea. Se raceste la temperatura camerei, se aduce la volum cu amestec de propan-2-ol-hexan (pct. 3.1), se omogenizeaza si se lasa sa stea timp de o ora.
Se determina densitatea optica a solutiei testului martor (D) prin comparare cu solutia de referinta (C) si densitatea optica a solutiei probei (B) prin comparare cu solutia de referinta (A), cu spectrofotometru la o lungime de unda de 440 nm, utilizandu-se celule de sticla de 1cm.
Se scade densitatea optica a solutiei testului martor din cea a solutiei probei (= densitatea optica corectata). Din aceasta valoare se calculeaza continutul in gosipol liber, asa cum s-a indicat la pct. 6.
5.3. Determinarea gosipolului total
Se plaseaza o proba test ce contine 1 pana la 5 mg de gosipol intr-o retorta gradata de 50 ml si se adauga 10 ml de solvent B (pct. 3.3). In acelasi timp, se prepara un test martor, plasand 10 ml de solvent B (pct. 3.3) in alta retorta gradata de 50 ml. Se incalzesc cele doua retorte timp de 30 de minute deasupra unei bai de apa fierbinte. Se raceste la temperatura camerei si se aduce la volum continutul fiecarei retorte cu amestec de propan-2-ol-hexan (pct. 3.1), se omogenizeaza si se lasa sa sedimenteze timp de 10 pana la 15 minute, apoi se filtreaza si se colecteaza filtratele in retorte de sticla mata cu gat stramt.
Se pipeteaza 2 ml de filtrat al probei in fiecare din cele doua retorte gradate de 25 ml si inca 2 ml de filtrat al probei martor in fiecare din alte doua retorte de 25 ml. Se aduce la volum continutul unei retorte din fiecare serie pana la 25 ml, cu amestec de propan-2-ol-hexan (pct. 3.1). Aceste solutii sunt utilizate ca solutii de referinta.
Se adauga 2 ml de anilina (pct. 3.4) in fiecare din cele doua retorte. Se incalzeste timp de 30 de minute deasupra unei bai de apa fierbinte, pentru a dezvolta culoarea. Se raceste la temperatura camerei, se aduce la volumul de 25ml cu amestec de propan-2-ol-hexan (pct. 3.1), se omogenizeaza si se lasa sa sedimenteze timp de o ora.
Se determina densitatea optica, asa cum s-a indicat la pct. 5.2. pentru gosipolul liber. Din aceasta valoare se calculeaza continutul de gosipol liber, asa cum s-a indicat la pct. 6.
6. CALCULAREA REZULTATELOR
Rezultatele pot fi calculate fie pornindu-se de la densitatea optica specifica (pct. 6.1), fie prin referire la o curba de calibrare (pct. 6.2).
6.1. Utilizarea densitatii optice specifice
Densitatile optice specifice, in baza conditiilor descrise, sunt urmatoarele:
gosipol liber: E ![]() = 625
= 625
gosipol total: E ![]() = 600
= 600
Continutul de gosipol liber si total al probei este calculat dupa urmatoarea formula:
% gosipol = ![]()
unde:
E = densitatea optica corectata, determinata asa cum s-a indicat la pct. 5.2.;
p = proba test, in g;
a = parte de alicota a filtratului, in ml.
6.2. Utilizarea curbei de calibrare
6.2.1. Gosipol liber
Se prepara 2 serii de cinci retorte gradate de 25 ml. Se pipeteaza alicote de 2,0 , 4.0 , 6,0 , 8,0 si 10,0 de solutie standard A de gosipol (pct. 3.5) in fiecare serie de retorte. Se aduce la volum pana la 10 ml cu solvent A(pct. 3.2). Se completeaza fiecare serie cu o retorta gradata de 25 ml care contine numai 10 ml de solvent A(pct. 3.2) (test martor).
Se aduce la volum retortele din primele serii(incluzand retorta pentru testul martor) pana la 25 ml cu amestec de propan-2-ol-hexan(pct. 3.1) (serii de referinta).
Se adauga 2 ml de anilina (pct. 3.4) pentru fiecare retorta din a doua serie(incluzand retorta pentru testul blanc). Se incalzeste timp de 30 de minute intr-o baie de apa fierbinte pentru a dezvolta culoarea. Se raceste la temperatura camerei, se aduce la volum cu amestec de propan-2-ol-hexan(pct. 3.1), se omogenizeaza si se lasa sa stea timp de o ora (serii standard).
Densitatea optica a solutiilor din seriile standard se determina, asa cum s-a indicat la pct. 5.2, prin comparare cu solutiile corespunzatoare din seriile de referinta. Se traseaza curba de calibrare prin schitarea densitatii optice in raport cu cantitatile de gosipol (in μg).
6.2.2 Gosipol total
Se prepara sase retorte gradate de 50 ml. In prima retorta se plaseaza 10 ml de solvent B (pct. 3.3), iar in celelalte se plaseaza respectiv 2,0 , 4,0 , 6,0 , 8,0 si 10,0 ml de solutie standard B de gosipol (pct. 3.6). Se umple continutul fiecarei retorte pana la 10 ml cu solvent B(pct. 3.3). Se incalzeste timp de 30 de minute intr-o baie de apa fierbinte. Se raceste la temperatura camerei, se umple volumul cu amestec de propan-2-ol-hexan (pct. 3.1) si se omogenizeaza.
Se plaseaza 2.0 ml din aceste solutii in fiecare din cele doua serii de sase retorte gradate de 25 ml. Se umple continutul retortelor din prima serie pana la 25 ml cu amestec de propan-2-ol-hexan (pct. 3.1) (serii de referinta).
Se adauga 2 ml de anilina(pct. 3.4) in fiecare retorta din cele doua serii. Se incalzeste timp de 30 de minute intr-o baie cu apa fierbinte. Se raceste la temperatura camerei, se aduce la volum cu amestec de propan-2-ol-hexan(pct. 3.1), se omogenizeaza si se lasa sa stea timp de o ora (serii standard).
Se determina densitatea optica a solutiilor din seriile standard, asa cum s-a indicat la pct. 5.2, prin comparare cu solutiile corespunzatoare din seriile de referinta. Se traseaza curba de calibrare prin schitarea densitatii optice in raport cu cantitatile de gosipol (in μg).
6.3 Repetabilitate
Diferenta dintre rezultatele celor doua determinari paralele efectuate pe aceeasi proba trebuie sa fie de maximum:
a) 15%, in valoare absoluta, pentru continut de gosipol mai mic de 500 ppm;
b) 75 ppm, in valoare absoluta, pentru continut de gosipol de minimum 500 ppm si maximum 750 ppm,;
c) 10%, in valoare absoluta, pentru continut de gosipol maimare de 750 ppm.
ANEXA nr. 2
la norma sanitara veterinara
I. DETERMINAREA TILOZINEI
- prin difuziune pe agar-
1. Scop si domeniu de aplicare
Aceasta metoda se utilizeaza pentru determinarea continutului de tilozina din furaje, concentrate si premixuri, atunci cand este prezenta in cantitate mai mare de 2 ppm.
2. PRINCIPIU
Proba trebuie tratata cu o solutie tampon fosfat la ph 8, incalzita anterior la 800C si apoi extrasa cu metanol. Dupa centrifugare, extrasul trebuie diluat si determinata activitatea antibiotica a acestuia prin masurarea difuziei tilozinei pe mediu de agar insamantat cu Sarcina lutea. Difuzia este evidentiata prin formarea de zone de inhibitie in prezenta microorganismului. Diametrul acestor zone este direct proportional cu logaritmul concentratiei de antibiotic.
3. MICROORGANISM: Sarcina lutea ATCC nr. 9341
3.1. Intretinerea tulpinii parentale
Se inoculeaza cu Sarcina lutea un tub de agar inclinat prelevat din mediul de cultura (pct. 4.1), se ajusteaza pana la ph 7,0. Se incubeaza peste noapte la aproximativ 350C. Se tine cultura intr-un refrigerator si se reinoculeaza agarul inclinat cu aceasta in fiecare luna.
3.2. Prepararea suspensiei bacteriene
Se colecteaza bacteriile dintr-o eprubeta cu agar inclinat, recent preparata (pct. 3.1), utilizand 2 pana la 3 ml de solutie fiziologica salina (pct. 4.4). Cu aceasta suspensie se insamanteaza o retorta Roux ce contine 250 ml mediu de cultura (pct. 4.1), ajustat la ph 7,0. Se incubeaza timp de 24 de ore, la 350C, apoi se colecteaza bacteriile in 25 ml de ser fiziologic (pct. 4.4). Se omogenizeaza si se dilueaza aceasta suspensie pentru a se obtine o transmisie a luminii de aproximativ 75% la 650 nm.
Aceasta solutie poate fi utilizata timp de o saptamana, daca a fost tinuta intr-un refrigerator.
Prin teste preliminarii pe placute cu mediu primar pentru determinare (pct. 4.1), se stabileste cantitatea de inocul ce pentru diferite concentratii de tilozina utilizate, va induce cele mai mari zone de inhibitie posibile ce sunt inca clare. Mediul de cultura este inoculat la temperaturi intre 48 pana la 500C.
4. MEDII DE CULTURA SI REACTIVI
4.1. Mediu primar pentru determinare (1)
Glucoza 1 g
Peptona triptica 10 g
Extract de carne 1,5 g
Extract de drojdie3 g
Agar, conform cu calitatea 10 pana la 20 g
Apa distilatapana la 1000 ml
Se ajusteaza ph-ul la 7, imediat inainte de utilizare, pentru a se intretine tulpina parentala si prepararea suspensiei de bacterii si la ph 8 pentru determinare.
4.2. Solutie tampon fosfat, ph 8
Fosfat de potasiu dehidrogenat KH2PO4 A.R.0,523 g
Fosfat de dipotasiu hidrogenat K2HPO4 A.R. 16,730 g
Apa distilata pana la 1000 ml
4.3. Solutie tampon fosfat, ph 7
Fosfat de potasiu dehidrogenat KH2PO4 A.R.5,5 g
Fosfat de dipotasiu hidrogenat K2HPO4 A.R.13,6 g
Apa distilata pana la 1000 ml
4.4. Ser fiziologic steril.
4.5. Metanol pur.
4.6. Metanol 40% (v/v).
4.7. Amestec de solutie tampon fosfat (pct. 4.2)/ metanol pur: 60/40 ca volum.
4.8. Substanta standard: tilozina cu activitate cunoscuta.
5. SOLUTII STANDARD
Se usuca substanta standard (pct. 4.8) timp de 3 ore la 600C intr-un cuptor cu vacuum (5 mm de mercur). Se cantaresc10 pana la 50 mg intr-o retorta gradata, se dizolva in 5 ml de metanol (pct. 4.5) si se dilueaza solutia cu solutie tampon fosfat, ph 7 (pct. 4.3), pentru a se obtine o concentratie de tilozina baza de 1000 µg per ml.
Se prepara din aceasta solutie de stoc o solutie standard de lucru S8 ce contine 2 µg per ml de tilozina baza prin diluare cu amestecul (pct. 4.7).
Se prepara apoi prin dilutii succesive (1 1), utilizand amestecul (pct. 4.7), urmatoarele concentratii:
S4 1 µg/ml
S2 0,5 µg/ml
S1 0,25 µg/ml
6. EXTRACTIE
Pentru concentrate, se ia o proba test de 10 g; pentru premixuri si furaje o proba test de 20 g. Se adauga 60 ml de solutie tampon fosfat, ph 8 (pct. 4.2), incalzita anterior pana la 800C si se omogenizeaza timp de 2 minute (cu mixer domestic, Ultra-turrax etc).
Se lasa sa sedimenteze timp de 10 minute, se adauga 40 ml de metanol (pct. 4.5) si se omogenizeaza timp de 5minute. Se centrifugheaza extractul si se dilueaza o parte alicota cu amestecul (pct. 4.7), pentru a se obtine o concentratie prezumtiva de tilozina de 2 µg per ml (= U8). Se prepara apoi concentratiile U4, U2 si U1 prin dilutii succesive (1 1), utilizand amestecul (pct. 4.7).
Pentru un continut mai mic de 10 ppm, se evapora extractul pana se usuca, intr-un evaporator rotativ la 350C si se dizolva reziduul in metanol 40% (pct. 4.6).
7. METODA DE DETERMINARE
7.1. Inocularea mediului de cultura
Se inoculeaza mediul primar pentru determinare, la 48 pana la 500C (pct. 4.1), se ajusteaza pana la ph 8.0, cu suspensie de bacterii (pct. 3.2).
7.2. Prepararea placilor
Difuzia in agar este efectuata pe placi utilizand 4 concentratii de solutii standard (S8, S4, S2, S1) si 4 concentratii ale extractului (U8, U4 ,U2, U1). Cele 4 concentratii ale solutiei standard si ale extractului trebuie sa fie plasate in fiecare placa.
De aceea, se aleg tavi ce sunt destul de mari pentru a permite ca cel putin 8 godeuri cu diametrul de 10 pana la 13 mm sa fie realizate in mediu de agar. Se calculeaza necesarul de mediu de cultura de inoculat, (pct. 7.1) pentru a se furniza o acoperire uniforma de aproximativ 2 mm grosime. Testul trebuie sa fie efectuat, de preferinta, pe placi ce constau din placi plate de sticla, echipate cu un inel din aluminiu sau plastic perfectat la nivel, cu diametrul de 200 mm si inalt de 20 mm.
Se pipeteaza in godeuri cantitatile masurate cu acuratete intre 0,1 si 0,15 ml de solutie antibiotica, depinzand de diametrul godeurilor.
Pentru fiecare proba, se repeta difuzia de cel putin 4 ori cu fiecare concentratie, in asa fel incat fiecare determinare sa cuprinda o evaluare de 32 de zone de inhibitie.
7.3. Incubare
Se incubeaza tavile peste noapte, la 35 pana la 370C.
8. EVALUARE
Se masoara diametrul zonelor de inhibitie, de preferinta prin proiectare. Se inregistreaza masuratorile pe hartie semi-logaritmica, impartind logaritmul concentratiilor la diametrul zonelor de inhibitie. Se urmaresc liniile solutiei standard si ale extractului. Cele doua linii sunt paralele, cu conditia sa nu existe nici o interferenta.
Logaritmul activitatii relative este calculat utilizand urmatoarea formula:
![]()
Activitate reala = activitate prezumata x activitate relativa
9. REPETABILITATE
Diferenta dintre rezultatele a doua determinari paralele, efectuate pe aceeasi proba, nu trebuie sa depaseasca 10% in valoare relativa.
II. DETERMINAREA VIRGINIAMICINEI
- prin difuziune pe un mediu de agar-
1. SCOP SI DOMENIU DE APLICARE
Metoda se utilizeaza pentru determinarea virginiamicinei din furaje si premixuri. Limita cea mai joasa de determinare este 2 mg/kg (2 ppm)(1).
2. PRINCIPIU
Proba trebuie extrasa cu o solutie metanolica de Tween 80. Extractul este decantat sau centrifugat si diluat. Activitatea antibiotica a acestuia se determina prin masurarea difuziei virginiamicinei intr-un mediu de agar inoculat cu Micrococcus luteus. Difuzia este relevata prin formarea de zone de inhibitie ale microorganismului. Diametrul acestor zone este estimat a fi direct proportional cu logaritmul concentratiei de antibiotic peste limita concentratiilor de antibiotic utilizate.
3. Microorganism: Micrococcus luteus ATCC 9341 (NCTC 8340, NCIB 8553)
3.1. Intretinerea culturii stoc
Se inoculeaza eprubete ce contin medii de cultura inclinate (pct. 4.1) cu Micrococcus luteus si se incubeaza timp de 24 de ore la 300C. Se pastreaza cultura intr-un refrigerator, la aproximativ 40C. Se reinoculeaza la fiecare doua saptamani.
3.2. Prepararea suspensiei bacteriene(a)
Se recolteaza cresterea bacteriana dintr-un agar inclinat, recent preparat (pct. 3.1) cu 2 pana la 3 ml de solutie de clorura de sodiu (pct. 4.3). Se utilizeaza aceasta suspensie pentru a se inocula 250 ml de cultura de mediu (pct. 4.1) continuta intr-o retorta Roux si se incubeaza timp de 18 pana la 20 de ore la 300C. Se recolteaza cresterea bacteriana in 25 ml de solutie de clorura de sodiu (pct. 4.3) si se amesteca. Se dilueaza suspensia pana la 1/10 cu solutie de clorura de sodiu (pct. 4.3). Transmisia de lumina a suspensiei trebuie sa fie de aproximativ 75%, masurata la 650 nm, intr-o celula de 1 cm, fata de solutie de clorura de sodiu. Aceasta suspensie poate fi pastrata timp de o saptamana, la aproximativ 40C.
4. MEDII DE CULTURA SI REACTIVI
4.1. Mediu de cultura si de proba(b)
Peptona de carne6g
Triptona 4 g
Extract de drojdie3 g
Extract de carne1,5 g
Glucoza 1 g
Agar 10 pana la 20 g
Apa1000 ml
Ph 6,5 (dupa stilizare).
4.2. Fosfat tampon, ph 6
Fosfat acid de potasiu, K2HPO4 2g
Fosfat diacid de potasiu, KH2PO48g
Apa pana la1000 ml
4.3. Solutie de clorura de sodiu 0,8% (w/v): se dizolva 8 g de clorura de sodiu in apa si se dilueaza pana la 1000 ml, apoi se sterilizeaza.
4.4. Metanol
4.5. Amestec de fosfat tampon (pct. 4.2)/metanol (pct. 4.4): 80/20 (v/v).
4.6. Solutie metanolica Tween 80 0,5% (w/v): se dizolva 5 g de Tween 80 in metanol (pct. 4.4) si se dilueaza cu metanol pana la 1000 ml.
4.7. Substanta standard: virginiamicina cu activitate cunoscuta.
5. SOLUTII STANDARD
Se dizolva o cantitate din substanta standard cantarita cu acuratete (pct. 4.7) in metanol (pct. 4.4) si se dilueaza cu metanol (pct. 4.4), pentru a se obtine o solutie stoc ce contine 1000 μg de virginiamicina per ml.
Depozitata intr-o retorta cu astupata la 40C aceasta solutie este stabila pana la 5 zile.
Din aceasta solutie stoc se prepara, prin dilutie succesiva cu amestecul (pct. 4.5), urmatoarele solutii:
S8 1 μg/ml
S4 0, 5μg/ml
S2 0,25 μg/ml
S1 0,125 μg/ml
6. Prepararea extractului si a solutiilor de testare
6.1. Extractie
6.1.1. Produse cu un continut de virginiamicina de pana la 100 mg/kg.
Se cantareste o cantitate din proba de 50 g, se adauga 200 ml de solutie (pct. 4.6) si se agita timp de 30 de minute. Se lasa sa se sedimenteze sau se centrifugheaza, se iau 20 ml de solutie de supernatant si se evapora pana la aproximativ 5 ml, intr-un evaporator rotativ, la o temperatura ce nu depaseste 400C. Se dilueaza reziduul cu amestecul (pct. 4.5), pentru a se obtine un continut de virginiamicina estimat la 1 μg/ml ( = U8).
6.1.2. Produse cu un continut de virginiamicina mai mare de 100 mg/kg.
Se cantareste o cantitate de proba ce nu depaseste 10 g si care contine intre 1-50 mg de virginiamicina, se adauga 100 ml de solutie (pct. 4.6) si se agita timp de 30 de minute. Se lasa sa se sedimenteze sau se centrifugheaza, apoi se dilueaza solutia de supernatant cu amestecul (pct. 4.5), pentru a se obtine un continut de virginiamicina estimat de 1 μg/ml ( = U8).
6.2. Solutii de proba
Din solutia U8 se prepara solutii U4 (continut estimat: 0,5 μg/ml), U2 (continut estimat: 0,25 μg/ml) si U1 (continut estimat: 0,125 μg/ml) prin intermediul dilutiei succesive (1+1) cu amestecul (pct. 4.5).
7. Procedura de testare
7.1. Inocularea mediului de testare
Se inoculeaza mediul de testare (pct. 4.1) cu suspensie bacteriana (pct. 3.2) la aproximativ 500C. Prin teste preliminare pe placi cu mediu (pct. 4.1) se determina cantitatea de suspensie bacteriana necesara pentru a induce cele mai mari si mai clare zone de inhibitie, cu concentratii variate de virginiamicina.
7.2. Prepararea placilor
Difuzia pe agar este efectuata pe placi cu 4 concentratii ale solutiei standard (S8, S4, S2 si S1) si cele patru concentratii ale solutiei de testare (U8, U4, U2 si U1). Aceste 4 concentratii de extract si de standard trebuie neaparat sa fie plasate in fiecare placa. In acest scop, se selecteaza placi destul de mari pentru a permite realizarea a cel putin 8 godeuri cu diametrul de 10 pana la 13 mm si de cel putin 30 mm intre centre, ce trebuie realizate in mediu de agar. Testul poate fi efectuat pe placi ce constau din placi plate de sticla echipate cu un inel perfectat la nivel, din aluminiu sau plastic, cu diametrul de 200mm si inalt de 20 mm.
Se toarna in placi o cantitate de mediu (pct. 4.1), se inoculeaza ca la pct. 7.1., pentru a se obtine o grosime de aproximativ 2 mm (60 ml pentru o placa cu diametru de 200 mm). Se lasa sa se fixeze la o pozitie de nivel, se realizeaza godeurile si se plaseaza in acestea volume masurate cu exactitate de testare si din solutii standard (intre 0,1 si 0,15 ml per gaura, in conformitate cu diametrul). Se replica fiecare concentratie de cel putin patru ori, astfel incat fiecare determinare sa fie supusa unei evaluari a 32 de zone de inhibitie.
7.3. Incubare
Se incubeaza placile timp de 16 pana la 18 ore la 30 ± 20C.
8. EVALUARE
Se masoara diametrul zonelor de inhibitie cu o aproximatie de 0,1 mm. Se inregistreaza masuratorile medii pentru fiecare concentratie pe hartie grafica semi-logaritmica, relevand logaritmul concentratiilor in legatura cu diametrele zonelor de inhibitie. Se schiteaza liniile cele mai potrivite, atat ale solutiei standard cat si ale extractului. Se determina punctul "cel mai potrivit" pentru nivelul standard cel mai scazut (SL) utilizand formula:
a) SL
![]()
Se determina punctul "cel mai potrivit" pentru nivelul standard cel mai inalt (SH) utilizand formula:
b) SH = ![]()
Se calculeaza in mod similar punctele "cele mai potrivite" pentru nivelul cel mai scazut (UL) al extractului si nivelul cel mai inalt al extractului, inlocuind U1, U2, U4 si U8 pentru S1, S2, S4 si S8 in formula anterioara.
Se inregistreaza valorile calculate SL si SH pe aceeasi hartie grafica si acestea se unesc, pentru a da linia "cea mai potrivita" pentru solutia standard. Se inregistreaza, in mod similar, UL si UH si acestea se unesc, pentru a da linia "cea mai potrivita" pentru extract.
Liniile trebuie sa fie paralele in absenta oricarei interferente. Din motive practice, liniile pot fi considerate paralele, daca valorile (SH - SL) si (UH - UL) nu difera cu mai mult de 10% din valoarea medie a acestora.
Daca liniile sunt estimate a nu fi paralele fie u1 si s1 sau u8 si s8 pot fi ignorate si SL, SH, UL si UH calculate, utilizand formula alternativa, pentru a da liniile alternative "cele mai potrivite":
a )
SL 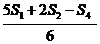 sau SL
sau SL ![]()
b )
SH 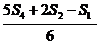 sau SH
sau SH ![]()
si in mod similar pentru UL si UH. Trebuie sa fie indeplinite aceleasi criterii de paralelism. Trebuie sa fie notat in raportul final faptul ca rezultatul a fost calculat pornindu-se de la trei niveluri.
Atunci cand liniile sunt considerate ca fiind paralele, se calculeaza logaritmul activitatii relative (log A) prin intermediul uneia din urmatoarele formule, depinzand daca au fost utilizate trei sau patru niveluri pentru evaluarea paralelismului.
Pentru patru niveluri
c) Log A ![]()
Pentru trei niveluri
d) Log A ![]()
sau
d )
Log A ![]()
Activitatea extractului de proba activitatea standardului relevant x A
(U8 = S8 x A)
Daca se constata ca activitatea relativa este in afara intervalului 0,5 pana la 2,0, atunci se repeta testarea, efectuandu-se ajustarile corespunzatoare la concentratiile extractului sau, daca acest lucru nu este posibil, la solutiile standard. Atunci cand activitatea relativa nu poate fi adusa in intervalul solicitat, orice rezultat obtinut trebuie sa fie considerat ca aproximativ si acesta trebuie sa fie notat in raportul final.
Atunci cand liniile sunt considerate ca nefiind paralele, se repeta determinarea. Daca paralelismul nu este inca atins, determinare trebuie sa fie considerata ca nesatisfacatoare.
Se exprima rezultatul in miligrame de virginiamicina per kilogram de furaj.
9. REPETABILITATE
Diferenta dintre rezultatele a doua determinari paralele, efectuate pe aceeasi proba, de acelasi analist, trebuie sa fie de maximum:
2 mg/kg, in valoare absoluta, pentru un continut de virginiamicina de pana la 10 mg/kg,
20% in relatie cu cea mai mare valoare pentru un continut de 10 pana la 25 mg/kg,
5 mg/kg, in valoare absoluta, pentru un continut de 25 pana la 50 mg/kg,
10% in relatie cu cea mai mare valoare pentru un continut de peste 50 mg/kg.
(1) 1 mg de virginiamicina
este echivalent cu 1000 de unitati
(a) Pot fi utilizate alte metode, cu conditia sa fi fost stabilit ca acestea dau suspensii bacteriene similare.
(b) Poate fi utilizat orice mediu de cultura comercial de compozitie similara si care da aceleasi rezultate