
|
|
|
Reactiile Ag - Ac reprezinta consecinta proprietatii esentiale ale Ig-lor, respectiv a capacitatii de a recunoaste epitopii care au indus sinteza lor, de a reactiona cu acestia si de a produce o serie de manifestari evidente (precipitare, aglutinare, neutralizare etc.) (fig. 41).
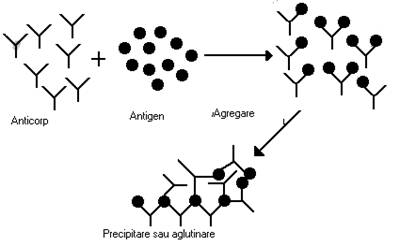
Fig. 41. Schema unei reactii Ag-Ac si a efectelor sale.
Reactia dintre un antigen (Ag) si un anticorp (Ac) presupune legarea D.A. al antigenului (epitop) de situsul de combinare al anticorpului (paratop). Aceasta legare, dependenta de complementaritatea sterica dintre antigen si anticorp, are loc cu participarea unor forte de legatura necovalente (forte van der Waals, forte electrostatice, legaturi de hidrogen si legaturi hidrofobe) care asigura, intr-un anumit grad eliminarea apei si stabilitatea complexului antigen-anticorp. Toate aceste forte actioneaza cu atat mai intens, cu cat antigenul se potriveste mai bine din punct de vedere steric si deci se apropie mai mult de situsul de combinare al anticorpului.
O caracteristica generala a reactiei antigen-anticorp o reprezinta specificitatea sa, adica, proprietatea anticorpului de a "discrimina" antigenul omolog de un alt antigen. Specificitatea anticorpilor nu este insa absoluta. In anumite cazuri pot avea loc reactii incrucisate, adica exista posibilitatea ca un antigen sa reactioneze cu un anticorp indus fata de un alt antigen.
Reactiile Ag - Ac au fost mult studiate datorita aplicabilitatii lor practice, decurgand din marea lor specificitate. Cele mai multe date au fost obtinute cu ajutorul haptenelor, care nu sunt imunogene, au uneori un singur D.A., dar au proprietatea de a lega specific Ac.
Principiile care stau la baza reactiilor Ag - Ac sunt cele ale oricarei reactii biomoleculare, astfel ca aceste reactii au fost abordate experimental si sunt descrise ca o interactiune de tip enzima - substrat sau hormon - receptor celular. Astfel, au fost evidentiate anumite particularitati ale reactiilor Ag - Ac:
1) Reactiile Ag - Ac sunt in principiu totdeauna reversibile; Ac nu altereaza ireversibil Ag, asa cum o enzima modifica substratul specific;
2) Reactiile Ag - Ac pot fi considerate ca prototip al interactiilor macromoleculare; experimental, poate fi obtinut orice tip de Ac, cu specificitate fata de substanta de interes;
3) Dificultatea majora in comparatie cu enzimele, decurge din heterogenitatea Ac-lor (chiar Ag-le inalt purificate contin urme de impuritati), totusi imunoserurile produse pe animale sunt inca mult folosite in practica; acest dezavantaj poate fi evitat prin utilizarea anticorpilor monoclonali.
Tipuri de reactii Ag-Ac
1. Reactii primare: interactiuni initiale, de legare a Ag-lor de Ac, independent de fenomenele biologice si biochimice care pot decurge din producerea lor. In vivo, interactiunile primare sunt suficiente pentru neutralizarea toxinelor, inhibarea infectiozitatii unor virusuri sau bacterii, declansarea reactiilor anafilactice. In vitro, acestea pot fi evidentiate si masurate prin: dializa la echilibru, extinctia fluorescentei, imunofluorescenta, RIA. Aceste metode evalueaza simultan cantitatile de Ag si Ac, dar si afinitatea anticorpilor pentru Ag.
2. Reactii secundare: ilustreaza fenomenele care pot aparea in vitro, ca o consecinta directa, dar nu obligatorie a interactiunilor primare. Evidentiate prin reactii de: precipitare, aglutinare, neutralizare, RFC (citoliza imuna, imunofagocitoza, chimiotactism);
3. Reactii tertiare: exteriorizeaza consecintele biologice ale reactiilor primare in vivo. Au un caracter mai complex decat reactiile secundare, pentru ca depind si de factorii proprii organismului (in plus de celelalte variabile: concentratia proteinelor S.C., prezenta unor celule secretoare de mediatori, afinitatea receptorilor de Ag).
= Efect: protector (imobilizarea bacteriilor, neutralizarea infectiozitatii virusurilor) sau nociv (soc anafilactic, anafilaxie cutanata, reactii tip Arthus, hemoliza intravasculara).
Reactia Ag-Ac depinde de interactiunea necovalenta dintre paratopii si epitopii corespunzatori (fig. 43). Marimea energiei de legare, cunoscuta sub denumirea de afinitate a Ac-lui pentru Ag omolog este determinata de gradul lor de potrivire stereochimica. Formarea complexului Ag-Ac are loc in doua etape:
1). Etapa initiala, foarte specifica, bazata pe complementaritatea structurala, adaptarea tridimensionala a celor 2 reactanti: determinantul antigenic si situsul de combinare al anticorpului. Aceasta complementaritate, considerata de tip "lacat-cheie", in care cheia (determinantul antigenic) se potriveste exact in lacat (situsul combinativ al anticorpului), in conceptia actuala, depinde de complementaritatea sterica si electrochimica a gruparilor.
2). Etapa a-II-a. Diferite forte intermoleculare intra in actiune dupa adaptarea stransa Ag-Ac, consolidand aceasta legatura. Desi complementaritatea stricta nu este absolut necesara, un grad mare de complementaritate si zone de contact intinse, furnizeaza forte de atractie intermoleculara si legaturi multiple, mai stabile, depasind fortele de repulsie. Fortele de atractie care participa la reactia Ag-Ac sunt slabe, in comparatie cu legaturile covalente*.
Datorita caracterului lor, aceste forte (forte electrostatice, legaturi de H, legaturi van der Waals, forte hidrofobe) sunt eficiente numai daca sunt multiple, deci energia lor globala va depinde de numarul de legaturi, care va fi cu atat mai mare, cu cat gradul de complementaritate sterica va fi mai mare. Faptul ca aceste forte sunt nespecifice, face ca reactia Ag-Ac sa fie reversibila, ceea ce conduce la ideea ca specificitatea este conditionata de complementaritate.
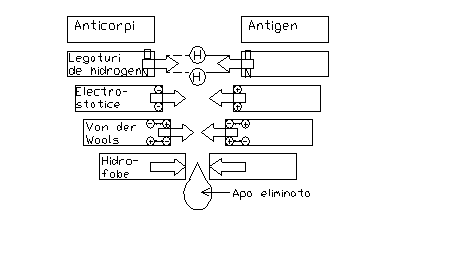
Fig. Reprezentarea schematica a fortelor de atractie intermoleculare, implicate in legarea antigenului de anticorp (dupa Roitt si colab., 1985, citati de Zarnea, 1990).
Legatura dintre doi atomi este cu atat mai puternica cu cat acestia sunt mai apropiati unul de altul. Distanta dintre doi atomi de hidrogen legati covalent este de 0,74 Ả, pe cand distanta dintre doi atomi de hidrogen legati cu forte van der Waals este de 1,2 Ả. Fortele slabe de legare sunt eficiente numai daca sunt multiple. Energia de legare a fortelor este data de numarul lor, iar numarul lor depinde de complementaritatea sterica dintre antigen si anticorp. Aceasta implica o anumita aliniere a atomilor sau a gruparilor reactive ale situsului de combinare al anticorpului, in raport cu atomii sau gruparile complementare ale antigenului, asa incat unei grupari chimice reactive proeminente sau unei sarcini pozitive pe suprafata unei molecule sa-i corespunda o concavitate sau o sarcina negativa pe cealalta. De aceea, orice diminuare a gradului de complementaritate determina o crestere a fortelor de repulsie si o diminuare a celor de atractie, deci o scadere a energiei globale de legare.
Fortele de legare dintre antigen si anticorp sunt nespecifice, iar natura lor permite ca unirea antigenului cu anticorpul sa fie reversibila. De aceea, specificitatea reactiei antigen - anticorp este conditionata exclusiv de complementaritatea lor.
Particularitatile reactiilor Ag-Ac sunt:
Afinitatea - masoara forta de legare dintre un epitop si paratopul corespunzator, respectiv rezultanta fortelor de atractie si de repulsie dintre cele doua molecule ale complexului Ag-Ac, care depinde de proprietatile fizico-chimice ale moleculelor respective (fig. 45).
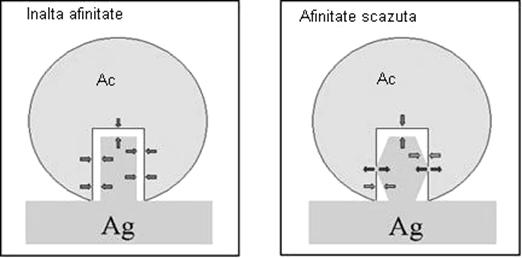
Fig. 45. Schema care ilustreaza capacitatea de afinitate inalta/scazuta dintre un determinant antigenic si situsul de combinare al unui anticorp (www.med.sc.edu)
Au fost imaginate mai multe tehnici de apreciere a afinitatii S.C. al Ac-lor, cea mai simpla tehnica prin care s-a apreciat afinitatea situsului activ al anticorpului este dializa la echilibru. Aceasta tehnica se bazeaza pe proprietatea haptenelor mici, monovalente (neprecipitante), de a traversa membranele de dializa care retin anticorpii si complexele haptena-anticorp. In acest scop, solutia concentrata de Ac este repartizata intr-un sac de dializa care este imersat intr-un volum cunoscut de solutie tampon, pH- 7,4, care contine o concentratie cunoscuta a haptenei. Haptena libera difuzeaza prin membrana, in compartimentul care contine Ac. La echilibru, se masoara concentratia haptenei libere de la exterior (care este egala cu cea a haptenei libere din interiorul sacului) si concentratia haptenei legata de Ac (concentratia totala a haptenei din sacul de dializa este mai mare deoarece o parte din ea este legata de Ac).
Concentratia de haptena legata se poate stabili ca fiind diferenta dintre cantitatea de haptena libera adaugata la inceput si cantitatea de haptena libera din cele doua compartimente ale sistemului de dializa. Aceste valori la echilibru depind de concentratia si afinitatea Ac. Constante de afinitate (Ka) se calculeaza dupa formula:
Ka=Kas/Kdis=[Ag]-[Ac]/ [Ag]x[Ac], in care:
Ka= constanta de afinitate
Kas= constanta de asociere
Kdis= constanta de disociere
[Ag]-[Ac]= concentratia complexului imun
[Ag]= concentratia determinatilor antigenici liberi
[Ac]= concentratia situsurilor de legare libere ale Ac
Relatia exprima cantitativ tendinta SC si a haptenei (Ag) de a forma un complex stabil, mai exact afinitatea situsului pentru haptena respectiva. Ka este direct proportionala cu afinitatea Ac si invers proportionala cu cantitatea de haptena necesara pentru a ocupa jumatate din situsurile combinative ale Ac.
Aviditatea - este definita ca o proprietate ce caracterizeaza energia medie a interactiunii de legare a unui Ag avand D.A. multipli si diferiti, cu S. C. heterogene ale Ac-lor indusi de acestia. Asadar, spre deosebire de afinitate care furnizeaza date privind natura fizico-chimica a reactiei Ag-Ac, aviditatea este semnificativa pentru Ag naturale sau multivalente.
Aviditatea depinde de afinitatea fiecarui S.C. al Ac-lor pentru D.A. diferiti si este in cazul Ag-lor si Ac-lor multivalenti, superioara sumei acestor afinitati (fig. 46).
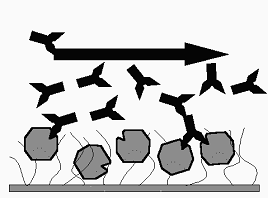
Fig. 46. Reprezentarea proprietatii de aviditate a anticorpilor
(www.home.hccnet.nl.htm)
S-a observat ca anticorpii dintr-un antiser imun, excluzand anticorpii monoclonali care sunt perfect omogeni, au o mare heterogenitate de afinitate. Aceasta observatie nu este considerata a fi surprinzatoare, deoarece chiar si in cazul unor substante simple, cum ar fi unele haptene, anticorpii pot fi dirijati fata de diferite regiuni ale moleculei. In cazul macromoleculelor naturale, numarul determinantilor antigenici este necunoscut aproape intotdeauna.
S-a demonstrat ca o legatura multivalenta intre Ag si Ac (aviditatea) este mult mai stabila decat o legatura monovalenta (aviditate intrinseca). Ex.: valoarea aviditatii in cazul legarii unui Ac monovalent (Fab) este de 104, la IgG (molecula bivalenta) - energia de legare creste de 103 ori, la IgM (decavalenta) - creste de 107 ori (valori arbitrare) (fig. 47).
Importanta determinarii afinitatii si aviditatii anticorpilor. Aceste proprietati
conditioneaza proprietatile lor fiziologice si imunopatologice. Ac cu afinitate mare sunt mai eficienti in numeroase reactii biologice: eliminarea imunitara a Ag-lor, protectia antibacteriana, neutralizarea virusurilor, hemoliza, lezarea membranelor. In imunopatologie: complexele Ag-Ac cu Ac cu afinitate mica, persista in circulatie, se depun, de ex., pe membrana bazala a glomerulului renal si determina insuficienta renala, pe cand cele care contin Ac cu afinitate mare sunt eliminate rapid.
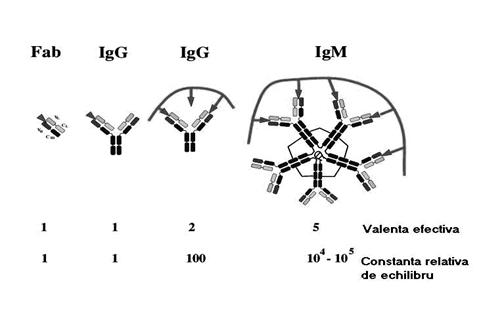
Fig. 47. Ilustrarea stabilitatii legaturilor multivalente (IgG, IgM), comparativ cea a legaturilor monovalente (1 Fab 1 S.C.) (dupa Roitt si colab., 2001).
Factorii care influenteaza asocierea Ag-Ac
Interactiunea fizica dintre cei 2 reactanti fiind rezultatul unui proces aleator, sansele ca reactia sa aiba loc pot fi marite de o serie de conditii: concentratia Ac-lor specifici, concentratia Ag-lor, clasa, subclasa Ig-lor, temperatura, pH-ul (reactia este insensibila in limitele 6,5 - 8,5), forta ionica - prezenta electrolitilor in mediu stabilizeaza reactia Ag-Ac, pentru ca influenteaza interactiunile electrostatice.
Sensibilitatea testelor imunologice. Diferitele reactii serologice difera prin conditiile de reactie, dar si prin sensibilitatea lor in detectarea unor cantitati minime de substante specifice. De ex., aglutinarea este mai sensibila decat precipitarea pentru ca particulele sau celulele relativ mari amplifica efectul vizibil, astfel ca antiserurile fata de bacterii sau hematii pot fi diluate de mii de ori. Diferentele de sensibilitate intre diferitele tipuri de reactii imunologice ar putea fi determinate de numarul de particule necesare pentru o reactie vizibila: 107 celule bacteriene, ceea ce ar corespunde la 109 molecule de Ag de suprafata (receptori membranari) si respectiv 6x1012 molecule de Ag solubile. Cunoasterea sensibilitatii diferitelor reactii este importanta in alegerea unei tehnici adecvate scopului urmarit. Efectul reactiilor Ag-Ac a putut fi amplificat si vizualizat sau masurat prin marcarea reactantilor imunologici cu fluorocromi, enzime sau radioizotopi, ceea ce a determinat o crestere semnificativa a sensibilitatii testelor de imunodiagnostic.
Reactiile Ag-Ac pot fi evidentiate calitativ si evaluate cantitativ in conditii de laborator, in scop de diagnostic, cercetare, identificare si clasificare a agentilor infectiosi (taxonomie).
Metodele cele mai utilizate in analiza imunologica se bazeaza pe reactia Ag-Ac primara si secundara utilizand procedee care imbina tehnici fizico-chimice (caracterizate prin precizie sacuratete) si tehnici imunologice (caracterizate prin sensibilitate si specificitate).
In scop de diagnostic, in general se cauta fie Ac, fie Ag in serul bolnavului sau in alte lichide biologice.
Serologia (studiul serului) poate fi aplicata practic in 2 directii principale:
- serodiagnostic: atunci cand se cunoaste Ag si se determina natura Ac, in scopul obtinerii de informatii cu privire la susceptibilitatea unui individ fata de o anumita boala, date privind o infectie trecuta sau prezenta (serodiagnostic), eficacitatea unei vaccinari.
- serotipizare atunci cand se cunoaste Ac si se determina natura Ag necunoscut sau pentru urmarirea modului in care se distribuie un Ag cunoscut.
In acest scop se prepara seturi de seruri imune de diagnostic, destinate cunoasterii microorganismelor patogene (aceste seruri pot fi pastrate timp indelungat sub forma liofilizata sau la temperaturi scazute).
In functie de natura Ag si metodele aplicate pentru vizualizarea lor, reactiile Ag- Ac pot fi grupate in:
A. Reactii de aglutinare - care evidentiaza Ag corpusculare;
B. Reactii de precipitare - care evidentiaza Ag solubile;
C. Reactii de neutralizare - care evidentiaza Ag reprezentate de toxine sau virusuri;
D. Reactii de fixare a complementului (RFC care conduc la citoliza) - care evidentiaza Ag reprezentate de celule straine sau evidentiaza o reactie Ag-Ac lipsita de o manifestare vizibila, prin adaugarea de complement si a unui al doilea sistem Ag-Ac, reprezentat de hematii de oaie si Ac anti-hematii (sistem hemolitic); absenta hemolizei / hemoliza indica o reactie +/-.
E. Reactii care folosesc reactivi marcati (cu fluorocromi, citometrie in flux, enzime, izotopi radioactivi).