
|
|
|
Infectiile nosocomiale
Germenii responsabili de producerea infectiilor nosocomiale sunt de regula, germeni oportunisti, multirezistenti, cu patogenitate crescuta; mai sunt denumiti si germeni de spital; ei sunt proprii fiecarui serviciu chirurgical, atat ca incidenta, dar mai ales ca sensibilitate la antibiotice.In cursul spitalizarii flora normala a organismului sufera modificari importante sub influenta unor factori ce tin de terenul bolnavului, antibioterapia efectuata anterior etc.
Dupa circa 7 zile de spitalizare 50% din pacienti isi modifica flora normala, fiind colonizati cu germeni de spital; in perioada postoperatorie imediata 75% dintre pacienti sunt colonizati cu germeni de spital.
Colonizarea orofaringelui se produce in
legatura cu: gravitatea bolii pentru care se interneaza bolnavul, afectiunii
asociate debilitante (alcoolismul cronic, diabetul), varsta inaintata,
interntia chirurgicala de amploare si antibioterapia prelungita peste 3-5 zile.
Flora intestinala la bolnavul
spitalizat este modificata prin: modificarea peristaltismului, staza
intestinala, hipoaciditatea gastrica; prezenta ulcerului gastric, a H.D.S., pot
fi la originea unei inmultiri bacteriene rapide.
Postul prelungit, alimentatia enterala
artificiala, terapia imunosupresiva, antibioterapia prelungita sunt factori
exogeni care modifica flora intestinala.
Dezechilibrul florei intestinale
permite imtarea si multiplicarea rapida a speciilor potential patogene care in
anumite situatii critice sunt responsabile de manifestari clinice mergand de la
o simpla diaree pana la un
sindrom septicemie.
Flora cutanata este dependenta la
bolnavul spitalizat de diferiti factori: pH, factori nutritionali, des-cuamare,
prezenta solutiilor de continuitate.
Utilizarea antisepticelor si
antibioticelor local favorizeaza colonizarea cu germeni oportunisti.
Antibioterapia prelungita pe cale generala este un factor determinant, alaturi de durata de spitalizare prelungita, a aparitiei suselor rezistente.
Flora vaginala este modificata de
antibioterapia prelungita peste 3 zile, favorizand in acelasi timp colonizarea
cu germeni rezistenti. O interntie chirurgicala pe aparatul genital feminin
poate aa aceleasi consecinte.
Bacilii gram-negativi aerobi - sunt
responsabili. de producerea a peste 50% din infectiile
nosocomiale. Rezervorul lor este cel mai frecnt omul (pacientul), insa se
gasesc si in mediul inconjurator.
Bacilii gram-negativi produc
infectiile urinare, infectiile intraperitoneale (peritonitele postoperatorii),
dar si infectiile plagilor chirurgicale, pneumonii, bacte-riemii primare sau
secundare.
Se gasesc printre germenii care
contamineaza aparatele medicale sau lichidele de perfuzie.
Sunt de obicei germeni cu o puternica
patoge-nitate si evolutie spre multirezistenta.Intre germenii gram-negativi
aerobi cel mai frecnt intalnit este E. coli, mai mult de jumatate din infectiile
nosocomiale cu germeni gram-negativi fiind produse de acest germen. Cel mai
adesea isi are originea in tubul digestiv, ca de altfel si ceilalti aerobi
gram-negativi responsabili de producerea infectiilor nosocomiale: Enterobacter,
Piocianic, Proteus, Citrobacter, Klebsiella.
Stafilococul produce 15-21% din
infectiile de spital. Omul este principalul rezervor pentru stafilo-coc, ca si
pentru alte bacterii gram-poziti (streptococul).
Se intalneste cel mai frecnt intre agentii
in-fectiosi cauzali pentru infectiile de plaga chirurgicala sau alte infectii
cutanate de spital.
Stafilococul epidermidis este un
agent important responsabil de bacteriemia de cateter intranos sau de infectia
materialului protetic chirurgical, ortopedic sau cardiovascular.
Streptococul este germenul intalnit in 5-l0% din infectiile
nosocomiale. Cel mai frecnt intalnit este Enterococul (infectii urinare,
infectiile plagilor). Streptococul din grupul A si pneumococul sunt rar
implicati.
Germenii anaerobi gram-pozitivi
(Peptostrepto-cocul) sau gram-negativi (Clostridium difficile, Bacte-roides
fragilis) sunt intalniti mai ales in peritonitele postoperatorii, dar si in
infectiile nosocomiale pulmonare si de parti moi. Sunt intalniti in 2-5% din
cazuri. Sunt germeni puternic patogeni si multirezis-tenti. Punerea lor in
evidenta intampina dificultati (mor de obicei in timpul recoltarii sau al
transportului catre laborator). Din acest punct de dere frotiul din produsul
patologic este mult mai util.
Ciupercile sunt responsabile de
producerea a 2-3% din infectiile
nosocomiale. Infectia se produce cand se utilizeaza antibioterapia prelungita.
Chimio-terapia prelungita, nutritia parenterala
sunt alti factori de risc mai ales pentru Candida. Infectiile cu ciuperci le
intalnim de asemenea la pacientii neutro-penici, cu imunodeficienta sera.
Virusurile produc in jur de 5% din infectiile
nosocomiale, omul fiind unicul rezervor: virusurile respiratorii, rubeolic,
rotavirusuri, virusul hepatitei B, HIV.
Infectiile nosocomiale sunt de obicei polimicro-bine, infectia monomicrobiana fiind foarte rara (de obicei infectiile plagilor operatorii cu stafilococ).In toate infectiile nosocomiale predomina bacteriile multirezistente. Pe de alta parte exista variatii ale florei din infectiile nosocomiale specifice diferitelor areale geografice (variatii nationale), iar in interiorul acestora fiecare spital are o ecologie bacte-riana locala proprie atat in termeni de repartitie a speciilor bacteriene, dar mai ales de rezistenta bacteriana. Studiul profilului bacteriologic al fiecarui spital ne indica prezenta unui anumit lot de germeni care au fost denumiti "germeni aflati in supraghere', sau "germeni de atentie' proprii fiecarui serviciu spitalicesc si definiti ca avand o puternica implicare, putere patogena si potential de evolutie spre multirezistenta.
Diagnostic
bacteriologic
Studiul bacteriologic al infectiilor
nosocomiale este dificil datorita polimorfismului bacterian si exigentelor de
cultura ale anumitor bacterii. Un studiu bacteriologic complet este utopic,
costisitor, posibil fals, deci inutil. Microbiolo-gul trebuie sa posede
informatiile clinice care ii vor permite sa adapteze metodologia si sa
interpreteze fiecare din etapele diagnosticului bacteriologic.
Interpretarea rezultatelor trebuie sa
tina cont de capcanele existente in fiecare etapa a diagnosticului
bacteriologic:
- examenul direct - pe
frotiu colorat gram poate fi practicat totdeauna; negativitatea sau
pozitivita-tea sa sunt informati. Existenta unui polimorfism microbian
orienteaza spre existenta unei flore mixte - aeroba si anaeroba; aceasta
informatie importanta va permite reorientarea rezultatelor culturilor anaerobe
negati;
- interesul culturilor trebuie sa fie relativizat datorita dificultatilor de
insamantare si crestere a germenilor anaerobi. De obicei anaerobii mor in
timpul recoltarii si a transportului catre laborator;
- posibilitatea contaminarii probelor prelevate creste riscul de relativitate
al culturilor bacteriene (calitatea prelevarii este primordiala);
- identificarea si studiul sensibilitatii la antibiotice cunosc aceleasi limite
pentru dirse specii microbiene care traiesc adesea in simbioza.
Din aceste motive interpretarea
rezultatelor bacteriologice trebuie facuta intr-o maniera critica. Pentru
majoritatea autorilor cautarea anaerobilor trebuie sa fie selectiva si limitata
la Bacteroides fragilis, singura bacterie anaeroba potential multirezistenta.
In rezumat, in cursul infectiilor nosocomiale rezultatele bacteriologice sunt
incomplete, sosesc tarziu si va fi periculos, in consecinta, de a limita
spectrul antibiotic la germenii indentificati.
Examenul bacteriologic este mai util,
in general, in urmarirea evolutiei unei infectii nosocomiale. Daca examenele
bacteriologice repetate nu se negatiaza sunt posibile urmatoarele situatii:
- infectia nosocomiala isi continua evolutia;
- selectia unor surse
bacteriene rezistente;
- aparitia unei recidive a infectiei;
- supraadaugarea la infectia nosocomiala cunoscuta a unei alte infectii.
Pseudomonas Aeruginosa
Infectiile cu Pseudomonas aeruginosa sunt o cauza frecventa de morbiditate si mortalitate a pacientilor spitalizati. Diagnosticul infectiilor este microbiologic, iar tratamentul a devenit complicat datorita rezistentei (intrinsenci si dobandite) a acestei bacterii si de aceea foarte multe aspecte ale tratamentului raman controversate.
Pseudomonas aeruginosa, diagnostic, tratament
Medicii noului mileniu trebuie sa considere Pseudomonas aeruginosa printre cei mai virulenti patogeni implicati in urmatoarele sindroame majore:
1) pneumonia la pacientii ventilati mecanic si pacientii cu neutropenie;
2) exacerbarea fibrozei chistice;
3) bacteriemie primara la pacientii cu neutropenie si infectati HIV cu CD4< 50 celule/mm;
4) endocardita datorita folosirii medicamentelor i.v. si in endocardita precoce dupa protezare valvulara mitrala sau aortica;
5) otita externa maligna la diabetici;
6) meningita nozocomiala si abcesul cerebral dupa interventii chirurgicale si fracturi ale bazei craniului;
7) endoftalmia secundara traumatismelor oculare, interventii intraoculare si contaminarea artificiala a cristalinului;
8) osteomielita - complicatie a traumatismelor si interventiilor ortopedice de protezare;
9) infectii cutanate ce complica arsurile severe.
Identitatea biologica a genului Pseudomonas s-a schimbat dramatic in ultimii ani, datorita trecerii de la clasificarea bazata pe omologia ARN -ului, la reclasificarea pe baza proprietatilor genotipice (filogenetice ), ilustrata in 'Bergey's Manual of Systematic Bacteriology'. Noua clasificare se refera la urmatoarele modificari:
organismele din grupul II fiind suficient de diferite de cele din grupul I constituie genul Burcholderia, din care fac parte urmatoarele specii: B.cepacia, B.mallei, B.pseudomallei, B.picketti,.B.gladioli, B. caryophylli si B.solanacearum.
organismele din grupul III sunt clasificate intr-o noua familie Comamonadaceae, care include genurile Comamonas si Acidivorax.
desi organismele din grupul IV prezinta semnificative diferente genetice fata de grupul I, ele apartin genului Pseudomonas.
Xanthomonas maltophilia a fost atribuit genului Stenotrophomonas.
Pseudomonas aeruginosa este frecvent
raspandit in natura, fiind izolat din apa, sol si plante,
fructe si vegetale, de la om si animale. Necesitatile
nutritionale minime, toleranat a la o mare diversitate de condit
ii fizice, abilitatea de a creste in apa distilata, contaminarea
solutiilor dezinfectante, sapunurilor, lichidului de dializa,
picaturilor oculare, instrumentarului etc. fac din Pseudomonas aeruginosa
un important patogen nosocomial.
Ps.
aeruginosa este uneori gasit ca parte a microflorei umane la indivizii
sanatosi, prin colonizarea perineului, axilei sau stomacului
dupa ingestia organismului.
Spitalizarea duce la o crestere
a ratei de purtatori, tegumentul la pacientii cu arsuri, tractul
respirator inferior la pacient ii intubati, pacientii care
primesc chemoterapie sau oricare alt virtual loc la pacientii tratati
cu antibiotice. Este agent etiologic al infectiilor cu diverse localizari
ca pneumonia, infectiile de tract urinar, bacteriemia, endocardita, sistem
musculoscheletal, ochi, urechi, sistem nervos central etc.
Strategii in diagnosticul de laborator al infectiilor cu Pseudomonas spp
Diagnosticul infectiilor este microbiologic. Rezultatul investigatiilor de laborator depinde de calitatea recoltarii, de aceea este imperioasa respectarea conditiilor standard de recoltare si transport pentru toate produsele patologice.
Prelucrarea produselor patologice in
laborator se face in functie de procedurile specifice pentru fiecare tip
de produs patologic, conform standardelor.
Examenul microscopic direct - frotiul
din produsul patologic-, colorat Gram evidentiaza bacili Gram
negativi (vezi imaginea nr.1), drepti sau usor incurbati 0,5 -
0,8 x 1,5- 3,0 microni metru, asezati izolat, in perechi sau scurte
lanturi, intra si perileucocitari.
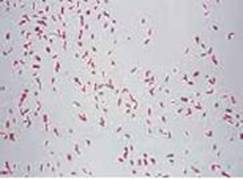
Imag.1 Pseudomonas SPP frotiu Gram Imag.2
Daca materialul din focarul de infec-
tie se caracterizeaza prin abundenta celulelor inflamatorii
si prezenta bacililor Gram negativi, materialul de contaminare se
caracterizeaza prin prezent a celulelor epiteliale, scuamoase
eventual incarcate cu numeroase bacterii de contaminare. Din flacoanele de
hemocultura pozitive se fac frotiuri Gram care evidentiaza
prezenta bacililor Gram negativi.
Rezultatul examenului microscopic
direct este un diagnostic rapid care se trimite in sectie, sub forma unui
'rezultat preliminar', avand rolul de a informa clinicianul asupra
calitat ii produsului patologic recoltat, identificarii
microscopice a bacteriei care a produs infectia, fiind primul criteriu
empiric pentru ghidarea antibioterapiei in cazul infectiei.
Cultivare si izolare
Pseudomonas spp. sunt bacterii nepretent ioase, de aceea cresc cu usurinta pe medii uzuale, cu un PH neutru. Geloza sange 5% si chocolate agar se folosesc pentru insamantarea produselor patologice ca LCR, lichid articular, lichid dializa peritoneala, in care nu se anticipa o flora mixta. Pentru izolarea Pseudomonas spp. din produsele patologice cu flora mixta se folosec medii selective, ca de exemplu MacConkey (exceptie face P. vesicularis), mediu cu cetrimide sau eosin-methylen blue agar.
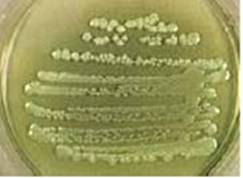
Imag.3 Pseudomonas Aeruginosa, aspectul
Coloniilor pe agar
Incubare
Pseudomonas spp. creste in
conditii aerobe de incubare, la temperatura de 35-37 grade, unele specii
cresc greu la aceasta temperatura si placile se
reincubeaza la 30 grade sau la temparatura camerei pentru inca
doua zile. Capacitatea Ps.aeruginosa de a creste la 42 grade il
diferentiaza de Ps. fluorescens si Ps. Putida.
Identificare:
a) pe baza caracterelor de cultura:
b)
Ps. aeruginosa, Ps. fluorescens, Ps. Putida: Izolatele de Ps. aeruginosa sunt usor de recunoscut pe baza aspectului coloniei, producerii de pigment difuzibil, a mirosului caracteristic de 'flori de tei'. Coloniile sunt mari, usor convexe, cu margini neregulate, cu luciu metalic, pe geloza sange coloniile sunt hemolitice. Pseudomonas aeruginosa este capabil sa produca un numar de pigmenti solubili, pioverdina (galben - verde fluorescent, deasemenea produs de P.fluorescens si P.putida) difuzibil in mediu, piorubina (culoare rosie), piomelanina (culoare maro). Piocinina, pigmentul albastru, nu este produs de nici o alta specie decat de Ps.aeruginosa. Ocazional tulpini de Ps.aeruginosa nu produc pigment sau produc un pigment galben - verde care nu-l diferentiaza de Ps.fluorescens, Ps.putida. Colonii nepigmentate de Ps.aeruginosa, mucoide pot fi izolate din secretiile traheale ale pacientilor cu fibroza chistica.
Ps.stutzeri: Grupul Ps.stutzeri este alcatuit din urma toarele trei organisme: Ps.stutzeri, CDC grup Vb -3, si Ps. mendocina. Ps. stutzeri formeaza colonii uscate, zbarcite, aderente de agar, maron. Insa nu toate tulpinile de Ps. stuzeri prezinta aceste aspecte, de aceea sunt greu de diferentiat de alte pseudomonade.
Ps.alcaligenes, Ps.pseudoalcaligenes, Pseudomonas spp.CDC grup 1: Coloniile nu prezinta aspecte particulare.
Ps.diminuta si Ps.vesicularis: Coloniile de Ps.diminuta sunt albe, in timp ce multe tulpini de Ps.vesicularis produc un pigment orange intracelular.
c) identificarea biochimica trebuie sa respecte urmatoarele conditii:
inocul din cultura pura, proaspata de 18 - 24 ore.
oxidaza si catalaza pentru toti bacilii Gram negativi inainte de a selecta testele de identificare . Incepand din anul 1896 eforturile de a gasi un substrat biochimic pentru o diferentiere corecta si rapida, la nivel de specie, a tulpinilor izolate au fost emarcabile. Toate sistemele comerciale de identificare se bazeaza pe una sau mai multe combinatii de tehnologii: reac- tia PH -ului, care necesita 15-24 ore de incubare, reactia enzimatica (2-4 ore) ,utilizarea sursei de carbon, detectarea cresterii bacteriene in prezenta substratului, detectarea acizilor grasi prin chromatografie, reactii care sunt influentate de marimea inoculului, timpul de incubare si temperatura reactiei. Sistemele de identificare a bacililor Gram negativi non- fermentativi, prezinta o acuratete mai mare de 90%, atat in cazul kiturilor manuale: API, IDTri-Panel etc. sau automate: PDPhoenix, Vitek. Controlul de calitate care verifica fiecare reactiv si procedura, se recomanda cu tulpini specifice ATC (American Type Culture Collection).
c) testarea
sensibiltatii la antibiotice prin metoda difuzimetrica (cea mai
frecvent folosita) sau determinarea concentratiei minime inhibitorii
(CMI) pe care multe laboratoare o practica ca metoda
suplimentara este o etapa obligatorie in diagnosticul
infectiilor cu Pseudomonas spp, datorita multiplelor mecanisme de
rezistenta dobandita enzimatic si neenzimatic,
efectuata cu scopul de a ajuta decizia terapeutica. Pseudomonas
aeruginosa este un patogen nozocomial cu inalta rezistenta la
antibiotice.
In 'Performance Standards for
Antimicrobial Testing 2004 si 2005', se recomanda pentru
testarea sensibilitatii Pseudomonas aeruginosa, prin metoda
difuzimetrica, urma toarele:
Mecanisme de rezistenta
Pseudomonas aeruginosa este o
bacterie cu notorietate pentru rezistenta sa (rezistenta
intrinseca, rezistenta dobandita) la foarte multe
antibiotice. Mecanismele implicate in rezistenta sunt impermeabilitatea,
efluxul, producerea enzimelor inactivatoare sau modificarea tintelor ceea
ce face sa fie mai putin sensibil la antibiotice in comparat ie cu
alti BGN (e.g. ampicilina, multe cefalosporine si macrolide).
Biofilmul care protejeaza bacteria contribuie de asemenea la
rezistenta lui la antibiotice.
Pe langa rezistenta
intrinseca, Ps.aeruginosa are abilitatea, prin schimbari mutat
ionale sau achizitie de material genetic, de a dezvolta
rezistenta la fiecare antibiotic antipseudomonas. Beta-lactamaza AmpC
este capabila sa degradeze beta-lactami ca de exemplu piperacilina,
caftazidim cand mutatia consta in producerea unei mari
cantitati de enzima.
Inhibitorii de beta-lactamaza, e.g.
tazobactam, sulbactam de sodiu si clavulanat nu sunt activi pe beta-lactamaza
AmpC. Rezistenta la gentamicina si tobramicina nu este intotdeauna
inso- tita de rezistenta la amikacina. Daca se
alege un antibiotic sensibil la tulpina testata succesul terapeutic nu
este asigurat datorita inclinatiei Ps. aeruginosa de a dezvolta
rezistenta in timpul terapiei.
Antibioticele pentru care o
singura mutatie este suficienta sa compromita
activitatea includ imipenemul si fluoroquinolonele, (e.g.
rezistenta intre 25%-50% la tulpinile izolate de la pacietii
care au primit monoterapie cu imipenemul si 33% -58% la pacientii
care au primit monoterapie cu ciprofloxacin).
In tarile mediteraneene
Ps.aeruginosa panrezistent, izolat din produsele patologice, produce o
metalo-betalactamaza VIM care, ca si IMP1 hidrolizeaza toti
beta-lactamii cu exceptia aztreonamului, ceea ce justifica
recomandarea de a nu se folosi empiric carbapenemi.
Imag.4 Imag.5
Tratament
Tratamentul infectiilor severe
cu Ps.aeruginosa presupune initierea unui tratament empiric, inainte ca
rezultatul sensibilitatii sa fie cunoscut si modificarea
lui in functie de rezultatul antibiogramei.
Alegerea tratamentului empiric este
dictata de severitatea infectiei, cunoasterea epidemiologiei si
fenotipurilor de rezistenta din sectia in care este internat
bolnavul si istoricul pacientului privind folosirea antibioticelor.
Expunerea anterioara la imipenem, ciprofloxacin, piperacilina sau
ceftazidim creste probabilitatea ca Ps. aeruginosa sa fie rezistent
la antibiotice.
Recomandari in alegerea tratamentului:
cand Ps.aeruginosa este cunoscut sau se suspecteaza ca a produs infectia, pana se cunoaste rezultatul antibiogramei, se recomanda tratament empiric cu doi agenti cu activitate antipseudomonas;
in tratamentul empiric se evita antibioticele la care pacientul a fost recent expus;
cand sensibilitatea tulpinii care a produs infectia este cunoscuta se recomanda folosirea a doua antibiotice in pneumonie, endocardita, bacteriemie, pacient cu neutropenie si sepsis;
in cazul folosirii monoterapiei nu se recomanda aminoglicozidele, fluoroquinolonele si imipenemul;
in combinatii se pot folosi; urmatoarele asocieri: (1) un betalactam antipseudomonas (e.g. piperacillina, ceftazidim, cefepim, imipenem, meropenem, aztreonam) cu un aminoglicozid si (2) o penicilina (antipseudomonas) cu spectru extins si fluoroquinolone;
sunt raporate cateva date clinice in favoarea combinatiilor antibioticelor folosite in tratamentul infectiilor severe;
rolul asocierii antibioticelor in prevenirea rezistentei ramane controversat, sunt studii efectuate pe loturi de pacienti cu infectie cu Ps.aeruginosa, pentru care asocierea terapeutica nu a fost urmata de o scadere a rezistentei; in schimb alte studii efectuate demonstreaza ca rata mortalitatii, in cazul asocierii a doua antibiotice, este mult mai mica decat in cazul monoterapiei.
Emergenta infectiilor produse de Ps.aeruginosa multirezistent a necesitat gasirea unei alternative de tratament, asa cum sunt polymyxinele. S-au testat agenti mai vechi ca de exemplu colistin, desi asociat cu o multime de efecte adverse (neurotoxic, nefrotoxic) s-a dovedit activ in cazul tulpinilor multirezistente, iar in studiile raportate (e.g. pacienti cu pneumonie nozocomiala sau traheobronsita cu Ps.aeruginosa care au facut aerosoli cu colistin), s-a dovedit o terapie suplimentara benefica.
In ciuda diferitelor studii publicate care evidentiaza rezultatele favorabile privind sensibilitatea polymixinelor, NCCLS-2005 (The National Committee for Clinical Laboratory Standards) nu furnizeaza criterii interpretative pentru testarea lor in cazul infect iilor cu Pseudomonas aeruginosa.
Controlul infectiilor
Cycling-ul antibioticelor are rolul
de a reveni sau reduce rezistenta la antibiotice s24t, bazat pe
ecologia bacteriana a fiecarei sectii, stabileste folosirea
diferitelor clase de antibiotice la un interval predeterminat (totusi
alegerea poate fi influentata de antibioticele primite anterioar de
pacient ).
Gruson si colaboratorii au aplicat un
program de rotatie a antibioticelor, restrictionand folosirea
ceftazidimului si ciprofloxacinului pentru a reduce incidenta
pneumoniei la pacientii ventilati cauzata de microorganisme
rezistente la cele doua antibiotice.
Dupa o perioada de doi ani, s-a constatat o semnificativa scadere a numarului de bacilli Gram negativi rezistenti la antibiotice si a sensibilitat ii Ps.aeruginosa la cateva antibiotice antipseudomonas. Raspandirea Ps.aeruginosa poate sa fie controlata prin aplicarea masurilor de izolare, tehnici aseptice, dezinfectia instrumentarului, folosirea dezinfectantelor si antisepticelor si nu in ultimul rand dezinfectia mainilor.
Concluzii
Conform 'National Nosocomial
Infections Surveillance - NNIS', Pseudomonas Aeruginosa este cel mai comun
patogen asociat infectiilor nozocomiale.
Rezistenta multipla la
antibiotice face imposibila alegerea unui tratament al infectiilor,
iar selectarea rezistentei in timpul tratamentului determina
esecul terapeutic.
Aplicarea masurilor de prevenire
si control al infectiilor si cyclingul antibioticelor pot fi o
alternativa in reducerea raspandirii bacteriei si a
rezistentei la antibiotice.