
|
|
|
Metoda Hückel (1931) face parte din metodele empirice de calcul si reprezinta varianta cea mai simplificata de calcul a structurii electronice si a proprietatilor moleculare in cadrul teoriei orbitalelor moleculare. Aceasta metoda se aplica numai sistemelor de electroni delocalizati folosind un set restrans de orbitale atomice.
Metoda face apel la urmatoarele aproximatii si simplificari:
1. Aproximatia separabilitatii s p. Se considera ca sistemul de electroni al moleculei formeaza un schelet rigid care nu interactioneaza cu electronii , acestia din urma determinand in mare masura proprietatile chimice ale moleculelor, fapt constatat de altfel si experimental.
Aceasta separabilitate permite
scrierea functiei de unda totale ca un produs a doua functii,
una asociata sistemului de electroni (![]() ), iar cealalta sistemului de electroni (
), iar cealalta sistemului de electroni (![]() ):
):
![]() (I.34)
(I.34)
Metoda Hückel se ocupa doar
de functia ![]() care poate scrisa
sub forma unui determinant Slater (I.22) daca se cunosc orbitalele
moleculare
care poate scrisa
sub forma unui determinant Slater (I.22) daca se cunosc orbitalele
moleculare ![]() .
.
![]()
2.
Aproximatia LCAO: orbitalele moleculare ![]() sunt scrise sub forma
unei combinatii liniare de orbitale atomice folosind un set restrans de OA
sunt scrise sub forma
unei combinatii liniare de orbitale atomice folosind un set restrans de OA
![]() .
.
![]() (I.35)
(I.35)
Fiecare atom participa cu o orbitala de tip pz perpendiculara pe planul legaturilor s. Elementele din perioada a doua (C,N,O,F) participa cu orbitalele 2pz, iar cele din perioada a treia (S,Cl) cu orbitalele 3pz. In felul acesta numarul orbitalelor atomice (NO) va fi egal cu numarul atomilor.
3. Metoda nu considera in mod explicit repulsia intre electroni, folosind in locul hamiltonianului real al sistemului H un hamiltonian h format dintr-o suma de operatori monoelectronici efectivi, care includ, intr-o forma neexplicita, intreaga energie potentiala a electronului µ in interactie cu nucleul si cei n-1 electroni:
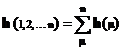 (I.36)
(I.36)
Acest lucru face ca metoda sa devina empirica, elementele de matrice ale acestui operatori fiind egalate cu parametrii empirici corespunzatori semnificatiei lor fizice.
Aplicand
metoda variationala pentru determinarea OM ![]() se obtine
sistemul de ecuatii liniar omogene:
se obtine
sistemul de ecuatii liniar omogene:
![]() (I.37)
(I.37)
Existenta unor solutii diferite de cea banala implica anularea determinantului secular:
![]() (I.38)
(I.38)
ecuatia (I.38) fiind o ecuatie de gradul NO in E.
4. Evaluarea elementelor determinantului (I.38) se bazeaza pe urmatoarele
aproximatii:
![]() reprezinta
integrala coulombiana
reprezinta
integrala coulombiana
avand semnificatia energiei pe care electronul
m o are in OA ![]() .
.
Valoarea acestei integrale depinde de electronegativitatea atomului, deci de sarcina neta purtata de atomul respectiv. Hückel atribuie tuturor atomilor de carbon din molecula aceeasi valoare a integralei coulombiene pe care o ia ca standard si egala cu a, o marime nedefinita care reprezinta energia unui electron din orbitala 2pz a atomului de carbon in campul corpului atomic (nucleu plus n-1 electroni)
![]() reprezinta
integrala de schimb
reprezinta
integrala de schimb
care se neglijeaza pentru atomii nelegati prin legaturi p si se considera egala cu parametrul b (nedefinit) considerat standard pentru legatura C-C. De remarcat ca aceasta integrala nu are semnificatie in fizica clasica si este o marime caracteristica fizicii cuantice.
De remarcat ca atat a cat si b sunt valori negative reprezentand energii de stabilizare. In rezumat:
 (I.39)
(I.39)
In cazul in care in molecula exista pe langa atomii de carbon si alti atomi (heteroatomi), elementele de matrice ale acestora sunt exprimate in termenii integralei coulombiene si de schimb standard a si b ale atomului de carbon:
![]()
![]()
![]()
![]()
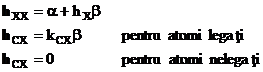 (I.40)
(I.40)
In
relatia (I.40) ![]() reprezinta
parametrul coulombian al heteroatomului X si este corelat cu
diferenta de electronegativitatea dintre heteroatomul X si atomul de
carbon:
reprezinta
parametrul coulombian al heteroatomului X si este corelat cu
diferenta de electronegativitatea dintre heteroatomul X si atomul de
carbon: ![]() > 0 pentru heteroatomii mai electronegativi decat carbonul
si
> 0 pentru heteroatomii mai electronegativi decat carbonul
si ![]() < 0 pentru cei mai putin electronegativi. Pentru
cazurile in care heteroatomul poate participa prin conjugare cu unul sau doi
electroni la sistemul de electroni p al moleculei (exemplu:
< 0 pentru cei mai putin electronegativi. Pentru
cazurile in care heteroatomul poate participa prin conjugare cu unul sau doi
electroni la sistemul de electroni p al moleculei (exemplu:![]() in compusii carbonilici sau
in compusii carbonilici sau ![]() in fenoli)
in fenoli) ![]() .
.
In ceea ce priveste parametrul de
rezonanta ![]() , acesta depinde de taria legaturii p(
, acesta depinde de taria legaturii p( ![]() ), lungimea
legaturii, precum si de
integralele de acoperire.
), lungimea
legaturii, precum si de
integralele de acoperire.
Valorile parametrilor coulombieni si de rezonanta se aleg in asa fel incat sa se obtina valori teoretice in concordanta cu cele experimentale pentru diferitele proprietati moleculare, valori care sunt folosite apoi la compusi de acelasi tip.
In Tabelul (I.1) sunt listate valorile curente a acestor parametrii pentru atomii principalele elementelor organogene si ai legaturile lor.
Tabelul I.1 Principalii parametrii coulombieni si de rezonanta utilizati in
metoda Hückel
Atom
hX
Legatura
kCX
C
0,0
![]()
1,0
N.
0,5-0,8
C C
0,9
N:
1,2-1,8
C=C
1,1
N+
2,0
C=O
1,2-1,5
O.
0,7-1,3
C O
0,7-0,8
O:
1,2-2,0
C=N-
1,0
O+
2,5
C NH2
0,8-1,0
S:
0,8-1,0
C S-
0,4-0,6
F
1,7-2,5
C F
0,6-0,8
Cl
1,5-2,0
C Cl
0,4
S(d)
-1,4
N O(NO2)
1,2-1,6
C-(S)
0,2
C NO2
1,1-1,2
5. In privinta integralelor ![]() metoda Hückel
neglijeaza integralele de acoperire:
metoda Hückel
neglijeaza integralele de acoperire:
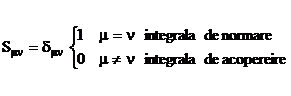 (I.41)
(I.41)
Aceasta este cea mai drastica aproximatie a metodei si a fost facuta in scopul simplificarii ecuatia (I.38). Aproximatia este justificata de faptul ca integralele de acoperire au valori mici ce scad rapid cu distanta, iar efectul ei este contracarat de alegerea unor parametrii a si b corespunzatori.
Wheland introduce integrala de acoperire pentru doua orbitale 2pz vecine, ajungand in final la rezultate formal identice cu cele din metoda Hückel. Diferenta consta in inlocuirea marimii b cu o alta marime ceea ce conduce la o parametrizare diferita.
Aplicarea metodei Hückel implica urmatoarele etape, etape exempli-ficate folosind molecula de acroleina:
a. numerotarea arbitrara atomilor implicati in conjugare:
![]()
b. scrierea determinantului secular:
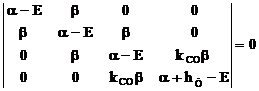 (I.42)
(I.42)
c. se imparte determinantul secular (I.42) cu b si se face schimbarea
de variabila:
![]()
Determinantul secular devine:
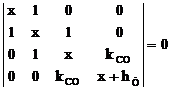 (I..43)
(I..43)
Se
inlocuieste ![]() si
si ![]() = 1,2 (valori luate
din Tabelul I.1)
= 1,2 (valori luate
din Tabelul I.1)
Determinantul (I.43) devine:
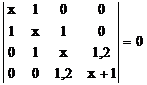 (I.44)
(I.44)
d.
Se
rezolva ecuatia (I.44), iar
radacinile ![]() conduc la valorile
parametrului E de forma
conduc la valorile
parametrului E de forma ![]() :
:
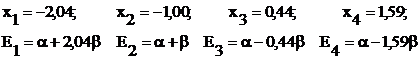
e.
Cu
fiecare valoare obtinuta pentru parametrul E se rezolva sistemul de
ecuatii (I.37), adaugand
conditia de normare impusaorbitalei moleculare ![]() ; se obtin in
acest fel seturile de coeficienti
; se obtin in
acest fel seturile de coeficienti ![]() care vor determina
OM
care vor determina
OM ![]() :
:
f. Se alcatuieste diagrama OM asezand energiile orbitalelor moleculare in ordine crescatoare (b<0) si se completeaza cu electroni conform principiului lui Pauli:
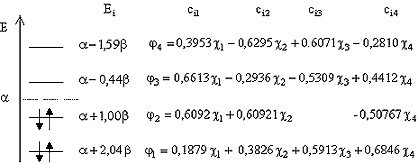
Figura I.1 Diagrama OM pentru acroleina
In
urma efectuarii unui calcul Hückel asupra unui sistem de electroni p se obtin ca un prim rezultat
energiile si forma orbitalelor moleculare ![]() .
.
Nivelele energetice obtinute in urma efectuarii unui calcul Hückel sunt plasate de o parte si de alta a valorii a. Valoarea a corespunde electronilor 2pz nelegati in atomul de carbon si daca apar orbitale moleculare cu aceasta valoare, ele reprezinta orbitale de nelegatura NB (Non Bonding). Orbitalele moleculare cu energii inferioare marimii a sunt orbitale liante, iar cele cu energii superioare antiliante. Ultima orbitala moleculara ocupata se mai numeste orbitala HOMO (Highest Occupied Molecular Orbital ), iar prima neocupata LEMO (Lower Empty Molecular Orbital)
Odata cunoscute energiile orbitalelor moleculare pot fi calculate urmatoarele marimi:
Se obtine prin insumarea energiilor orbitalelor moleculare ocupate:
![]() (I.45)
(I.45)
![]() fiind gradul de ocupare
al OM
fiind gradul de ocupare
al OM ![]() : 2 pentru orbitalele moleculare dublu ocupate, 1 pentru cele
semiocupate, si 0 pentru cele neocupate.
: 2 pentru orbitalele moleculare dublu ocupate, 1 pentru cele
semiocupate, si 0 pentru cele neocupate.
Tinand
cont de expresia generala a energiei orbitalelor moleculare (![]() ), energia electronilor p va fi de forma:
), energia electronilor p va fi de forma:
![]() (I.46)
(I.46)
Valoare
![]() va fi cu atat mai mare
cu cat sistemul de electroni p este mai mare.
va fi cu atat mai mare
cu cat sistemul de electroni p este mai mare.
In
cazul hidrocarburilor primul termen al expresiei (I.46) reprezinta energia
a n electroni care ocupa orbitalele ![]() ale celor n atomi de
C; rezulta ca cel de al doilea termen
ale celor n atomi de
C; rezulta ca cel de al doilea termen ![]() reprezinta
energia datorata conjugarii electronilor p. Notand
reprezinta
energia datorata conjugarii electronilor p. Notand ![]() cu m, o valoare
pozitiva, expresia energiei electronilor p devine:
cu m, o valoare
pozitiva, expresia energiei electronilor p devine:
![]() (I.47)
(I.47)
Cunoasterea energiei electronilor p delocalizati este necesara calcularii unei alte marimi numita energie de delocalizare.
Este definita ca diferenta intre energia
electronilor p delocalizati (![]() )
)
si energia electronilor p daca acestia ar fi
localizati (![]() ):
):
![]() (I.48)
(I.48)
Energia
electronilor p localizati se calculeaza prin insumarea energiilor
legaturilor p localizate intre doi atomi (![]() ) si a energiilor electronilor neparticipanti localizati pe
heteroatomi (
) si a energiilor electronilor neparticipanti localizati pe
heteroatomi (![]() ), sau neinperechiati (
), sau neinperechiati (![]() pentru carboradicalilor ):
pentru carboradicalilor ):
![]() (I.49)
(I.49)
unde ![]() si n reprezinta numarul dublelor
legaturi C = C, numarul electronilor neparticipanti si
respectiv numarul electronilor neinperechiati.
si n reprezinta numarul dublelor
legaturi C = C, numarul electronilor neparticipanti si
respectiv numarul electronilor neinperechiati.
Energiile
![]() se obtin in urma unui calcul Hückel pe molecule formate
din doi atomi (vezi paragraful Aplicatii)
se obtin in urma unui calcul Hückel pe molecule formate
din doi atomi (vezi paragraful Aplicatii)
Energia de delocalizare, asa cum este definita prin relatia (I.48), este o marime negativa, se exprima in unitati b b<0) si reprezinta un criteriu de stabilitate moleculara: molecula va fi cu atat mai stabila cu cat energia de delocalizare va fi mai mare (in unitati b Deoarece energia de delocalizare va depinde de marimea sistemului de electroni p delocalizati, pentru a compara sisteme cu un numar diferit de electroni, se defineste o energie de delocalizare per electron prin raportarea relatiei (I.48) la numarul de electroni p din sistemul respectiv.
Avand in vedere ca marimea parametrului b nu este definita ca valoare si in acelasi timp depinde de tipul compusului, in cadrul metodei Hückel nu se pot face decat analize relative privind variatia unor proprietati moleculare in cadrul unei serii de compusi inruditi.
Energia de ionizare a moleculei ![]()
Reprezinta energia necesara smulgerii unui electron din molecula, care se presupune ca se afla in orbitala moleculara HOMO, cu obtinerea unui ion molecular si a unui electron liber in repaus (energie zero):
![]() (I.50)
(I.50)
Energia de reducere ![]()
Reprezinta energia pusa in joc cand molecula primeste un electron pe nivelul LEMO:
![]() (I.51)
(I.51)
Tranzitiile spectrale ![]()
In principiu metoda Hückel permite calculul spectrului de absorbtie. Deoarece metoda nu ia in calcul in mod explicit repulsia intre electroni, cuanta de energie absorbita va fi egala cu diferenta dintre energia celor doua nivele intre care are loc tranzitia electronului. Astfel prima tranzitie presupune trecerea unui electron de pe HOMO pe LEMO. Energia absorbita va fi egala cu:
![]() (I.52)
(I.52)
Avand
in vedere ca energia unei orbitale este de forma ![]() , rezulta:
, rezulta:
![]()
![]()
![]() (I.53)
(I.53)
Astfel folosind diagrama din Figura I.1 se obtine pentru prima tranzitie in molecula de acroleina valoarea:
![]()
Energia tranzitiilor spectrale se obtine in unitati b. Se poate face o apreciere a deplasarii maximului de absorbtie intr-o serie de compusi inruditi sau, ca urmare a introducerii unor substituenti in molecula. Totodata, prin compararea valorilor teoretice cu cele experimentale se poate calcula valoarea integralei de schimb:
![]() (I.54)
(I.54)
Odata
obtinuta valoarea b, valoarea integralei coulombiene a se poate calcula din valoarea
experimentala a energiei de ionizare ![]()
![]() (I.55)
(I.55)
Valorile parametrilor a si b astfel obtinute nu sunt transferabile decat la compusii din aceeasi serie.
Odata cunoscute expresiile orbitalele moleculare sub forma unor combi-natii liniare de orbitale atomice (I.35) se pot calcula o serie marimi corelabile direct, sau prin intermediul altor marimi derivate, cu datele experimentale. Dintre acestea deosebit de importante sunt densitatea de sarcina p pe atom si ordinul de legatura p definite de Coulson prin relatiile (I.56) si (I.57).
densitatea de sarcina p pe atom m
![]()
![]() = 2,1,0 (I.56)
= 2,1,0 (I.56)
ordinul de legatura p intre atomii m si n
![]()
![]() = 2,1,0 (I.57)
= 2,1,0 (I.57)
unde ![]() reprezinta
coeficientii orbitalelor atomice m si n in orbitala moleculara i, iar
reprezinta
coeficientii orbitalelor atomice m si n in orbitala moleculara i, iar ![]() numarul de
electroni din aceasta orbitala.
numarul de
electroni din aceasta orbitala.
Densitatea de sarcina pe atomul m reprezinta fractia de electroni localizata pe atomul m ; suma densitatilor de sarcina va fi egala cu numarul total de electroni p din molecula :
![]() (I.58)
(I.58)
Densitatea de sarcina ofera informatii privind structura electronica a
moleculei, a distributiei electronilor pe atomi si dupa cum se va vedea reprezinta un indice de reactivitate al moleculei.
Ordinul de legatura p poate fi corelat cu distanta dintre atomi, cu taria si cu gradul de localizare al legaturii p; totodata, ca si densitatea de sarcina, este folosit ca indice de reactivitate.
Densitatile de sarcina
si ordinele de legatura p calculate pentru molecula de
acroleina, luata ca exemplu, sunt date in Figura I.2, ![]() fiind trecute in
dreptul atomilor, iar
fiind trecute in
dreptul atomilor, iar ![]() pe legaturi:
pe legaturi:
![]()
Figura I.2 Diagrama moleculara a acroleinei
Se observa ca, datorita conjugarii, apare un caracter de dubla legatura si intre atomii 2 si 3, iar pe atomul de oxigen, mai electronegativ, un surplus de electroni.
Sarcina neta pe atom ![]()
Se poate defini, in locul
densitatii de sarcina, sarcina neta pe atomul m data de diferenta intre
numarul de electroni cu care atomul respectiv participa la conjugare
(![]() ) si densitatea de sarcina:
) si densitatea de sarcina:
![]() (I.59)
(I.59)
Momentul de dipol electric ![]()
Folosind sarcina neta pe atomi se
poate calcula componenta p a momentului de dipol electric ![]() prin insumarea vectoriala a componentelor sale carteziene
prin insumarea vectoriala a componentelor sale carteziene ![]() :
:
![]() (I.60)
(I.60)
in care:
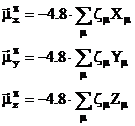 (I.61)
(I.61)
unde ![]() reprezinta
coordonatele carteziene ale atomului m exprimate in Ċ (1Ċ = 10-8 cm),
coeficientul 4,8 provine de la sarcina electronului exprimata in
unitati electrostatice de sarcina (4,8 10 10 u.e.s), iar semnul minus asigura semnul conventional al
momentului de dipol; in felul acesta rezultatele se obtin in Debye,
unitatea practica in care se exprima momentul de dipol (1D = 10-10
u.e.s · cm).
reprezinta
coordonatele carteziene ale atomului m exprimate in Ċ (1Ċ = 10-8 cm),
coeficientul 4,8 provine de la sarcina electronului exprimata in
unitati electrostatice de sarcina (4,8 10 10 u.e.s), iar semnul minus asigura semnul conventional al
momentului de dipol; in felul acesta rezultatele se obtin in Debye,
unitatea practica in care se exprima momentul de dipol (1D = 10-10
u.e.s · cm).
Daca se face insumarea vectoriala a componentei p cu componenta s, obtinuta la randul ei prin
insumarea vectoriala a momentelor de legatura, se obtine
momentul de dipol electric al moleculei ![]() :
:
![]()
![]() (I.62)
(I.62)
o marime accesibila direct experimental si care poate sa confirme, sau nu, justetea distributiei de sarcina obtinuta teoretic.
Prin aplicarea metodelor cuantice se pot obtine informatii privind nu numai structura electronica, dar si reactivitatii chimice. Aproximatiile folosite in tratarea reactivitatii chimice sunt legate de modul de aproximare a starii de tranzitie; aceste aproximatii au condus in principal la doua modele: modelul moleculei izolate si modelul dinamic.
1. Modelul moleculei izolate. Indici statici de reactivitate
Modelul moleculei izolate considera ca starea de tranzitie este atinsa foarte rapid si este apropriata, similara ca structura de cea a moleculei substrat; modelul este adecvat moleculelor foarte reactive, cu energie de activare mica, cand starea de tranzitie se atinge foarte rapid. Modelul face abstractie de reactant si conduce la o serie de indici statici de reactivitate ce pot fi evaluati folosind numai orbitalele moleculare si energiile proprii substratului.
Densitatea de sarcina ![]() si sarcina neta
si sarcina neta ![]() ,
definite de relatiile (I.56), respectiv (I.59). Pozitiile cele mai
reactive in substitutia electrofila (SE)sunt cele cu densitatea de
sarcina maxima, respectiv cu sarcina neta negativa, maxima in valoare absoluta. In
cazul substitutiei nucleofile (SN) pozitiile cele mai reactive vor fi
cele cu densitatea de sarcina minima, respectiv cu sarcina neta pozitiva maxima.
,
definite de relatiile (I.56), respectiv (I.59). Pozitiile cele mai
reactive in substitutia electrofila (SE)sunt cele cu densitatea de
sarcina maxima, respectiv cu sarcina neta negativa, maxima in valoare absoluta. In
cazul substitutiei nucleofile (SN) pozitiile cele mai reactive vor fi
cele cu densitatea de sarcina minima, respectiv cu sarcina neta pozitiva maxima.
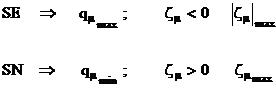 (I.63)
(I.63)
Ordinul de legatura p ![]() definit de
relatia (I.57), poate fi folosit ca indice static de reactivitate in
reactiile de aditie: reactiile de aditie vor avea loc mai
usor cu cat legatura p este mai localizata deci cu cat
valoarea
definit de
relatia (I.57), poate fi folosit ca indice static de reactivitate in
reactiile de aditie: reactiile de aditie vor avea loc mai
usor cu cat legatura p este mai localizata deci cu cat
valoarea ![]() este mai mare.
este mai mare.
Indicele de valenta
libera ![]() se defineste ca:
se defineste ca:
![]() (I.64)
(I.64)
si reflecta capacitatea atomului m de a forma noi legaturi. In relatia
(I.64) ![]() reprezinta suma
maxima a ordinelor de legatura p pe care un atom o poate forma; pentru
atomul de carbon
reprezinta suma
maxima a ordinelor de legatura p pe care un atom o poate forma; pentru
atomul de carbon ![]() si este o valoare
teoretica obtinuta in urma unui calcul de tip Hückel pe molecula
ipotetica de trimetilenmetam, molecula in care atomul de carbon ar fi
implicat in maximum de legaturi p posibile.
si este o valoare
teoretica obtinuta in urma unui calcul de tip Hückel pe molecula
ipotetica de trimetilenmetam, molecula in care atomul de carbon ar fi
implicat in maximum de legaturi p posibile.
Indicele
de valenta libera s-a dovedit un indice care, pentru prima
data, a putut explica, pe o baza teoretica viabila,
aditia 1-4 in sistemele conjugate (polimerizari, aditia Diels
Alder diena-filodiena, etc.): aditia are loc la atomii m si n pentru care suma (![]() +
+ ![]() ) este maxima. De asemenea acest indice poate fi folosit si in
reactia de substitutie radicala, substitutia avand loc la atomul
cu
) este maxima. De asemenea acest indice poate fi folosit si in
reactia de substitutie radicala, substitutia avand loc la atomul
cu ![]() maxim.
maxim.
Aditia 1-4![]()
(I.65)
![]()
Autopolarizabilitatea ![]() , un indice obtinut prin aplicarea teoriei
perturbatiei, considerand ca reactantul induce o perturbatie la
apropierea de substrat. Acest indice este definit de relatia:
, un indice obtinut prin aplicarea teoriei
perturbatiei, considerand ca reactantul induce o perturbatie la
apropierea de substrat. Acest indice este definit de relatia:
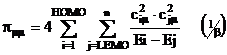 (I.66)
(I.66)
Autopolarizabilitatile
se exprima in unitati ![]() si sunt folosite
ca indici de reactivitate in substitutia electrofila si
nucleofila, substitutia avand loc la atomii cu
si sunt folosite
ca indici de reactivitate in substitutia electrofila si
nucleofila, substitutia avand loc la atomii cu ![]() maxime; acest indice
de reactivitate nu face distinctie intre natura reactantului electrofil
sau nucleofil.
maxime; acest indice
de reactivitate nu face distinctie intre natura reactantului electrofil
sau nucleofil.
![]()
![]() (I.67)
(I.67)
Densitatea electronilor de frontiera ![]() , un indice introdus de Fukui in 1952 pentru substitutia
electrofila, nucleofila si radicalica. Se bazeaza pe analogia pe care Fukui o face intre
electronii de frontiera (electroni ce ar ocupa orbitalele moleculare HOMO
si LEMO) si electronii de valenta ai atomilor, privind
rolul determinant al acestora pentru proprietatile chimice ale
moleculelor. Desi mult controversata aceasta ipoteza a
condus in foarte multe cazuri la rezultate in concordanta cu datele
experimentale.
, un indice introdus de Fukui in 1952 pentru substitutia
electrofila, nucleofila si radicalica. Se bazeaza pe analogia pe care Fukui o face intre
electronii de frontiera (electroni ce ar ocupa orbitalele moleculare HOMO
si LEMO) si electronii de valenta ai atomilor, privind
rolul determinant al acestora pentru proprietatile chimice ale
moleculelor. Desi mult controversata aceasta ipoteza a
condus in foarte multe cazuri la rezultate in concordanta cu datele
experimentale.
Densitatea electronilor de frontiera este definita prin relatia:
![]() (I.68)
(I.68)
Pozitiile cele mai reactive sunt dupa Fukui cele pentru care densitatea electronilor de frontiera este maxima:
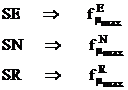 (I.69)
(I.69)
Pentru a-si argumenta teoria Fukui introduce un nou indice de reactivitate numit superdelocalizabilitate, dar care este un indice de reactivitate dinamic, luand in considerare, in mod neexplicit si reactantul.
2. Modelul dinamic. Indici dinamici de reactivitate
Modelul dinamic, care considera starea de tranzitie diferita de cea a reactantilor, modificata de reactantul propriu-zis, desi acesta nu intervine explicit. Modelul dinamic a condus la indicii dinamici de reactivitate.
Superdelocalizabilitatea ![]()
![]() a fost introdusa
de Fukui in 1954 ca indice dinamic luand in considerare o hiperconjugare care
ar apare intre reactant si substrat. Este definita prin:
a fost introdusa
de Fukui in 1954 ca indice dinamic luand in considerare o hiperconjugare care
ar apare intre reactant si substrat. Este definita prin:
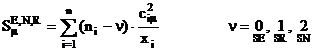 (I.70)
(I.70)
Pozitiile cele mai reactive sunt cele pentru care superdelocalizabilitatea este maxima:
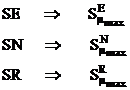 (I.71)
(I.71)
Energia de localizare ![]() introdusa de
Wheland pentru reactiile de substitutie in seria aromatica
si are la baza ipoteza formarii unui complex s in starea de tranzitie, in care apare
o legatura s intre reactant si atomul de carbon atacat al substratului.
Datorita acestei legaturi carbonul la care va avea loc
substitutia isi schimba starea de hibridizare de la sp2
la sp3 fiind scos din conjugare. Delocalizarea celor (n-n) electroni, n fiind functie de tipul
substitutiei (2 pentru SE, 1 pentru SR si 0 pentru SN), se va face pe
restul atomilor ramasi in conjugare.
introdusa de
Wheland pentru reactiile de substitutie in seria aromatica
si are la baza ipoteza formarii unui complex s in starea de tranzitie, in care apare
o legatura s intre reactant si atomul de carbon atacat al substratului.
Datorita acestei legaturi carbonul la care va avea loc
substitutia isi schimba starea de hibridizare de la sp2
la sp3 fiind scos din conjugare. Delocalizarea celor (n-n) electroni, n fiind functie de tipul
substitutiei (2 pentru SE, 1 pentru SR si 0 pentru SN), se va face pe
restul atomilor ramasi in conjugare.
Energia
de localizare ![]() este definita de
Wheland ca diferenta intre energia
in substrat
este definita de
Wheland ca diferenta intre energia
in substrat ![]() si energia
electronilor p ramasi in complexul s, format prin atacarea pozitiei m (
si energia
electronilor p ramasi in complexul s, format prin atacarea pozitiei m (![]() ):
):
![]() (I.72)
(I.72)
Tinand cont ca cei doi termeni ai diferentei sunt de forma (I.57), energia de localizare se poate scrie:
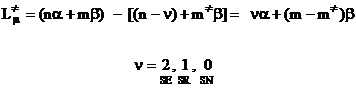 (I.73)
(I.73)
Deoarece numai ultimul termen este cel ce va diferentia pozitiile intre ele, in locul relatiei (I.73) se poate folosi pentru energia de localizare relatia:
![]() (I.74)
(I.74)
Energia de localizare se exprima in unitati b si cum este direct proportionala in valoare absoluta cu energia de activare a reactiei, pozitia cea mai reactiva va fi cea cu cea mai mica energie de localizare.
1. Sa se scrie determinantii Hückel pentru: a. benzen; b. fenol;c. nitrobenzen.
Rezolvare:
- Se numeroteaza atomii:
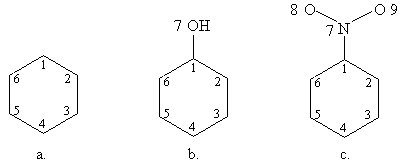
- Se scriu determinantii Hückel folosind parametrii coulombieni si de schimb adecvati pentru gruparile-OH si -NO2 luati din Tabelul I.1:
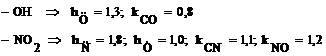
a.
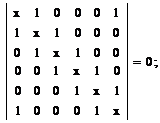
b.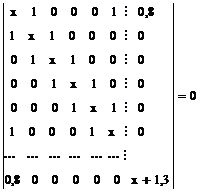 c.
c. 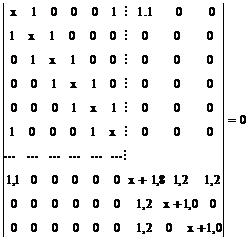
Obs. daca se pastreaza numerotarea ciclului aromatic determinantii b. si c. se obtin adaugand determinantului benzenului o linie si o coloana, respectiv trei linii si trei coloane corespunzatoare atomilor substituentilor.
2. Sa se determine energia de delocalizare a acroleinei.
Rezolvare:
Energia de delocalizare este
data de relatia (I.47): ![]()
Energia electronilor p se calculeaza cu relatia (I.45) facand apel la rezultatele obtinute prin aplicarea metodei Hückel pentru acroleina (vezi 1), rezultate trecute in diagrama orbitalelor moleculare din Figura I.1:
![]()
![]()
![]()
![]()
Energia electronilor p
localizati ![]() se obtine prin
particularizarea relatiei (I.49):
se obtine prin
particularizarea relatiei (I.49):
![]()
![]()
Este necesara deci cunoasterea energiilor legaturilor p C=C si C=O, energii ce se pot obtine prin efectuarea unui calcul Hückel pentru molecula de etena si aldehida formica.
Pentru etena: ![]()
Deteminantul Hückel este: ![]() cu solutiile
cu solutiile ![]() ;
;
Energiile OM sunt ![]()
![]() si
si ![]()
Diagrama OM:
![]()
![]()
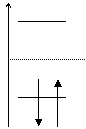
![]()
a ![]()
![]()
Energia electronilor p in molecula de etena si deci energia unei legaturi p localizate C=C este:
![]()
Pentru
aldehida formica: ![]()
![]()
Deteminantul Hückel este: ![]() cu solutiile;
cu solutiile; ![]()
Energiile OM sunt ![]()
![]() si
si ![]()
Diagrama OM:
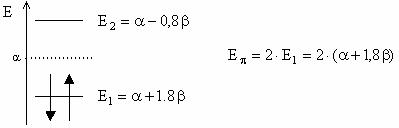
Energia electronilor p in molecula de aldehida formica si deci energia unei legaturi p localizate C=O este:
![]()
Energia electronilor p
localizati ![]() in acroleina:
in acroleina:
![]() ,
,
iar energia de delocalizare va fi:
![]()
3. Sa se calculeze densitatile de sarcina si sarcinile nete pe atomii fenolului, precum si energiile de localizare la substitutia electrofila in pozitiile orto, meta si para. Sa se interpreteze rezultatele obtinute.
Rezolvare:
Se foloseste numerotarea si determinantul scris la aplicatia 1. Prin rezolvarea acestuia si a sistemului de ecuatii din care a provenit. Se poate folosi fie un program de calcul de tip Hückel fie o subrutina de vectori si valori proprii cum ar fi cea a pachetului Mathcad; se obtin urmatoarele energiile si orbitale moleculare:
I
xi
ji
c1 c2 c3 c4 c5 c6 c7
1
2.1769
0.5116 0.37020.2942 0.27030.2942 0.3702 0.4667
0.2126 -0.0999 -0.3681 -0.4730 -0.3681 -0.0999 0.6634
-0.00000.5000 0.5000 -0.0000 -0.5000 -0.5000 0.0000
0.41230.3596 -0.1635 -0.4727 -0.16350.3596 -0.5424
-0.0000 -0.50000.5000 -0.0000 -0.50000.50000.0000
0.5693 -0.2340 -0.3142 0.5765 -0.3142 -0.2341 -0.1906
-0.44580.4109 -0.3904 0.3836 -0.39040.41090.1069
2
1.5564
3
1.0000
4
0.6918
5
-1.0000
6
-1.0899
7
-2.0351
Fenolul
are primele 4 OM dublu ocupate pentru care ![]() este 2, celelalte
fiind neocupate
este 2, celelalte
fiind neocupate ![]() este 0;
este 0;
Se calculeaza densitatile de sarcina p si sarcinile nete folosind relatiile (I.56) si (I.59). Se obtine:
Atom
![]()
![]()
C1
0.9541
0.0459
C2,C6
1.0527
0.0527
C3,C5
0.9976
0.0023
C4
1.0407
0.0407
O
1.9045
0.0955
Obs.: Se constata densitati de sarcina supraunitare si sarcini nete negative in pozitiile 2, 6 si 4, ceea ce explica atacul electrofil in pozitiile orto si para.
Pentru calculul energiei de localizare :
calculeaza energia electronilor p:
![]()
considera
urmatoarele structuri ale complecsilor s care se formeaza in starea de tranzitie prin
atacul agentului electrofil ![]() in pozitiile
orto, meta si para:
in pozitiile
orto, meta si para:
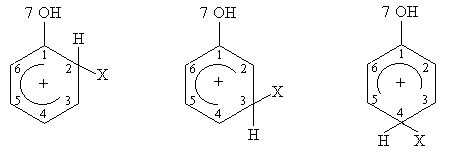
Aceste structuri reprezinta sisteme de 6 electroni p delocalizati pe 6 atomi;
Se scriu determinantii Hückel cu parametrii: ![]() si se obtin
energiile p ale complecsilor
si se obtin
energiile p ale complecsilor ![]() :
:
![]()
- Energiile
de localizare se obtin din (I.74): ![]()
![]()
![]()
Obs.: Pozitiile oro si para sunt favorizate atacului electrofil fata de pozitia meta, energiile de localizare respective fiind mai mici.
4. Sa se calculeze energia de delocalizare a formelor lactimica si lactamica a citozinei. Sa se discute rezultatul.
Rezolvare:
Se scriu structurile celor doua forme:
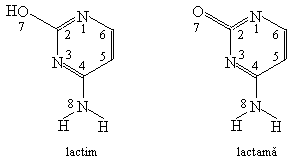
Se scriu determinantii Hückel folosind urmatorii parametrii:
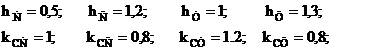
Rezolvand determinantii se obtin in final energiile electronilor p delocalizati:
![]()
Energiile electronilor p localizati pentru cele doua forme se scrie conform relatiei (I.49):
Pentru
energiile![]() si
si ![]() se folosesc rezultatele obtinute in aplicatia 2:
se folosesc rezultatele obtinute in aplicatia 2:
![]() ;
;
![]() ;
;
Pentru
calculul ![]() se aplica metoda Hückel metileniminei
se aplica metoda Hückel metileniminei ![]() urmand
urmand
procedura din aplicatia 2:
Parametrii: ![]()
Deteminantul Hückel este: ![]() cu solutiile:
cu solutiile:
![]()
Energiile OM sunt: ![]()
![]() si
si ![]()
Diagrama OM:
![]()
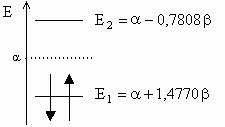
Energia electronilor p in molecula de metilenimina si deci energia unei legaturi p localizate C=N este:
![]()
Energiile electronilor localizati vor fi:
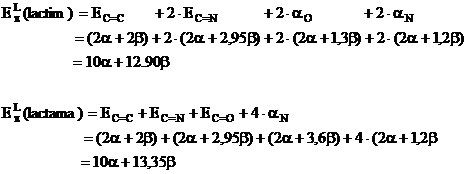
Cu aceste valori energiile de delocalizare devin
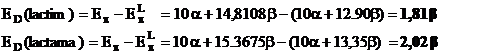
OBS.: Avand energia de delocalizare mai mare, forma lactamica este favorizata, echilibrul lactim-lactama fiind deplasat spre aceasta forma. Acest fapt este valabil pentru toate bazele pirimidinice si purinice si in aceasta forma sunt prezente in acizii nucleici.