|
|
|
Intrebari si raspunsuri la chimie anul 1
CAP.1.INTRODUCERE
1.care sunt caracteristiciile prin care se difinesc substantele?
R: substantele se definesc prin omogenitatea si compozitie unitara (compozitie constanta)
2.ce se intelege prin omogenitate?
R: omogenitatea este propietatea sistemelor de a prezenta aceleasi caracteristici in tot cuprinsul lor.
3.ce intelegeti prin compozitie unitara(constanta)?
R: constanta compozitiei desemneaza faptul ca in orice portiune de substante se gasesc aceiasi particule care interactioneaza in acelasi mod (adica exista acelasi tip de molecule)
4.ce intelegeti prin materiale? Explicate, exemplificati.
R: marea majoritate a corpuriilor sunt constituite din amestecuri de substante, pt acestea este indicat numele de materiale.
De ex: unele aliaje sunt materiale omogene dar nu sunt substante deoarece nu au compozitie unitara.
In componenta lor intra diferite metale in proporti variabile.
De ex: benzina desi este un material lichid omogen nu este substanta deoarece nu are compozitie unitara , poate fi de ex separate prin distilare intr-un nr mare de substante.
De ex: aerul( este un amestec din mai multe substante)
5.ce intelegeti prin materiale eterogene? Explicate, exemplificati.
R: materiale eterogene sunt formate din parti care au propietati diferite ( nu au propietati identice in toata masa lor )
Materiale ca: lemnul, betonul, otelul sunt eterogene pt. ca se poate observa(cu ochiul liber, cu microscopul sau cu alte mijloace) ca sunt formate din mai multe componente.
Ex: lemnul are inele tari si moi
Extra: Substnetele: -omogenitate
-compozitie unitara →nu pot fi separate .
Materiale: -omogene
-eterogene
(materialele sunt un amestec de substante)!,→ ele pot fi separate
6.care este caracteristica propietatilor intensive ale substantelor si materialelor? Dar caracteristica propietatilor extensice?exemplificati.
R:Substantele si materialele se deosebesc intre ele prin propietatiile care le au si care le servesc la caracterizarea lor:
prop. Intensive: sunt cele care nu depind de cantitatea de substanta : densitatea, pct de fierbere, pct de topire, caldura specifica, vascozitatea.
Prop. Extensive: sunt cele care depind de cantitatea de substanta fiind proportionala cu aceasta: masa si volum.
7.dati cate 3 exemple de substante sau materiale de natura anorganica, repectiv de natura organica.
Substantele si materialele se impart in 2 mari categori : 1.subst. si materiale de natura anorganica -apa, oxygen, aer, sticla, beton, otel, aur, minereuri. -acizi anorganici (minerali): acid sulfuric(H2 SO4, HCL, HNO3.
-baze anorganice: NaOH, KOH
-saruri anorganice: NaCl(clorura de sodium), KCl, NH4, NO3. 2.de natura organica: CH4, CH3CH2OH,
-produse farmaceutice
- combustibili
-lubrifianti
-cauciuc
-mase plastice
-fibre sintetice
CAP.2.STRUCTURA SUBSTANTELOR
2.1.atom, element chimic, izotopi
1.ce sunt nucleonii? Ce reprezinta numarul atomic Z? dar numarul de masa A?
Atomul este constituit din nucleu si invelis electronic. Protoni si neutroni, care alcatuiesc nucleu atomic se numesc nucleoni.
numarul de protoni din nucleu se noteaza cu Z
numarul de particule din nucleu adica suma nr de protoni si nr de neutroni se numeste nr de masa si se noteaza cu A.
2.ce este un element chimic? Cum se reprezinta elementele chimice? Dati 3 exemple.
Specia de atomi care au aceiasi nr de atomi Z formeaza un element chimic.(elementele chimice se reprezinta prin simboluri)
Ex: Hydrogenium - H Hydrogenium - Hg
Nitrogenium - N
Natrium - Na
3.ce sunt izotopii? Exemplificati.
Exista specii de atomi care desi au acelasi nr atomic Z au nr de masa A diferit, ci anume ei se numesc izotopi.
|
z- nr protoni |
N-nr neutroni |
A=Z+N Nucleoni |
simbol |
denumire |
|
1 |
0 |
1 |
|
Protinium |
|
1 |
1 |
2 |
|
Deuteriu |
|
1 |
2 |
3 |
|
Tritiu |
2.2 Structura invelisului de electroni al atomului
1.tipuri de orbitali.descriere
Orbitali au diferite forme si energi. Se cunosc 4 tipuri de orbitali:
-orbitali de tip S , au forma sferica,un substrat S contine un singur orbital si deci contine max 2 electroni
-orbitali de tip b au 2 lopi egali, situati de o parte si de alta a nucleului, intr-un substrat p sunt 3 orbitali orientate in spatu, dp cele trei axe de coordonate (Px, Py, Pz) un substrat p contine 6 electroni.
-orbitali de tip d au forma mai complicate, sunt in nr de 5 si sunt complet ocupati cand au 10︣e.
-orbitali de tip f sunt in nr de 7 si sunt complet ocupati cand au 14 e︣︣.
-pt acelasi strat energia cea mai mica au electroni din substratul s si aceasta creste in oridinea s,p,d,f.
2.Care sunt electronii din invelisul electronic al unui atom care au energia cea mai mica? Dar cei care au energia cea mai mare?
Energia electronului este cu atat mai mica cu cat acestia sunt mai apropiati de nucleu. Cea mai mica energie o au in stratul K(1) iar cea mai mare energie o au electroni din ultimu strat numit si strat de valenta.
|
Stratul |
K(1) |
L(2) |
M(3) |
N(4) |
||||||
|
Numarul max de electroni pe strat |
2 |
8 |
18 |
32 |
||||||
|
Substratul |
1s |
2s |
2p |
3s |
3p |
3d |
4s |
4p |
4d |
4f |
|
Numarul max de electroni pe substrat |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
14 |
3. Ce este electronul distinctiv si unde se gaseste el in inveliul electronic al unui atom?
Electronul prin care un element se deosebeste de cel precedent in sistemul periodic se numeste electron distinctiv.
E distinctiv si se afla pe nivel energetic cel mai ridicat. Pozitia acestuia in invelisul electronic este de cea mai mare importanta pt comportarea chimica a elementului respectiv.
4.Scrieti configuratia electronica a elementului cu Z=. specificati din ce perioada si din ce bloc de elemente face parte (explicate).
Rezolvare: - prima data se deseneaza tabla de sah
se stabileste dp tabla de sah ordinea de ocupare cu electroni a substratului.
Exe: z=15
1s(2)2s(2)2p(6)3s(2)3p(3) (s(2)inseamna s la puterea a 2-a , 3s(2) inseamna s la puterea a 2..si asa mai departe)
(in total in aceasta configuratie sunt 15 electroni (se aduna electroni de la putere) blocul este p iar perioada este nr cel mai mare adik 3)
Exe: z=11
1s(2)2s(2)2p(6)3s(1)
-perioada este 3,iar blocul s(deoarece este ultimul electron )
5.Cum isi realizeaza metalele configuratia stabila de gaz rar?exempificati.
In tendinta lor de a ajunge la configuratia, cel mai apropiat gaz rar din sistemul periodic unde metalele cedeaza electroni de valenta devenind ioni pozitivi.
Ex: Li (z=3) 1s(2)2s(2)→-un electron →1s(2)(este un dublet)
6.Cum isi realizeaza nemetalele configuratia stabila de gaz rar?exemplificati.
Pentru a ajunge la configuratia gazului rar, cel mai apropiat nemetal accepta electroni devenind ioni negative
Ex: Cl din grupa 17 accepta un electron deci este monovalenta
Cl (z=17) 1s(2)2s(2)2p(6)3s(2)3p(5)→+e→1s(2)2s(2)2p(6)3s(2)3p(6)=[ (18)Ar]
7.Ce sunt elementele cu character metalic? Unde se afla in sistemul periodic elementele cu caracterul metalic cel mai pronuntat?
Elementele ai caror atomi au tendinta de a pierde electroni se numesc electroni pozitivi si se spune despre ele ca au character metalic.
Elementele cu character metalic cel mai pronuntat se gasesc in stanga jos al sist periodic.
8.Ce sunt elementele cu character nemetalic? Unde se afla in sistemul periodic elementele cu caracterul nemetalic cel mai pronuntat?
Elementele ai caror atomi atrag puternic electroni se numesc electroni negative si se spune despre ele ca au character nemetalic.
2.3.Legaturi chimice
1.Ce tipuri de legaturi chimice cunoasteti? Enumerati.
Sunt de 2 tipuri :
-legaturi tari:-ionica
-covalenta
-metalica
-legaturi slabe: -de hydrogen
- fortele van de var
- interactiuniile dipole
2.Cum se formeaza legatura ionica? Exemplificati.
Formarea combinatiilor ionice are loc ca urmare a atractiei electrostatice intre ioni cu sarcini de semne contrare, formati prin transfer de electroni de la atomi elementelor cu caracter electro-pozitivi (metale) la atomi elementelor cu caracter electro-negativi (nemetale).
De ex: Formare clorura de sodiu implica transferal unui electron de la atomul de sodiu la atomul de clor.
3. Conductibilitatea electrica a substantelor ionice. Explicate.
In stare solida ioni ocupa poziti fixe I crystal determinate de leg electro-valenta care este o leg puternica. Din acest motiv ioni nu se deplaseaza sub actiunea campului electric si deci curentul nu trece prin cristale. In stare topita sau in solutie reteaua cristalina este dispusa si ioni devin mobile. Subst ionice se mai numesc conductor ionici sau conductori de ordin 2.
4.Cum se formeaza legatura covalenta? Exemplificati.
La interactiunea dintre 2 atomi negative configuratia electronica stabile de gaz rar poate fi realizata prin punerea in comun a perechilor de electroni.
Ex: 2 atomi de Cl
(1s2 2s2 2p6 3s2 3p5) ajung la configuratia electronica a argonului ( z=18)
5.Cum se formeaza legatura covalenta nepolara? Exemplificati.
Legatura covalenta este nepolara in cazul moleculelor diatomice cu atomi identici (ex: H2, O2, N2, CL2) deoarece perechiile commune de electroni apartin in mod egal atomilor legati.
Ex: H∙ + ∙H → H:H H-H
6. Cum se formeaza legatura covalenta polara? Exemplificati.
Legatura covalenta polara atunci cand intre atomi legati exista diferenta de electro- negativitate si ca urmare electroni de legatura vor fi mai puternic atrasi de atomul mai electro-negativ.
7.Din ce fel de atomi sunt constituite moleculele simple? Dar cele complexe? Dati cate trei exemple pentru fiecare.
Molecule pot fi: -simple: constituie din atomi ai aceluiasi element:
-H2, O2, O3, N2, Cl2, I2, F2.
-complexe : constituite din atomi ai mai multor elemente, cel putin 2: -H2O, HCL, H2SO4, HNO3, H3PO4, CH4, C3COH
8.Calculati numarul de moli de substanta din 100g Nacl. Se dau ANa (cu Na la indice:P) = 23 si ACl (cu Cl la indice).
MNaCl(cu NaCl la indice) = ANa +ACl = 23+35,5 = 58,5% g/mol
nNaCl (cu NaCl la indice) = mNaCl/MNaCl = 100g/58,5 g/mol = 1,709 mol.
9. Din ce motiv metalele uzuale au structura policristalina? Explicate.
Unele metale se gasesc in mai multe forme cristaline. Prezentand fenomenul de polimorfism. Ex: Fierul pana la 906 ◦C are o retea cubica ctrata intern si se numeste (fier alfa ) iar intre 906-1401◦C are o retea cubica cu fete centrate (fier gama)
10.In ce mod se pot imprima metalelor propietatiile potrivite copului urmarit si ce se intampla in timpul tratamenteor respective?
Prin tratamente termice si mecanice se pot imprima metalelor propietatiile potrivite scopului urmarit.
Operatiile folosite in industria metarlugica (laminarea, presare, calire, forjare). Determina modificarea controlata a structuri policristaline a metalelor; cristalitele isi modifica forma, orientarea si dimensiunea. Aceste schimbari structurale arata ca la temperature ridicate atomi difuzeaza schimband structura in reteaua cristalina.
11.Cum sunt distribuiti electronii intr-un crystal metalic, comparative cu cei dintr-un atom liber?
Intr-un crystal metalic, distributia electronilor este diferita de aceia din atomi liber ; intr-un atom liber, electroni sunt reprezentati pe anumite nivele de energie in anumiti orbitali. In cazul metalului compact, numai electroni mai apropiati de nucleu se gasesc in orbitali care se extend pe toti atomi din cristale. In acest fel, nivele superioare de energie se contopesc formand ,, benzi de energie". Electronul din aceste benzi de energie mai putin atrasi de nucleu, sunt mai mobile si apartin in oarecare masura tuturor atomilor.
12.Explicati opacitatea metalelor.
Opacitatea metalelor sunt opace , ele nu sunt transparente nici cand se afla sub forma de foite, deoarece lumina care vine in contact cu metalul intalneste electroni mobili din structura acestuia (din benzile de energie) si este fie reflectata fie absorbita dar nu este transmisa (nu trece prin metale).
13.Explicati conductibiltatea electrica a metalelor.
Conductibilitatea electrica- datorita existentei electronilor mobile din benzile de energie, metalele au propietatea de a conduce curent electric. Daca se aplica o diferenta de potential la extremitati unui bucati de metal(fir sau placa), electroni mobile din reteaua metalica se deplaseaza ordonat in directia egalzari potentialului.(metalele cu cea mai buna conductibilitate electrica sunt argintul, cuprul, aurul si aluminiul).
14.Ce este plastcitatea metalelor.
Plasticitatea este o propietate mecanica a metalelor, care le permite sa sufere de formari permanente sub actiunea unor forte exterioare, fara sa se rupa reteaua cristalina. Unele metale pot fi trase in fire(ductibilitate) prin operati de filare sau in foi( maleabilitate) prin operatia de laminare. Deoarece plasticitatea creste cu temperature, metalele sunt incalzite pentru a fi prelucrate mechanic.
15. Ce sunt aliajele si de cate tipuri sunt? Exemplificati.
Aliajele sunt materiale metalice obtinute prin difuzia in starea topita a doua sau mai multor metale; uneori rezulta din metale cu adausuri de nemetale.
Aliajele sunt de 2 tipuri: -omogene (sol solide)-aur, argint, aur-argint-cupru, Fe-Ni
-eterogene.
16.Din ce motiv unele substante sunt amorfe? Exemplificati.
Substantele amorfe spre deosebire de subst. solide cristalizate, au particulele componente (macromolecule sau macroioni) in stare de dezordine aproape completa.
CAP.3.Procese Chimice
1. Ce sunt reatiile chimice? Cum se numesc participanti la reacti chimica?
Reactiile chimice sunt procesele in urma carora unele substante se transforma in alte substante.
Substantele care reactioneaza (intra in reactie) se numesc reactanti. Subst rezultate din reactie (care ies din reactie) se numesc produsi de reactie.
2.Enumerati legea conservarii masei in reactiile chimice. Exemplificati
In orice reactie chimica suma maselor substantelor care intra in reactie este egala cu suma masei subts. obtinute din reactie.
Ex: 2H + O →H2O, 2g hydrogen + 16 g oxygen=18g de H2O
3.Cu ce se
ocupa stoechiometria reactiilor chimice? Ce sunt coeficientii stoechiometrici
si de unde reies valorile lor?
Stoechiometria se ocupa cu stabilirea
rapoartelor cantitative dintre participanti la reactia chimica. Numerele
asezate in fata formulelor chimice se numesc coeficenti stoechimiometrici.
Valorile lor reies din legea conservari atomilor si lean conservari masei.
2moli de H reactioneaza cu un mol de O si rez 2 moli de H2O
CAP.4.Legile Gazelor
1.Aplicatii utilizand relatiile (4.2)-(4.5)
2.Aplicatii utilizand relatia (4.6).
CAP.5.Solutii
1.Ce sunt solutiile? Din ce componente sunt constituite?
Solutia este un system omogen (monofazic) format din doua sau mai multe componente: -componenta care se dizolva aflata de obicei in proporti mai mare numit solvent sau dizolvat.
-componenta care se dizolva aflata de obicei in proporti mai mica numita solvent sau dizolvat; o solutie poate sa contina una sau mai multe componente dizolvate.
2.Ce exprima concentratia unei solutii?
Concentratia unei solutii exprima raportul dintre componente dizolvate si solutie (system) sau uneori raportul dintre compoenta dizolvata si solvent.
Componenta dizolvata/solutie system sau comp. dizolvate/solvent.
3. Calculati concetratia procentuala a solutiei obtinute prin dizolvarea a 40g NaCl in 460 g apa.
c % =m dizolvat/ m solutie · 100% = mNaCl / mNaCl + m H20 ·100=
=40/500 ·100 =8 %
4.Calculati concentratia molara a solutiei obtinute prin dizolvarea a 5,85 g NaCl in apa; volumul solutiei obtinute este de 500 cm(cubi). Se dau ANa(cu Na la indice) = 23 si ACl= 35,5.
c= m dizolvat/ M dizolvat · V solutie = mNaCl/ MNaCl·V solutia=
→mNaCl = 5,85 g
→MNaCl =ANa + ACl = 23+ 35,5 =58,5 g /mol
V solutie = 500 cm(cubi) = 0,5 L
c= 5,85 g /58,5 g/mol · 0,5 =..
5. Ce intelegeti prin solubilitatea uneisubstante intr-un solvent?
Valoarea concentratiei de saturatie sau de echilibru a subst. dizolvate , la o anumita temperature se numeste solubilitate.(S , sau cs(cu s la indice)).
Sau- solubilitatea reprezinta cantitatea de substanta care se poate dizolva la o temperature data intr-o anumita cantitate de substanta.
6.[factori care influenteaza solubilitatea substantelor. Natura solventului si a substantei diolvate]. In ce sovent se dizolva mai usor naftalina: in apa sau in benzen? Dar acidul clorhidric? Justificati.
Natura solventului si a subst. dizolvate.
-sa constatat experimental ca aceiasi subs. Are solubilitati diferite in solventi diferiti.; de asemenea subst. diferite au solubilitati diferite in acelasi solvent.
Ex: la 16 s C: naftalinei 32g/ 100g toluene
Naftalinei 5,3 g / 100g alcohol etilic
la 16 s C:iodului I2(cu 2 la indice) 5,9· 10 la minus 3 /100g alcohol etilic.
O subst. se dezolva mai usor in solventi cu care se aseamana structural:
-subst. polare se dizolva mai usor in solventi polari(de ex: HCl in apa)
-subst. nepolare se dizolva mai usor in solventi nepolari( de ex: naftalina in toluene)
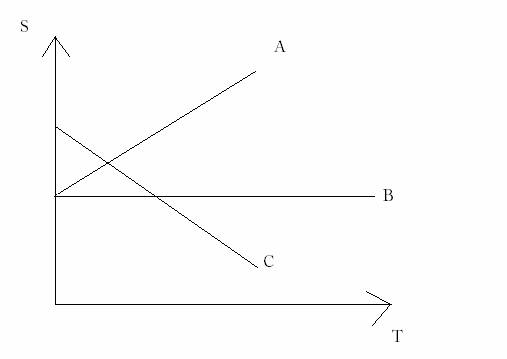
7. [factori care influenteaza solubilitatea substantelor. Temperatura] reprezentati graphic curbele de solubilitate pentru subst A.B,C stiind ca :.