
|
|
|
Chemiluminescenta (CL) este emisia de radiatie electromagnetica (luminiscenta) fara emisie de caldura ca rezultat al unei reactii chimice dintre un analit A si un reactiv R, cu formarea unui intermediar excitat care se poate scrie:
[A] + [R] → [Intermediar*] → [Produsi] + radiatie
Revenirea compusului Intermediar* din starea excitata* pe un nivel energetic mai coborat este responsabila de emisia de radiatie. Desi raditia poate fi eliberata, in principiu, in domeniul UV, VIS sau IR, emisia de radiaitie vizibila este cea mai obisnuita si utila.
Specificarea ambigua "produsi" din reactia de mai sus este adesea necesara datorita naturii si complexitatii reactiei. Pentru chimistul analist, in majoritatea cazurilor, ambiguitatea legata de adevaratii produsi de reactie nu este importanta, deoarece el este interesat de sensibilitatea instrumentului (adica limitele de detectie pentru analitii de interes), de selectivitate (adica raspunsul dat de un analit este comparat cu cel al unui compus interferent) si domeniul liniar al raspunsului.
In teorie, pentru fiecare molecula de reactant este emis un foton de radiatie, sau numarul lui Avogadro de fotoni per mol. In practica, reactiile ne-enzimatice nu au eficienta cuantica, QC, mai mare de 1%.
In general o reactie de CL poate decurge prin doua mecanisme si anume:
□ printr-o reactie directa dintre un substrat (S) care este precursorul de chemiluminiscenta si un oxidant (Ox), in prezenta sau absenta unui catalizator (C) care poate fi un ion metalic sau o enzima, cu formarea unui produs sau intermediar (P). O parte din acest compus P se afla intr-o stare excitata (P*) care ulterior revine in starea fundamentala prin emisie de fotoni (hν).
■ printr-o reactie indirecta bazata pe transferul energiei de la specia excitata (P*) la un fluorofor (chemiluminiscenta sensibilizata sau chemiluminiscenta cu transfer de energie) care este astfel excitat si prin dezexcitare emite fotoni.
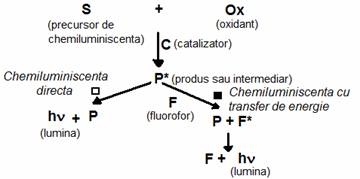
Reprezentarea schematica a celor doua mecanisme de baza de producere a reactiilor de CL
Cerinte pentru emisia de chemiluminiscenta.
Pentru ca o reactie chimica sa produca lumina ea trebuie sa indeplineasca urmatoarele conditii:
1. Reactia trebuie sa fie exoterma pentru a produce energie suficienta pentru a forma stari excitate. Aceasta conditie este satisfacuta de reactii redox ce implica oxigen sau apa oxigenata sau oxidanti cu potential similar. Deoarece majoritatea reactiilor de chemiluminiscenta produc fotoni in domeniul vizibil formarea starii electronice excitate si generarea chemiluminiscentei in acest domeniu spectral necesita aprox 40-70 kcal. mol-1.
2. Calea de reactie trebuie sa fie favorabila formarii unei stari electronice excitate, de ex. reactia nu va fi chemiluminiscenta daca energia de reactie se pierde sub forma de caldura
3. Emisia de fotoni trebuie sa fie o cale favorabila de dezexcitare a produsului excitat comparativ cu alte procese neradiative competitive de dezexcitare (izomerizare, transfer intramolecular de energie, reactii chimice cu alte specii, disociere moleculaza, etc.) care pot aparea in proportii mici.
Factori ce influenteaza emisia de chemiluminiscenta
Deoarece intensitatea de chemiluminiscenta depinde de numerosi parametrii masurarile de chemiluminiscenta sunt influentate de diferiti factori experimentali ca de ex.:
1. Structura chimica a precursorului de CL
2. Natura si concentratia altor substraturi ce influenteaza calea de CL si ar putea favoriza alte procese neradiative
3. Catalizatorul
4. Temperatura
5. pH-ul si taria ionica
6. Hidrofobicitatea solventului si compozitia solutiei (de ex. randamentul de CL a luminolului in dimetilsulfoxid este de 5 ori mai mare decat in apa iar radiatia emisa are lungime de unda diferita, in DMSO 425 nm (albastru-violet) si in apa 480-500 nm (albastru-verde)).
7. Prezenta acceptorilor de transfer de energie.
Instrumentatia
Faptul ca un proces de chemiluminiscenta este propria sursa de radiatie face ca metodele si instrumentele de analiza sa fie foarte simple. Prin urmare luminometrele :
-o celula de reactie (tub de analiza, celua in flux, microplaca) intr-o carcasa etans pentru radiatie
-un sistem pentru introducerea si amestecarea probei si a reactivului;
- un detector de radiatie cum ar fi tubul fotomultiplicator, fotodiode sau sau in cazul cel mai simplu un film fotografic sau de raze X sau chiar detector visual;
-un sistem de achizitie si procesare a semnalelor.
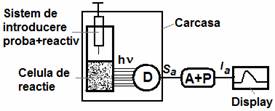
Reprezentarea schematica a unui chemiluminometru D=detector; A+P=sistem de achizitie si prelucrare a semnalelor; Sa = semnal analitic; Ia = informatie analitica
Semnalul analitic in tehnicile CL
In tehnicile CL dupa amestecarea reactivilor cu proba incepe reactia de CL si se produce radiatie, intensitatea acesteia scazand pe masura ce se consuma reactivii ceea ce implica un caracter tranzitoriu al emisiei de CL, a carei durata depinde de reactia specifica si care poate fi de la un flash scurt la o radiere lunga. Acest lucru este important pentru alegerea sistemului optim de reactivi.
In functie de situatie, semnalul analitic poate fi luat ca intensitatea maxima de CL (inaltimea picului), semnalul dupa un timp fix de la punctul de amestecare, integrarea semnalului pe o anumita perioada, sau integrarea intregului pic (fig. ). Toate acestea sunt corelate cu concentratia analitului.
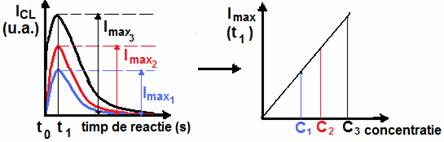
Variatia intensitatii de CL cu timpul (a) si curba de etalonare (b) pentru masurari de CL.
Reactii de chemiluminiscenta
Reactiile de chemiluminiscenta pot fi grupate in trei categorii:
Reactiile de chemiluminiscenta si bioluminiscenta implica de obicei scindarea sau fragmentarea legaturii O-O dintr-un compus peroxidic organic. Peroxizii, in special peroxizii ciclici, sunt predominanti in reactiile emitatoare de lumina deoarece legatura peroxidica slaba este scindata usor iar reorganizarea moleculara rezultata elibereaza o cantitate mare de energie.
Una dintre secventele de reactie propuse pentru reactia peroxioxalatilor, pentru care bis(2,4,6-triclorofenil) oxalatul esterul difenilic al acidului oxalic, Cyalume®, sau TCPO) este exemplul cel mai proeminent, implica reactia dintre TCPO (combustibil) si H2O2 (oxidant) pentru a produce un intermediar, in acest exemplu 1,2 -dioxetandiona dar au fost propusi si altii, ca hidroperoxioxalat
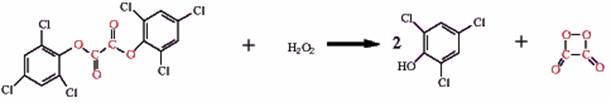
bis(2,4,6-triclorofenil) oxalat (TCPO) Apa oxigenata 2,4,6-triclorfenol 1,2-dioxietandiona
(combustibil) (oxidant) (intermediar)
Intermediarul, aici 1,2-dioxetandiona, nu emite deloc lumina dar in schimb ea reactioneaza cu un alt compus, adesea un compus viabil drept colorant fluorescent (fluorofor), de ex. 9,10-difenilantracen (DPA), cu formarea produsului excitat care emite rapid lumina. Spectrul de emisie al DPA ca fluorofor prezinta maximul de emisie la 425 nm similar cu emisia de fluorescenta normala a DPA.
a) b)
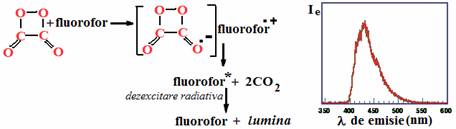
Reactia dioxetandionei cu 9, 10-difenilantracen (a) si spectrul de emisie al difenilantracenului ca fluorofor de chemiluminiscenta (b
Pentru a avea aplicabilitate practica reactiile oxalatilor, de ex, in HPLC, necesita un sistem mixt de solventi (tampon/solvent organic) pentru a asigura solubilitatea reactivilor, un pH optimizat, si permite compatibilitatea cu analitii.
In sistemul TCPO descris mai sus viteza de descompunere, constanta de crestere, intensitatea maxima a luminii si eficienta cuantica depind de concentratia apei oxigenate.
Procesul de transferare a energiei reactiei initiale, reactia chimica dintre apa oxigenata si TCPO, spre emisia de lumina de la fluoroforul in stare excitata (fluorofor*) poate fi urmarit pe tot parcursul procesului, prin pierderile in fiecare etapa a procesului: oxidarea initiala pentru a produce intermediarul, reactia intermediarului cu un fluorofor si reactia fluoroforului excitat pentru a produce lumina.
Oxidarea initiala poate produce:
Intermediarul cu energie ridicata:
In cele din urma, fluoroforul excitat poate:
J pierde energie prin emisia de lumina sau
L fi dezexcitat prin producerea de caldura in locul luminii.
 Difeniloxalatul
daca este utilizat intr-un stick luminescent (lightstick sau glowstick),
emite radiatie prin chemiluminiscenta unui colorant fluorescent
(numit sensibilizator) activat de Cyalume®
ce reactioneaza cu apa oxigenata in cea mai eficienta reactie
ne-enzimatica cunoscuta.
Difeniloxalatul
daca este utilizat intr-un stick luminescent (lightstick sau glowstick),
emite radiatie prin chemiluminiscenta unui colorant fluorescent
(numit sensibilizator) activat de Cyalume®
ce reactioneaza cu apa oxigenata in cea mai eficienta reactie
ne-enzimatica cunoscuta.
Cyalume® + H2O2 + colorant → fenol + 2CO2 + colorant*
Cand colorantul fluorescent activat revine pe un nivel energetic mai coborat se emite radiatie. Culoarea depinde de colorant.
Culoare
Sensibilizator
Albastru
9,10-Difenilantracen
Verde
9,10-Bis(feniletinil)antracen
Galben-verzui
Tetracen
Galben
1-Cloro-9,10-bis(feniletinil)antracen
Portocaliu
5,12-Bis(feniletinil)-naftacen, Rodamina 6G
Rosu
Rodamina B
2. Chemiluminiscenta luminolului
Luminolul (5-amino-2,3-dihidro-1,4-ftalazindiona), un alt reactiv chemiluminiscent larg utilizat este considerat drept "combustibil" in reactia care genereaza 3-aminoftalat (3-APA) ca specie emitatoare (fig. a). Spectrul de emisie 3-APA in reactia chemiluminiscenta a luminolului este prezentat in figura b (Ie = intensitatea radiaitiei de chemiluminiscenta).
a) b)
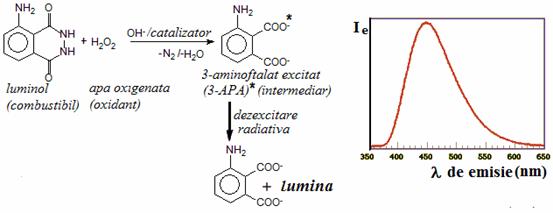
Reactia de chemiluminiscenta a luminolului (a) si spectrul de emisie al 3-APA (b).
Desi oxidantul cel mai utilizat este apa oxigenata similar cu chemiluminiscenta peroxioxalatului au fost utilizati si alti oxidanti ca
perborat,
permanganat,
hipochlorit si
iod.
Emisiei radiatiei de chemiluminiscenta a 3-APA rezultat in reactia de oxidare a luminolului cu apa oxigenata este aproape instantanee si atingeun maxim in cateva secunde.
Dupa cum profilul de timp al emisiei luminolului (Ie = intensitatea radiatiei emise exprimata in unitati arbitrare) intensitatea luminii scade la aproximativ 50% din valoarea maxima dupa aproximativ 8 s iar atat intensitatea initiala cat si viteza de scadere a acesteia in acest tip de sistem au fost dependente de continutul de Cu(II).
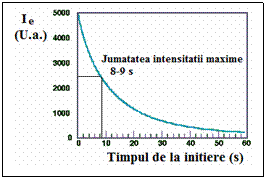 Profilul
de timp al emisiei luminolului (Ie = intensitatea radiatiei emise
exprimata in unitati arbitrare)
Profilul
de timp al emisiei luminolului (Ie = intensitatea radiatiei emise
exprimata in unitati arbitrare)
Analitii derivatizati cu luminol permit determinarea compusilor care normal nu ar prezenta chemiluminiscenta in acest sistem si probabil au emitatori usor diferiti
Multi cationi metalici (cel mai sensibil este cobaltul(II)) catalizeaza reactia dintre luminol, H2O2, si OH- in solutie apoasa pentru a mari emisia de lumina sau cel putin de a mari viteza oxidarii pentru a produce emitatorul (un complex metal peroxid) si prin urmare inceputul/intensitatea producerii de lumina. Prin urmare aceasta poate fi baza unor determinari analitice semnificativ diferite. De ex, sistemul poate fi utilizat la determinarea:
Aceasta ultima aplicatie este o caracteristica importanta a acestui sistem deoarece multi compusi de ex. amino acizii, fructoza, glicerolul, tiolii, si albumina serica formeaza complecsi cu cationi metalici si astfel pot fi determinati utilizand chemiluminiscenta luminolului.
Reactia de chemiluminiscenta
a luminolului a fost studiata folosind diferite peroxidaze drept catalizator.
Numerosi compusi fenolici, unele amine aromatice, anumiti heterociclii, in particular benzotiazoli, si acizi acrilboronici functioneaza ca amplificatori in reactiile de oxidare mediate de peroxidaze. Compusii din ultima grupa actioneaza probabil prin intermediul conversiei la fenol prin reactia in situ cu peroxidul de hidrogen.
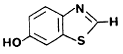
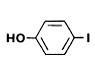
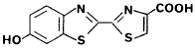
6-hidroxibenzotiazol p-iodofenol (p-PI) dehidroluciferina
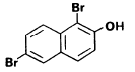
![]()
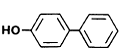
p-fenilfenol (p-PP) 1,6-dibrom-2-naftol 4-benziloxianilina
Molecule capabile de a amplifica emisia de radiatie
produsa in reactia de oxidare a luminolului catalizata de
Eficacitatea unui amplificator pare a fi bazata, in principiu, pe potentialul sau de oxidare in conditiile de reactie si relatia sa cu potentialul de oxidare al substratului detectabil
In prezenta amplificatorilor, emisia de radiatie scade lent (dureaza cateva minute) iar intensitatea sa poate fi de pana la 1000 ori mai mare decat in reactia neamplificata
Amplificatorii actioneaza sinergetic in reactia dintre luminol si peroxid catalizata de peroxidaze. Gradul de amplificare depinde de:
identitatea amplificatorului; de ex. p-indofenolul duce la o amplificare de pana la 2500 ori a emisiei de radiatie, comparativ cu reactia neamplificata
pH; amplificare semnificativa are loc intre pH 7 si 9,5 , valoarea maxima atingandu-se in jur de pH 8,6;
concentratia amplificatorului; amplificatorii prezinta o concentratie optima pentru amplificare iar adaos mai mare de amplificator la reactia peroxidaza-luminol-peroxid scade gradul de amplificare.
Spectrele de emisie ale reactiilor amplificate si neamplificate sunt foarte similare sugerand ca amplificatorii nu actioneaza ca emitatori mai eficienti dar isi exercita actiunea mai rapid in reactia complexa dintre peroxidaza, oxidant si luminol
Solutii continand ioni de mangan (
Una dintre cele mai eficiente substante
chemiluminiscente, lucigenina (azotat de
bis-N-metilacridina) prezinta o emisie verde foarte stralucitoare
care trece in emisie albastru-verzuie si in final albastra cand este
oxidata in mediu alcalin. In conditii optime durata emisiei poate fi
de pana la cateva minute. 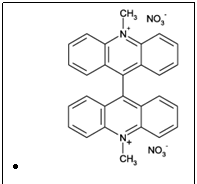
In timp ce luminolul reactioneaza cu o varietate de specii reactive ale oxigenului (H2O2, O2-, OH) chemiluminiscenta lucigeninei este mai specifica pentru anionul superoxid si astfel este larg utilizata ca metoda de analiza a producerii enzimatice de superoxid in multe sisteme biologice.
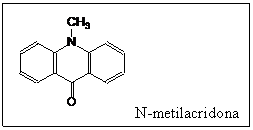 S-a aratat ca alti
derivati de acridina produc emisie de chemiluminiscenta la
oxidarea cu apa oxigenata in mediu apos alcalin. Principalul produs
de reactie, N-metilacridona, un intermediar activ, este de asemenea foarte
cunoscut printre reactiile de chemiluminiscenta.
S-a aratat ca alti
derivati de acridina produc emisie de chemiluminiscenta la
oxidarea cu apa oxigenata in mediu apos alcalin. Principalul produs
de reactie, N-metilacridona, un intermediar activ, este de asemenea foarte
cunoscut printre reactiile de chemiluminiscenta.
Una dintre cele mai vechi reactii de chemiluminiscenta cunoscute este cea a fosforului elementar alb care se oxideaza in aer umed generand o incandesceta verde. Aceasta este de fapt o reactie in faza gazoasa a vaporilor de fosfor, deasupra solidului, cu oxigenul. Mecanismul acestei reactii nu a fost inca elucidat complet.
In flacari bogate in hidrogen, bioxidul de sulf si alti compusi ai sulfului prezinta emisie de chemiluminiscenta datorita sulfului elementar excitat produs:
SO2 + 2H2 → S + 2H2O
S + S → S2*
S2* →S2 + lumina (300-425 nm)
Prin aceasta metoda compusi ai sulfului au putut fi determinati la nivel de cateva ppm.
Urmatoarea secventa de reactie de chemiluminiscenta intre bioxidul de sulf si oxigen a fost propusa pentru analiza SO2 la nivel de 0,001 ppm.
O + O + SO2 → O2 + SO2*
SO2* → SO2 + lumina (280 nm)
Dezavantajul metodei consta in dificultatea gasirii unei surse stabile de atomi de oxigen.
Detectia monoxidului de azot cu instrumentele analitice comerciale utilizate pentru testarea calitatii aerului se bazeaza pe reactia in faza gazoasa in care ozonul (O3) se combina cu NO pentru a forma bioxid de azot intr-o stare activata (notata cu *) care revine la o stare energetica inferioara prin emisia partiala de fotoni de radiatie electromagnetica cu un domeniu spectral larg, de la vizibil pana in IR (lungimile de unda sunt centrate in jur de 1200 nm).
NO + O3 → NO2* + O2
NO2* → NO2 + lumina (600-2800 nm)
Cuvantul "partiala" arata ca exista doua cai prin care NO2 din starea excitata se poate dezexcita: prin emisie de fotoni (chemiluminiscenta) sau prin pierderea de energie prin coliziuni cu alte particule. Deoarece numarul colizionilor din faza gazoasa este mai mic la presiuni mai mici pentru reducerea pierderilor de energie prin ciocnirea moleculelor, majoritatea reactiilor de chemiluminiscenta in stare gazoasa au loc la presiune mica (~1 torr) mentinuta cu ajutorul unei pompe de vid. Astfel numarul de dezactivari prin ciocniri scade si creste cantitatea de energie eliberata prin emisie de fotoni.
Un tub fotomultiplicator si alte componente electronice asociate numara fotonii al caror numar este proportional cu cantitatea de NO prezenta in aer. Pentru determinarea cantitatii de NO2 dintr-o proba ce nu contine NO, inainte de a se aplica reactia de activare cu ozon NO2 trebuie transformat in NO, prin trecerea probei printr-un convertor. Reactia cu ozon produce un numar de fotoni proportional cu NO care este proportional cu NO2 inainte ca acesta sa fie transformat in NO. In cazul unei probe de aer mixte, continand atat NO cat si NO2, reactia de mai sus da suma NO+ NO2 daca proba este trecuta prin convertor. Daca proba mixta nu este trecuta prin convertor reactia cu ozon produce NO2* activat doar intr-o cantitate proprotionala cu NO din proba. NO2 din proba nu este activat de reactia cu ozon. Desi NO2 neactivat este prezent cu NO2* activat, doar specia activata emite fotoni al caror numar este proportional cu NO initial din proba. In final se scade NO din (NO + NO2) pentru a obtine NO2.
Aceasta reactie este folosita pentru determinarea de rutina fie a ozonului (utilizand exces de NO) sau a NO (folosind exces de O3).
In chemiluminiscenta in faza gazoasa producerea luminii are loc aproape instantaneu; de aceea, majoritatea sistemelor analitice amesteca pur si simplu analitii si reactivul intr-o camera cu volum mic direct in fata tubului fotomultiplicator. Daca analitii sunt eluati dintr-o coloana a unui cromatograf de gaze atunci adesea capatul coloanei este prins direct in camera de reactie (fig. ).
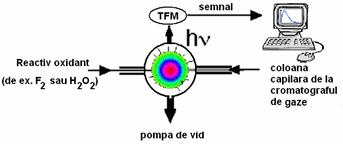
Fig. Reprezentarea schematica a unui detector GC de chemiluminiscenta (TFM=tub fotomultiplicator)
Reactia licuriciului are cea mai mare eficienta cuantica cunoscuta pentru reactii de chemiluminiscenta, QC de 88%. ATP (adenozin tri-fosfat), sursa biologica de energie omniprezenta reactioneaza cu luciferina pentru a forma un complex intermediar care se combina cu oxigen pentru a produce un compus puternic chemiluminiscent.
|
|
Luciferina bacteriala este un fosfat de riiboflavina redusa (FMNH2) care este oxidat in asociere cu o aldehida cu catena lunga, oxigen si o luciferaza. |
|
|
Luciferina dinoflagelatelor se considera ca derivand de la clorofila si are o structura foarte similara. In Gonyaulax, la pH 8 molecula este "protejata" de o "proteina ce leaga luciferina", dar daca pH-ul este scazut in jur de 6, luciferina libera reactioneaza si se produce lumina. |
|
|
Coelenterazina este cea mai 'populara' dintre luciferinele marine. Aceasta molecula apare in majoritatea sistemelor luciferina-luciferaza si este renumita ca fiind emitatorul de lumina a fotoproteinei 'aequorin'. |
|
|
Luciferina din licurici se utilizeaza intr-un sistem luciferin-luciferaza care necesita ATP drept cofactor. Din aceasta cauza poate fi utilizat ca bio-indicator al prezentei energiei sau "vietii". |
Instrumentatie
Pot fi dezvoltate instrumente pentru a masura bioluminiscenta, alaturi de alte caracteristici ale oceanului cum ar fi temperatura, salinitatea, transmisia optica si fluorescenta stimulata.
Aceasta informatie poate fi utilizata pentru a crea mape bi- si tridimensionale de bioluminiscenta din ocean.
Caracteristici ale spectrometriei bazata pe chemiluminiscenta comparativ cu alte tehnici spectrometrice
1.
Chemiluminiscenta, ca si spectrometria de
emisie atomica (
2. Majoritatea probelor nu au semnal de fond, adica nu emit ele insele, astfel ca nu exista semnale interferente care sa limiteze sensibilitatea.
3. Masurarea chemiluminiscentei nu este o masurare a unui raport asa cum este cazul fluorescentei sau a absorbtiei. In fluorescenta acest lucru poate duce la dificultati cu compusii care prezinta o deplasare Stokes mica. Fluorescenta ar putea fi greu de rezolvat de lungimea de unda de excitare iar in masurarile absorbtiometrice factorul ce limiteaza sensibilitatea este necesitatea de a masura o diferenta mica intre doua semnale relative mari.
In masurarile de chemiluminiscenta trebuie insa ca raspunsul spectral al sistemului de detectie sa fie cat mai aproape de spectrul CL pentru ca sensibilitatea determinarilor sa fie maxima.
4. Spre deosebire de tehnicile bazate pe fotoluminiscenta in cele de CL nu este necesara o sursa externa de radiatie ceea ce ofera urmatoarele avantaje:
-instrumentatie simpla;
-absenta problemelor legate de instabilitatea sursei de radiaitie;
-absenta fenomenului de imprastiere a radiaitiei incidente pe detector
-reducerea interferentelor datorate proceselor neselective de excitare.
Majoritatea tehnicilor de chemiluminiscenta implica doar cateva componente chimice pentru a genera cu adevarat lumina.
5. Selectivitatea si liniaritatea depind in principal de reactie si de conditiile de reactie in timp ce la procesele de fotoluminiscenta absorbtia si/sau emisia de radiatie de catre alti compusi (produsi, intermediari, componente ai matricei) pot determina interferente si neliniaritate.
6. In functie de natura analitului si a reactiei CL cresterea sau scaderea intensitatii CL depinde direct de concentratia analitului.
7. Desi nu este asa de larg aplicabila ca spectroscopia bazata pe excitare, chemiluminometria este foarte sensibila si prezinta un domeniu liniar mare. Daca randamentul cuantic este mare se pot atinge limite de detectie in domeniul femtomolar (de ex. in solutie se poate detecta sub 1 fmol fluorofor daca se utilizeaza CL peroxioxalatilor si sub 0,1 fmol daca se foloseste luminol). Limitele de detectie pentru metodele de chemiluminiscenta pot fi de 10 pana la 1000 ori mai coborate decat pentru alte tehnici de luminiscenta. In general CL este de aproximativ 105 ori mai sensibila ca tehnicile bazate pe absorbtie si de cel putin 103 ori mai sensibila ca fluorimetria.
Limitarea principala a limitelor de detectie ce pot fi atinse prin chemiluminiscenta implica curentul rezidual (de fond) al detectorului (de ex. tubul fotomultiplicator) necesar pentru a detecta emisia de radiatie a analitului.
8. Tehnica este versatila pentru determinarea unei varietati mari de compusi care pot fi implicati in reactii CL cu mar fi:
- substratul de CL sau precursorul CL care este responsabil de generarea starii excitate;
- reactivul (de obicei un oxidant) necesar reactiei de CL
- specii care influenteaza viteza reactiei CL (activatori, catalizatori -enzime sau ioni metalici, inhibitori - reducatori)
- fluorofori in CL sensibilizata
- specii ce pot fi derivatizate cu precursori de CL sau florofori
- specii care un participa direct la reactia de CL dar genereaza sau consuma, in alta reactie, un compus ce va fi implicat in reactia de CL
9. Reactiile CL pot fi cuplate ca mijloc de detectie in tehnicile cromatografice, imunoanaliza, electroforeza capilara, furnizand informatii calitative si cantitative despre o gama larga de specii