
|
|
|
Spectrele de absorbtie din domeniul vizibil si ultraviolet implica tranzitiile electronilor intre starea fundamentala si o stare electronica excitata a moleculelor, fiind permise tranzitiile intre orbitale moleculare de acelasi tip si care au loc cu conservarea spinului electronic (DS = 0). Cu alte cuvinte vor fi permise numai tranzitiile intre stari de aceeasi multiplicitate (2S+1), fiind interzise de exemplu tranzitiile singlet-triplet.
Intensitatea benzilor de absorbtie depinde de
probabilitatea producerii tranzitiilor electronice implicate in
absorbtia energiei. Pe langa conservarea spinului, exista
anumite reguli de selectie, tranzitiile permise de aceste reguli conducand la absorbtii
caracterizate prin coeficienti molari de extinctie e, definiti de relatia (IV.16), cu
valori cuprinse intre 104 - 105 ![]() , tranzitiile "interzise" avand coeficienti molari de extinctie cuprinsi intre
, tranzitiile "interzise" avand coeficienti molari de extinctie cuprinsi intre
1-103 ![]() . De aceea aceste reguli trebuiesc luate in sensul
probabilitatii de tranzitie intre doua stari.
. De aceea aceste reguli trebuiesc luate in sensul
probabilitatii de tranzitie intre doua stari.
Conform regulilor de selectie sunt interzise tranzitiile intre stari care au aceeasi simetrie a distributiei electronice. O masura a variatiei distributiei sarcinii electronice la trecerea de la starea fundamentala la cea excitata este momentul de tranzitie , astfel ca regula de selectie prevede obligativitatea existentei unui moment de tranzitie diferit de zero pentru ca tranzitia sa fie admisa. Probabilitatea tranzitiei, deci si intensitatea benzii de absorbtie este proportionala cu patratul momentului de tranzitie.
Majoritatea benzilor de absorbtie se datoreaza unor tranzitii in care sunt implicate modificari ale momentului electric de dipol. Momentul de tranzitie este caracterizat nu numai prin marimea dar si prin directia sa in molecula, directie ce trebuie sa coincida cu directia vectorului electric al radiatiei excitatoare. In stare gazoasa sau lichida vor exista in permanenta molecule pentru care aceasta conditie este indeplinita. Daca se lucreaza in stare solida si se foloseste lumina polarizata, datorita pozitiei fixe a moleculelor se obse5rva o variatie a absorbtiei in functie de orientarea vectorului electric (fenomenul de dicroism).
Tipurile de tranzitii electronice caracteristice spectrometriei in ultraviolet si vizibil (UV-VIS ) sunt prezentate in Figura IV.11 .
Tranzitiile σ → σ au loc la absorbtia radiatiilor luminoase din domeniul ultravioletului de vid (λ ~ 180 nm) domeniu greu accesibil din punct de vedere experimental.
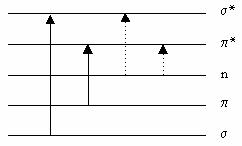
Figura IV.11 Schema tranzitiilor electronice
Tranzitiile π → π sunt caracteristice legaturilor delocalizate, benzile corespunzatoare acestor tranzitii sunt relativ intense (εmax > 104) si sunt puternic influentate de marimea portiunii conjugate a moleculei.
Tranzitiile n → σ si cele n → π sunt situate la lungimi de unda mai mari decat benzile σ → σ , respectiv π → π si sunt de intensitate mai mica (εmax < 102) deoarece corespund la tranzitii electronice teoretic interzise. Ele sunt mai putin influentate de dimensiunea moleculei, orbitalele n, corespunzatoare electronilor neparticipanti, fiind localizate pe heteroatomi.
Deci, numai compusii care au legaturi π vor prezenta benzi de absorbtie inUV-VIS
Dupa cum s-a mai aratat (Figura IV.1) domeniul ultraviolet cuprinde radiatii cu lungimi de unda l variind intre 100-380 nm, iar cel vizibil intre 380-800 nm. Din punct de vedere practic, al informatiilor ce se pot obtine cu privire la structura moleculara, semnificativ este domeniul 180-800 nm, pentru care sunt construite majoritatea spectrofotometrelor. Regiunea ultravioleta este divizata, din motive experimentale, in doua portiuni distincte: ultravioletul de vid si ultravioletul de cuart.
Ultravioletul de vid, sau ultravioletul indepartat, reprezinta domeniul sub 200 nm , limita sub care oxigenul din aer absoarbe puternic si face imposibile masuratorile in prezenta oxigenului; de aceea se lucreaza in atmosfera de gaz inert (azot sau argon).
Ultravioletul de cuart, sau mai simplu ultravioletul, reprezinta domeniul peste 200 nm; se lucreaza cu optica din cuart care este transparent pentru radiatiile UV, sticla fiind opaca sub 380 nm.
Spectrele electronice sunt cele mai complexe spectre tranzitiile electronice implicand si tranzitii intre nivele de rotatie si vibratie, spectrele avand un caracter de banda.
Absorbtia radiatiilor luminoase de catre molecule are loc conform legii Lambert-Beer (IV.16), respectata in solutii diluate, in lipsa a interactiilor intermoleculare.
Pozitionarea benzilor de absorbtie si intensitatea acestora este influentata atat de natura substituentilor (gruparilor functionala) prezenti in molecula cat si de solventul in care este dizolvat compusul. Efectele intalnite sunt:
Efect batocrom- deplasarea maximelor de absorbtie spre lungimi de unda mai mari;
Efect hipsocrom - deplasarea maximelor de absorbtie spre lungimi de unda mai mici;
Efect hipercrom - cresterea intensitatii de absorbtie;
Efect hipocrom- scaderea intensitatii de absorbtie;
Aceste efecte sunt prezentate schematic in Figura IV.12.
Substituentii care fac ca absorbtia sa aiba loc in UV-VIS sunt grupari cromofore si sunt in general gruparile cu electroni π care pot interactiona cu sistemul de electroni π din restul moleculei, extinzand in felul acesta delocalizarea: -NO2, -NO, -CHO, -COOH.
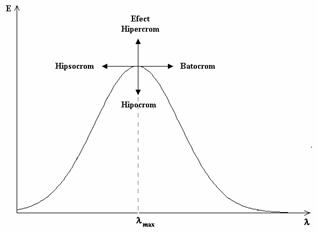
Figura VI.12 Efecte asupra benzilor de absorbtie
Substituentii care alaturi de cromoforii produc atat modificarea pozitiei cat si intensitatea absorbtiei sunt grupari auxocrome. Acestea sunt grupari saturate de atomi de tipul -OH, -NH2, -Cl.
Dintre incercarile de sistematizare si clasificare a benzilor de absorbtie, desi nu unanim recunoscuta trebuie mentionata cea care face urmatoarele diferentieri:
Benzi
R (radicalice) datorita tranzitiilor n → π a unor grupari nesaturate simple
ca >
C = O si - NO2; ![]() fiind benzi
"interzise".
fiind benzi
"interzise".
Benzi
K (conjugate) datorate tranzitiilor π → π in moleculele nesaturate cu legaturi
conjugate; ![]() .
.
Benzi
B (benzenoidice) caracteristice moleculelor aromatice si
heteroaromatice; se prezinta ca niste benzi largi cu coeficienti de
extinctie relativ mici; de exemplu benzenul prezinta o banda
larga, cu tendinta vizibila de structura fina de
vibratie in regiunea 230-270 nm cu ![]() .
.
Benzi E (etilenice) ca si cele B sunt caracteristice tot moleculelor aromatice , fiind atribuite tranyitiilor electronice ale sistemului de trei legaturi duble etilenice intr-o conjugare ciclica.
O alta clasificare foloseste urmatoarea nomenclatura a benzilor: N → V pentru tranzitiile de tip π → π , N → A sau N → Q pentru cele n → π si N → B pentru cele n → s
Spectrele UV ale compusilor aromatici se diferentiaza net de cele ale polienelor, datorita conjugarii specifice starii aromatice.
Benzenul absoarbe in UV la lungimile de
unda 184nm (banda E1, ![]() ), 203nm (banda E2,
), 203nm (banda E2, ![]() ) si 254nm (banda B,
) si 254nm (banda B, ![]() banda
caracteristica de tip B fiind cea
de la 254nm. Aceasta banda este deplasata batocrom la
introducerea unor substituenti ca NH2, OH, NO2, NO,
CHO, COOH, etc. in nucleul benzenic datorita conjugarii electronilor
π sau a celor neparticipanti
cu electronii π ai nucleului aromatic. Astfel banda de tip B
este situata la 270nm la fenol si la 280nm in anilina,
benzaldehida si nitrobenzen.
banda
caracteristica de tip B fiind cea
de la 254nm. Aceasta banda este deplasata batocrom la
introducerea unor substituenti ca NH2, OH, NO2, NO,
CHO, COOH, etc. in nucleul benzenic datorita conjugarii electronilor
π sau a celor neparticipanti
cu electronii π ai nucleului aromatic. Astfel banda de tip B
este situata la 270nm la fenol si la 280nm in anilina,
benzaldehida si nitrobenzen.
Introducerea celui de al doilea substituent conduce la o accentuare a deplasarii batocromice a benzilor π → π , astfel incat la o serie de benzeni substituiti acestea sunt situate in regiunea vizibila a spectrului. Deplasari in acelasi sens se constata si la benzile corespunzatoare tranzitiilor n → π
Benzile de absorbtie din spectrele electronice sunt influentate in pozitie, intensitate si semilatime de solventul folosit. Efectul de solvent este direct legat de gradul de interactine dintre solvent si solvit, modificarile din spectre putand fi puse pe seama interactiilor dipol - dipol, a formarii legaturilor de hidrogen sau a formarii compusilor cu transfer de sarcina.
Deplasarile benzilor electronice datorita efectelor de solvent se explica prin solvatarea diferita a starii fundamentale si a celei excitate, ca rezultat al diferentei in distributia de sarcina in cele doua stari. O deplasare batocroma este cauzata dupa cum se vede in Figura IV.13 de o mai mare solvatare a starii excitate in comparatie cu cea fundamentala, pe cand o deplasare hipsocroma este urmarea unei solvatari mai mari a starii fundamentale.
Efectul de solvent poate fi folosit la determinarea tipului de tranzitie electronica intrucat benzile π → π se deplaseaza batocrom cu cresterea polaritatii solventului in timp ce benzile n → π se deplaseaza hipsocrom la trecerea de la un solvent nepolar la unul polar (Figura IV.13). Solvatarea puternica a nivelelor n se datoreaza interactiei puternice intre dipolii solventului si electronii neparticipanti puternic localizati pe heteroatomi.
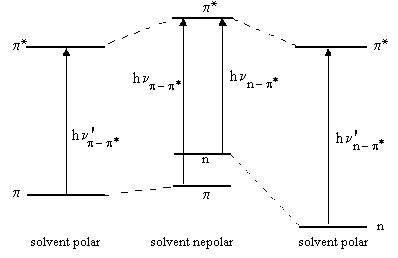
Figura IV.13 Modificarea energiei de excitare datorita efectului de solvent:
hυ'p p < hυp p ; hυ'n-p > hυn-p
Spectrele electronice UV - VIS desi mai putin caracteristice, oferind informatiile generale privind structura moleculara a compusilor, referitoare la prezenta sau absenta in molecula a unor grupari cromofore, joaca totusi un rol important in studiul si elucidarea structurii compusilor organici. Comparativ cu spectrometria IR si RMN, spectrometria UV-VIS are o aplicabilitate mult mai restansa; cu ajutorul spectrelor electronice se pot obtine informatii cu
privire la natura cromoforilor si la pozitia lor relativa fata de alte elemente structurale, se pot trage concluzii cu privire la stereochimia moleculelor, la existenta legaturilor de hidrogen, a efectelor de conjugare, la influenta solventilor. Pe baza compararii a numeroase spectre a unor serii de structuri similare s-a dezvoltat o spectrometrie UV-VIS empirica, ce ofera o serie de informatii cu caracter general privind natura compusilor.
Marele avantaj si aport al spectroscopiei UV-VIS este acela ca ofera o metoda comoda, dar in acelasi timp moderna si performanta, ce se dovedeste de a fi de o mare utilitate in studiile analitice, in studiul vitezelor de reactie si a echilibrelor chimice, in elucidarea mecanismelor de reactie si al interactiilor intermoleculare.