
|
|
|
CERCETARI IN DOMENIUL ARDERII DIFUZIVE A COMBUSTIBILILOR GAZOSI
Pe plan mondial se face puternic simtita ascensiunea turbinelor cu gaze, ca urmare a dezvoltarii tehnologiei de obtinere a unor materiale rezistente la temperaturi inalte, a unor arzatoare perfectionate cu productie redusa de noxe si a sistemelor de racire eficienta a pieselor aflate in zona temperaturilor inalte. Exista o preocupare majora de informare si corelare a cercetarilor europene in cadrul unor programe internationale de tip FP V si FP VI la care a aderat si Romania, prin care se doreste implementarea acestor sisteme moderne de producere a energiei electrice si termice cu un grad ridicat de eficienta si in conditii de maxima protectie a mediului [4, 20, 35, 65, 70, 114].
1.1.1 Ecuatiile fundamentale pentru substantele simple
Pentru substantele individuale aflate intr-o anumita faza, caldurile molare izobare se aproximeaza in functie de temperatura prin expresii polinomiale de forma [4, 20, 35, 65, 70, 114]:
![]() , (1.1)
, (1.1)
sau prin combinatii
liniare ale unor functii ![]() cu
cu ![]() :
:
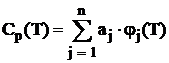 , (1.2)
, (1.2)
Utilizand derivatele entalpiei H si ale entropiei S in raport cu temperatura la presiune constanta:
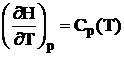 ;
; 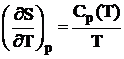 , (1.3)
, (1.3)
Notand temperatura ![]() cu T si inlocuind
relatiile (1.12) si (1.13) in (1.6) si (1.7) obtinem:
cu T si inlocuind
relatiile (1.12) si (1.13) in (1.6) si (1.7) obtinem:
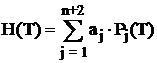 , (1.18)
, (1.18)
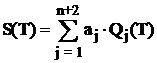 . (1.19)
. (1.19)
1.1.2 Echilibrul chimic
Echilibrul chimic pentru amestecuri de gaze care reactioneaza se defineste in termodinamica chimica pe baza principiului al doilea al termodinamicii, cu ajutorul potentialelor chimice.
Principiul al doilea al termodinamicii se poate exprima sub forma
TdS dH - Vdp,
de unde rezulta, pentru un sistem in care au loc procese la presiune si temperatura constanta:
dGp,T 0, (1.25)
unde: G = H - TS este entalpia libera, sau energia libera Gibbs. Prin urmare, pot avea loc numai procesele insotite de scaderea energiei libere Gibbs; cand energia libera Gibbs atinge valoarea minima, care se mentine in continuare constanta, sistemul se afla la echilibru chimic.
Pentru un amestec de j substante, fiecare in cantitatile vi moli, diferentiala totala dG este in general
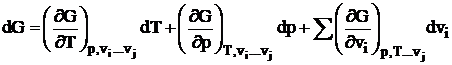 , (1.26)
, (1.26)
unde:
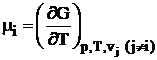 - potentiale
chimice ale componentilor i.
- potentiale
chimice ale componentilor i.
1.1.3 Suprafata de reactie
Ecuatia suprafetei de reactie in flacara difuiziva pentru procesul adiabatic se poate obtine prin rezolvarea ecuatiei [4, 20, 35, 65, 70, 114]:
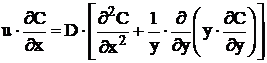 (1.39)
(1.39)
in care 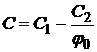 ,
,![]() -sunt
concentratii, iar
-sunt
concentratii, iar ![]() reprezinta
cantitatea de moli de oxigen care reactioneaza cu un mol de gaze
combustibile,cu urmatoarele conditii la limita:
reprezinta
cantitatea de moli de oxigen care reactioneaza cu un mol de gaze
combustibile,cu urmatoarele conditii la limita:
pentru 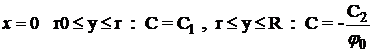
![]() si
si 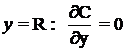 (1.40)
(1.40)
Integrarea ecuatiei (1.39) permite determinarea
interdependentei dintre concentratiile ![]() si
si ![]() in tot spatiul flacarii. Din
conservarea entalpiei totale in orice punct al spatiului
flacarii se obtine relatia:
in tot spatiul flacarii. Din
conservarea entalpiei totale in orice punct al spatiului
flacarii se obtine relatia:
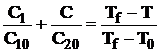 , (1.41)
, (1.41)
In cazul camerei de ardere cilindrice, miscare axial simetrica, din (1.45) cu conditiile (1.40), se obtine solutia:
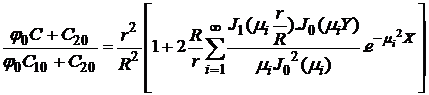 , (1.46)
, (1.46)
in care ![]() reprezinta
radacinile ecuatiei
reprezinta
radacinile ecuatiei ![]() , iar
, iar ![]() si
si ![]() sunt functiile
Bessel de ordinul zero si unu.
sunt functiile
Bessel de ordinul zero si unu.
1.3.1 Calculul parametrilor de stare in vecinatatea punctului Chapman- Jouguet superior (CJs)
In fig. 1.3 se reprezinta variatia presiunii si entropiei, in vecinatatea punctului Chapman-Jouguet superior:
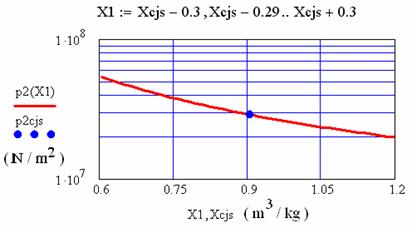
Fig. 1.3 Variatia presiunii in vecinatatea punctului Chapman-Jouguet superior
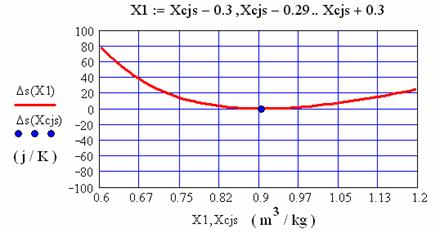
Fig. 1.4 Variatia entropiei in vecinatatea punctului Chapman-Jouguet superior
1.4 Difuzia moleculara unidimensionala nestationara in gaze
Difuzia pura sau moleculara se caracterizeaza prin diminuarea gradientilor de concentratie existenti in limitele unei faze oarecare si se produce prin migrarea atomilor sau moleculelor in lipsa curentilor de convectie.
Difuzia in regim stationar are loc in cazul in care intre doua puncte se mentine o diferenta constanta de concentratie, fenomenul fiind descris de prima lege a lui Fick [4, 20, 35, 65, 70, 114]:
![]() [kmoli/m2s]
, (1.51)
[kmoli/m2s]
, (1.51)
unde J este fluxul de difuzie
(J = const.), D [m2/s] - coeficientul de difuzie, C -
concentratia substantei care difuzeaza (molecule/m![]() ),
), ![]() - gradientul de
concentratie.
- gradientul de
concentratie.
Difuzia in regim nestationar se caracterizeaza prin variatia in timp a fluxului de difuzie si este descrisa de legea a doua a lui Fick
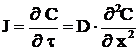 . (1.52)
. (1.52)
Pe baza teoriei cinetice a gazelor se deduce relatia :
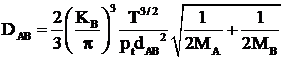 [m/s2] , (1.53)
[m/s2] , (1.53)
unde DAB este coeficientul de difuzie a gazelor A si B care difuzeaza , KB este constanta lui Boltzmann (KB = 1,38 10 - 9) [J/molec*K], dAB - diametrul mediu al moleculelor (dAB = (dA + dB) / 2 [m]) , MA,MB - mase moleculare [Kg/mol] , pt - presiunea totala [N/m2], T - temperatura [K] .
1.5 Stabilizatori de flacara
1.5.1 Scheme de tip Helmholtz
Metoda hodografica a lui S.A.Ciaplighin este aplicabila la problemele de tip Helmholtz si Kirchoff, probleme care pun in evidenta o marime specifica miscarilor care se studiaza si anume viteza caracteristica. Aceasta marime se considera a fi viteza de pe liniile libere, care are o valoare constanta, conform teoriei miscarilor cu linii de discontinuitate, pentru viteze. Teoria de mai sus a fost imaginata, pentru a se indeparta paradoxul lui D'Alembert, care consta in afirmarea lipsei de rezistenta la inaintare a unui corp care se misca intr-un fluid.
Teoria lui Helmholtz, reluata si de Kirchhoff, conduce la valori prea mici pentru rezistenta ce o incearca un solid in miscarea sa prin mediul fluid; acest lucru nu este surprinzator deoarece teoria aceasta neglijeaza complet efectele turbionare care se produc in spatele obstacolului, pe care singura vascozitatea le poate explica si admite doar existenta unei zone in care fluidul este antrenat cu obstacolul.
Teoria lui Helmholtz a fost dezvoltata prin metoda lui Levi-Civita care exprima solutia nedefinita a problemei ca o functionala de una sau mai multe functii q(s), intim legate de forma obstacolului si a peretilor solizi, dar a carei determinare cere rezolvarea unor ecuatii functionale neliniare. A doua problema pe care o pune teoria lui Helmholtz, anume, determinarea miscarii care corespunde unor pereti dati si nu construiti, dupa ce s-au dat functiile q(s), peretii fiind definiti prin ecuatia lor intrinseca, cere rezolvarea ecuatiilor functionale amintite. Astfel ipoteza lui Helmholtz revine la a neglija fenomenele turbionare foarte complicate care se intampla in aceasta regiune si a considera acolo fluidul in repaus, deci legat de obstacol (fig. 1.10)
Fig. 1.10 Modelul lui Helmholtz
Se formeaza astfel in spatele obstacolului
o regiune cu fluid imobil, pe care experienta o confirma pentru
numerele lui Reynoltz foarte mari, iar traiectoriile particulelor fluide (![]() ) detasate de pe frontiera obstacolului nu se vor mai
intalni in spatele acestuia, ci se vor intinde la infinit aval, cu
directii asimptotice paralele cu directia vitezei
) detasate de pe frontiera obstacolului nu se vor mai
intalni in spatele acestuia, ci se vor intinde la infinit aval, cu
directii asimptotice paralele cu directia vitezei ![]() a fluidului, la
infinit amonte (directia generala de miscare a curentului).
a fluidului, la
infinit amonte (directia generala de miscare a curentului).
1.5.4 Modelul Cheng - Kovity
Modelul Cheng si Kovitz, pentru stabilizarea flacarii la spatele obstacolului, este aratat in fig. 1.18.
Vartejul de gaze calde, recirculate la spatele obstacolului, se compune din doi curenti: unul de acelasi sens cu curentul principal in contact cu acest curent, celalalt curgand in sens contrar in apropierea axei sistemului, cu cei doi curenti mentionati [4, 20, 35, 65, 70, 114].
Pentru efectuarea calculelor se presupune ca flacara laminara este ancorata in punctul P la distanta xi de marginea A a obstacolului. Pentru ca in punctul P sa poata sa ia nastere si sa se mentina un front de flacara, este necesar ca aportul de caldura preluata de la frontul de flacara de gazele vartejului pe distanta PS, la care se adauga caldura degajata prin reactiile de ardere din interiorul vartejului, sa fie suficienta sa compenseze pierderile de caldura spre exterior si caldura transmisa pentru aprinderea amestecului combustibil proaspat pe distanta AP.
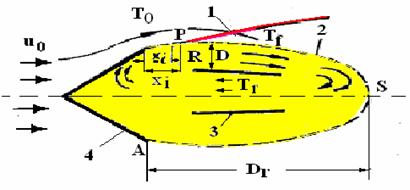
Fig. 1.18 Modelul Cheng si Kovitz pentru calculul distantei
de acrosare a flacarii xi , la spatele obstacolului:
1 - frontul de flacara; 2 - linie de separatie intre zona de curgere
si de recirculatie; 3 - linie de stagnare; 4 - obstacol V.
Din ecuatia de bilant de caldura bazata pe ipotezele de mai sus rezulta, relatia:
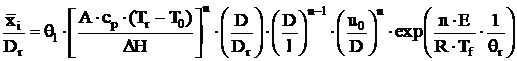 (1.89)
(1.89)
in care: exponentul n = 3/2 4/3; ![]() este distanta
medie de la marginea obstacolului A (fig.1.18) pana la centrul de
aprindere P; Dr - lungimea arcului AS;
este distanta
medie de la marginea obstacolului A (fig.1.18) pana la centrul de
aprindere P; Dr - lungimea arcului AS; ![]() - constanta
adimensionala; cp - caldura specifica la presiune
constanta a amestecului combustibil proaspat; Tf, Tr,
T0 - temperatura zonei flacarii, zonei de
recirculatie si amestecului combustibil proaspat:
- constanta
adimensionala; cp - caldura specifica la presiune
constanta a amestecului combustibil proaspat; Tf, Tr,
T0 - temperatura zonei flacarii, zonei de
recirculatie si amestecului combustibil proaspat: ![]() - caldura de ardere, in J g-1; E - energia de activare, in
J ∙ mol-1; R - constanta universala a gazelor; A -
factorul de frecventa in expresia vitezei de reactie;
- caldura de ardere, in J g-1; E - energia de activare, in
J ∙ mol-1; R - constanta universala a gazelor; A -
factorul de frecventa in expresia vitezei de reactie; ![]() - viteza curentului in
amonte de obstacol, in cm ∙ s-1; D - distanta intre linia
de separatie 2 si linia de stagnare 3 (fig. 1.18), in cm; l -
lungimea efectiva (cm) a placii plate a obstacolului care
defineste conditiile de frecare inainte de zona de stagnare din
spatele obstacolului).
- viteza curentului in
amonte de obstacol, in cm ∙ s-1; D - distanta intre linia
de separatie 2 si linia de stagnare 3 (fig. 1.18), in cm; l -
lungimea efectiva (cm) a placii plate a obstacolului care
defineste conditiile de frecare inainte de zona de stagnare din
spatele obstacolului).
1.6 Determinarea vitezei de rupere a flacarii turbulente de difuziune
Daca se noteaza cu ![]() viteza curentului pe
axa jetului, conditia de stabilitate a flacarii este:
viteza curentului pe
axa jetului, conditia de stabilitate a flacarii este:
![]() .
(1.91)
.
(1.91)
Daca se considera pentru ![]() expresia data de Williams si
Bollinger,
expresia data de Williams si
Bollinger,
![]() , (1.92)
, (1.92)
valabila pentru Re = 3 00080000), in
care: ![]() este viteza
maxima a scarii laminare, in cm s-1; d 0 - diametrul
gurii arzatorului, in cm, iar pentru um expresia data de
Abramovici.
este viteza
maxima a scarii laminare, in cm s-1; d 0 - diametrul
gurii arzatorului, in cm, iar pentru um expresia data de
Abramovici.
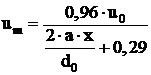 , (1.93)
, (1.93)
in care: ![]() este viteza curentului
in gura arzatorului; x - distanta de la gura arzatorului
pana la sectiunea de calcul a jetului (fig.8.38), si daca
se inlocuiesc in ecuatia (8.28) rezulta:
este viteza curentului
in gura arzatorului; x - distanta de la gura arzatorului
pana la sectiunea de calcul a jetului (fig.8.38), si daca
se inlocuiesc in ecuatia (8.28) rezulta: 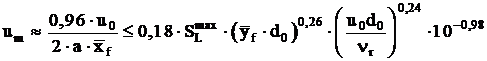 (1.94)
(1.94)
unde: ![]() , este lungimea raportata a flacarii pana
la sectiunea la care se realizeaza egalitatea Cm = Cs , adica concentratia de
combustibil gazos pe axa jetului este egala cu concentratia
stoichiometrica a amestecului combustibil, (
, este lungimea raportata a flacarii pana
la sectiunea la care se realizeaza egalitatea Cm = Cs , adica concentratia de
combustibil gazos pe axa jetului este egala cu concentratia
stoichiometrica a amestecului combustibil, (![]() depinde numai de natura combustibilului gazos);
depinde numai de natura combustibilului gazos); ![]() - diametrul raportat
al zonei de amestecare a jetului in sectiunea transversala in care
concentratia pe axa jetului Cm
= Cs (
- diametrul raportat
al zonei de amestecare a jetului in sectiunea transversala in care
concentratia pe axa jetului Cm
= Cs (![]() depinde numai de natura combustibilului gazos); ns - vascozitatea cinematica a amestecului combustibil - aer la ruperea
flacarii, in
depinde numai de natura combustibilului gazos); ns - vascozitatea cinematica a amestecului combustibil - aer la ruperea
flacarii, in ![]() ; a - coeficientul de structura al jetului (a 0,07) ; d0 - diametrul, in mm;
; a - coeficientul de structura al jetului (a 0,07) ; d0 - diametrul, in mm; ![]() , in m s-1.
, in m s-1.
1.7 Determinarea lungimii de desprindere a flacarii turbulente de difuziune
Pentru a calcula variatia concentratiei C in lungul jetului, poate fi adoptata o relatie de forma:
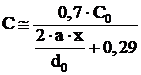 , (1.102)
, (1.102)
in care C0 este concentratia de combustibil gazos in gura arzatorului.
Pentru Ma = Mg, rezulta:
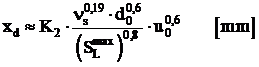 , (1.104)
, (1.104)
iar pentru cazul ![]() , rezulta:
, rezulta:
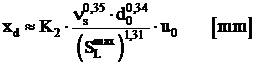 , (1.105)
, (1.105)
unde d0 este dat in mm.