
|
|
|
Factorul esential in cataliza eterogena, il constituie natura suprafetei catalizatorului. Pentru explicarea mecanismului reactiilor acid catalizate, se tine cont de existenta centrelor acide de pe suprafata catalizatorului. Conform principiilor de baza ale catalizei, interactia catalizator - reactant se realizeaza prin intermediul centrelor active si conduce la formarea unor specii intermediare instabile, bogate in energie si foarte reactive. Zeolitii sintetici, considerati acizi anorganici solizi, fac parte din categoria catalizatorilor acido - bazici caracterizati prin existenta pe suprafata lor a centrelor active catalitic, cu caracter acid sau bazic, de tip Brönsted sau Lewis.
Zeolitii sunt materiale unice care, spre deosebire de alti catalizatori, poseda pe suprafata lor intercristalina centre active definite cristalografic. In cazul zeolitilor cu raportSi /Al > 5, centrele active sunt stabile la temperaturi inalte si adesea sufera mici modificari, la interactia cu reactantii sau produsele de reactie.
Acizii Brönsted fiind specii capabile sa cedeze protoni, se mai numesc si acizi protonici si pot fi: molecule neutre, ioni pozitivi sau ioni negativi, iar interactia acid - baza se poate scrie:
![]()
![]() acid
A baza B + H +
acid
A baza B + H +
Tinand cont de acestea, moleculele bazice adsorbite pe suprafata unui catalizator care poseda astfel de centre, vor fi transformate printr-un mecanism de transfer de protoni, de la catalizatorul solid (centrul Brönsted) la molecula adsorbita.
Acizii Lewis sunt specii capabile sa accepte o pereche de electroni, deci trebuie sa aiba un orbital vacant sau sa si-l faca disponibil la apropierea bazei. Pot fi: cationi metalici, ionul carboniu, Al 3+ etc. Transformarea moleculei adsorbite in acest caz are loc prin transferul unei perechi de electroni de la molecula de reactant catre suprafata catalizatorului (centru acid Lewis). Mecanismul carbocationic poate fi explicat daca se considera ca intermediarii de reactie apar ca urmare a interactiunii dintre moleculele reactante si centrele acide de pe suprafata zeolitului.
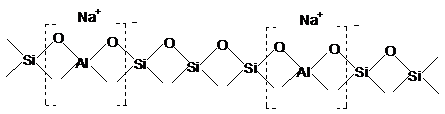 In forma Na+, asa
cum rezulta in mod obisnuit din sinteza, zeolitii nu
prezinta centre acide, reteaua zeolitica putand fi
reprezentata astfel:
In forma Na+, asa
cum rezulta in mod obisnuit din sinteza, zeolitii nu
prezinta centre acide, reteaua zeolitica putand fi
reprezentata astfel:
Prin inlocuirea ionilor Na+ cu ioni H+ sau cu alti ioni, in general cu mai multe valente, zeolitii se transforma in catalizatori care prezinta centre active cu caracter acid.
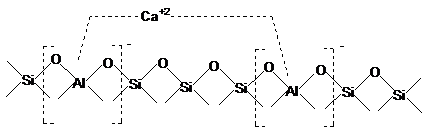 Pe baza datelor
experimentale, se considera ca inlocuirea ionilor Na+ din
reteaua zeolitica cu ioni polivalenti confera acesteia
activitate catalitica de tip ion carboniu care creste odata cu
raportul SiO2/Al2O3. In cazul zeolitilor
cu acest raport mic, sarcina negativa excedentara a fiecarui
tetraedru [AlO4]- este neutralizata de cationii de
Na+ asociati, dand o structura electric neutra. Prin
inlocuirea cationilor de Na+ cu cationi di - sau polivalenti,
de exemplu Ca2+ acesta se leaga prin doua valente la
distante inegale, fapt care conduce la o repartitie neuniforma
de sarcini, unul din tetraedre fiind complet neutralizat, iar celalalt cu
o sarcina partial negativa. Astfel suprafata
caracterizata prin sarcini distribuite neomogen, poate favoriza
reactii de tip ion carboniu prin polarizarea legaturilor din
moleculele reactante.
Pe baza datelor
experimentale, se considera ca inlocuirea ionilor Na+ din
reteaua zeolitica cu ioni polivalenti confera acesteia
activitate catalitica de tip ion carboniu care creste odata cu
raportul SiO2/Al2O3. In cazul zeolitilor
cu acest raport mic, sarcina negativa excedentara a fiecarui
tetraedru [AlO4]- este neutralizata de cationii de
Na+ asociati, dand o structura electric neutra. Prin
inlocuirea cationilor de Na+ cu cationi di - sau polivalenti,
de exemplu Ca2+ acesta se leaga prin doua valente la
distante inegale, fapt care conduce la o repartitie neuniforma
de sarcini, unul din tetraedre fiind complet neutralizat, iar celalalt cu
o sarcina partial negativa. Astfel suprafata
caracterizata prin sarcini distribuite neomogen, poate favoriza
reactii de tip ion carboniu prin polarizarea legaturilor din
moleculele reactante.
Calcule detailate au aratat ca intensitatea campului electrostatic al cationului in locuri accesibile reactantului are o astfel de valoare incat poate induce schimbari esentiale in pozitia perechii de electroni participanti din moleculele de reactant adsorbite. Cationul atrage perechea de electroni ce formeaza legatura C - H, inducand sarcini partiale localizate la cele doua elemente participante la legatura. Ca urmare a polarizarii legaturii C - H, atomul de C devine deficitar in electroni servind ca centru activ pentru reactiile de tip ion carboniu iar atomul de hidrogen se comporta ca un ion de hidrura.
Cationii metalici prezenti in structura zeolitilor transforma hidrogenul unei grupe OH, existente la un atom adiacent al retelei sau a moleculei de apa de hidratare a insusi cationului respectiv, in proton disponibil pentru diverse reactii chimice. Polarizarea grupelor OH structurale ca urmare a campului electrostatic al cationilor poate fi reprezentata astfel:
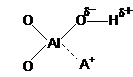
In zeolitii decationizati, natura centrelor active este diferita prin aceea ca nu sunt prezenti cationi metalici care sa polarizeze grupele structurale si moleculele de apa.
Zeolitii sunt folositi drept catalizatori in multe reactii chimice in care indeplinesc rol de catalizator acid Brönsted, catalizator bazic sau catalizator redox. Catalizatorii zeolitici pot fi monofunctionali (acizi solizi Brönsted HZ) sau bifunctionali (acizi solizi Brönsted + metal cu actiune specifica, de ex. hidrogenant /dehidrogenanta, HMZ).
Zeolitii si zeotipii care prezinta capacitate de schimb ionic pot fi transformati in acizi solizi Brönsted prin schimbul ionic total sau partial al cationilor compensatori de sarcina cu protoni. Activitatea de formare a carbocationilor ca intermediari de reactie se datoreaza transferului protonilor din centrele acide Brönsted catre moleculele reactante.
 In cazul procesarii alcanilor, alchenelor
si a cicloalcanilor pe catalizatorii zeolitici se formeaza ca
intermediari ionii de alchilcarbeniu
(ce contin atomul de C tricoordinat incarcat pozitiv in care cei trei
substituenti sunt grupe alchil sau H) sau ionii de alchilcarboniu (ce contin atomul de C pentacoordinat
incarcat pozitiv in care cel putin un substituent este atomul de H).
In cazul procesarii alcanilor, alchenelor
si a cicloalcanilor pe catalizatorii zeolitici se formeaza ca
intermediari ionii de alchilcarbeniu
(ce contin atomul de C tricoordinat incarcat pozitiv in care cei trei
substituenti sunt grupe alchil sau H) sau ionii de alchilcarboniu (ce contin atomul de C pentacoordinat
incarcat pozitiv in care cel putin un substituent este atomul de H).
Formarea carbocationilor pe un catalizator zeolitic monofunctional depinde de aciditatea zeolitului si de natura reactantilor:
mecanismul 1: prin aditia protonului zeolitic la o alchena:
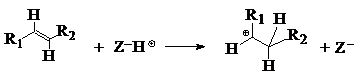
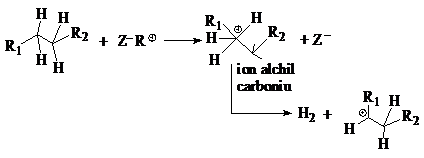 mecanismul 2: aditia protonului zeolitic la un alcan:
mecanismul 2: aditia protonului zeolitic la un alcan:
ion alchilcarbeniu
Mecanismele 1 si 2 au loc pe centrele acide Brönsted ale zeolitilor iar mecanismul 1 se realizeaza mult mai rapid decat 2 si la temperaturi joase.
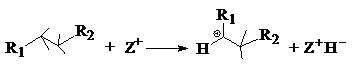 mecanismul
3: extragerea unui ion
hidrura (H
mecanismul
3: extragerea unui ion
hidrura (H![]() ) dintr-o molecula neutra (ex. alcan):
) dintr-o molecula neutra (ex. alcan):
(mecanismul 3 are loc pe centrele acide Lewis)
 sau de catre un
ion carbeniu R+ adsorbit in porii zeolitului prin transfer
bimolecular de ion hidrura:
sau de catre un
ion carbeniu R+ adsorbit in porii zeolitului prin transfer
bimolecular de ion hidrura:
Catalizatorii zeolitici bifunctionali contin un zeolit in forma hidrogen cu functie acida si un metal cu functie dehidrogenant /hidrogenanta. Componentele cu actiune dehidrogenant /hidrogenanta sunt:
metalele nobile: Pt, Pd, .
unele metale tranzitionale: Ni, Co, . sau post - tranzitionale: Ga, Zn, .
unii oxizi metalici: ZnO, Ga2O3, CuO, NiO, .
unele sulfuri metalice: NiS, Co/MoS, .
unii complecsi metalici.
In cazul procesarii alcanilor daca este
prezent si hidrogenul se mareste durata de lucru a
catalizatorului (intre regenerari) cat si activitatea
catalitica. Prezenta H2 reduce ionii Me+n la Me0
mult mai activ catalitic si previne formarea cocsului. Metalul cu
actiune dehidrogenanta favorizeaza trecerea alcanilor in alchene
iar alchenele prin protonare pe centrele acide Brönsted formeaza cationii
alchilcarbeniu; ionii alchilcarbeniu sufera rearanjari prin
izomerizari si reactii de scindare (in pozitia b) dupa care se desorb sub forma de
alchene (n+i). In prezenta metalului, alchenele sunt hidrogenate astfel
ca final vom avea noi alcani (iso). In procesul de aromatizare a GPL
si in cel de izomerizare a n-alcanilor, metalul initiaza
dehidrogenarea alcanilor la alchenele corespunzatoare, alchene care apoi
trec in arene (
Aciditatea zeolitilor este datorata in principal prezentei centrelor acide Brönsted dar si centrelor acide Lewis care se formeaza in urma unor tratamente termice la temperatura ridicata.
Un centru acid Brönsted este capabil sa transfere un proton (H+) de la zeolit la molecula adsorbita iar un centru acid Lewis este capabil sa transfere o pereche de electroni de la molecula adsorbita la suprafata zeolitului. Centrele acide Lewis se formeaza din centrele acide Brönsted prin eliminarea de apa la temperatura de circa500 0C :
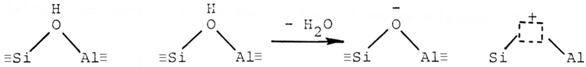
centre acide Brönstedcentru acid Lewis
Pentru a descrie aciditatea zeolitilor trebuie sa facem distinctie intre:
natura centrelor acide (centre Brönsted, centre Lewis);
densitatea sau concentratia acestor centre;
taria lor sau distributia centrelor acide dupa taria lor;
locul lor in structura zeolitului.
Aciditatea Brönsted a zeolitilor este datorata grupelor OH ale suprafetei (sSiOHAls) care sunt capabile sa transfere protoni (H+) moleculelor adsorbite. Pentru aceasta trebuie ca grupele OH sa contina protoni mobili.
Grupele OH ale suprafetei zeolitice se pot forma in 4 moduri:
1. schimb ionic direct Na-zeolit cu un acid mineral diluat - HCl, HNO3, CH3COOH. Acest lucru este posibil numai in cazul zeolitilor cu raport Si /Al ridicat (cazul ZSM-5, MOR):
![]()
![]() Na+Z
Na+Z![]() -hidratat + (H+ + Cl
-hidratat + (H+ + Cl![]() )sol H+Z
)sol H+Z![]() -hidratat + (Na+ + Cl
-hidratat + (Na+ + Cl![]() )sol
)sol
2. schimb ionic indirect, mai
intai in forma NH![]() sau AlK4N+ si apoi calcinare cu eliminare de NH3.
sau AlK4N+ si apoi calcinare cu eliminare de NH3.
![]()
![]()
![]() Na+Z
Na+Z![]() -hidratat + (NH
-hidratat + (NH![]() + Cl
+ Cl![]() )sol NH
)sol NH![]() Z
Z![]() -hidratat + (Na+ + Cl
-hidratat + (Na+ + Cl![]() )sol
)sol
NH![]() Z
Z![]() -hidratatH+Z
-hidratatH+Z![]() -calcinat + NH3 g
-calcinat + NH3 g
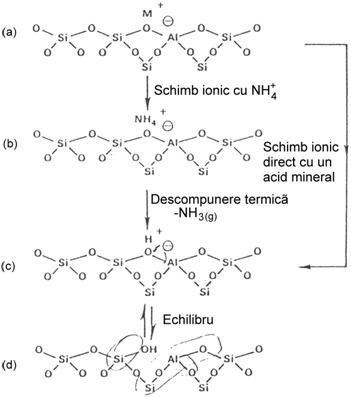 Formarea grupelor OH prin schimb ionic direct (cu
acid) sau indirect (prin intermediar NH
Formarea grupelor OH prin schimb ionic direct (cu
acid) sau indirect (prin intermediar NH![]() ) poate fi reprezentata astfel:
) poate fi reprezentata astfel:
3. prin disocierea apei in campul electrostatic puternic al cationilor di sau trivalenti:
![]() [Me+3(3Z
[Me+3(3Z![]() )(H2O)n]-hidratat [(2Z
)(H2O)n]-hidratat [(2Z![]() )Me+2(OH)]-partial + (H+Z
)Me+2(OH)]-partial + (H+Z![]() )-partial
)-partial
![]() deshidratatdeshidratat
deshidratatdeshidratat
![]()
![]() ex.:[La(H2O)n]+3
+ 3Na+Z
ex.:[La(H2O)n]+3
+ 3Na+Z![]() [La(H2O)n]+3(Z
[La(H2O)n]+3(Z![]() )3 [(LaOH)H2O)]+2H+(Z
)3 [(LaOH)H2O)]+2H+(Z![]() )3
)3
![]() [La(OH)2]+(H+)2(Z
[La(OH)2]+(H+)2(Z![]() )3
)3
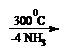
![]()
![]() 4. prin reducerea cu
hidrogen gazos a zeolitilor ce contin cationi ai metalelor
tranzitionale si nobile:
4. prin reducerea cu
hidrogen gazos a zeolitilor ce contin cationi ai metalelor
tranzitionale si nobile:
[Pd(NH3)4]+2
+ 2Na+Z![]() [Pd(NH3)4]+2(Z
[Pd(NH3)4]+2(Z![]() )2 Pd+2(Z
)2 Pd+2(Z![]() )2 Pd0(H+Z
)2 Pd0(H+Z![]()
![]() [Ni+2(Z
[Ni+2(Z![]() )2]-deshidratat + H2(g) Ni0(H+Z
)2]-deshidratat + H2(g) Ni0(H+Z![]() )2-deshidratat
)2-deshidratat