
|
|
|
STRUCTURI MsbA DE Escherichia coli SI Vibro cholera - OMOLOGI AI TRANSPORTORILOR ABC CU
REZISTENTA
Rezistentala medicamente (MDR) este o problema medicala dezbatuta si reprezinta un obstacol major in tratamentul unor boli si in dezvoltarea unor terapii eficiente. In tratamentul cancerului, de exemplu, MDR a restrans eficienta chemoterapiei, rezultand o mai mare rata a mortalitatii in randul pacientilor bolnavi de cancer.
MDR poate creste prin efluxul unor molecule de medicamente la interventia transportorilor localizati in membrana celulara. Unii dintre acestia, cum ar fi P-glicoproteina, poate transporta diverse clase de molecule de medicamente amfipatice si de lipide.
Comparatia structurala dintre VC-MsbA
si MsbA de
Domeniul transmembranar al VC-MsbA este capturat intr-o conformatie inchisa iar structura suporta un model de "atac de forta" al dinamicii transportorului unde NBD-urile opuse se suprapun situsurilor de legare a ATP.
MbsA apartine unei vaste superfamilii de proteine caracterizate printr-o inalta putere de legare a adenozintriphosphatului (ATP), aceea a casetei de transportori ABC.
MsbA transporta lipidul A, un component major al membranei externe bacteriene, fiind singurul transportor ABC esential pentru viabilitatea celulei, transformand-o intr-o tinta cu potential antibiotic.
Studii in-vitro au demonstrat ca MsbA este o ATPaza stimulata specific de catre lipidul A. Mutatii la nivelul transportului au derivat in acumulari letale de lipid A in membrana interna a celulei.
fihdsjhbjhdbfhsbvf
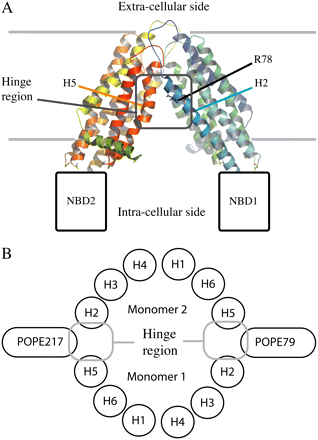
Fig.10. Prezentarea generala a unei
structurii MsbA, luand in vedere domeniul transmembranar, precum si
fosfolipidele ce alcatuiesc in partea schematica a imaginii,
partea intracelulara a proteinei. http://www.biophysj.org/cgi/content/full/91/7/2517/FIG1
VC-MsbA detine 68% din identitatea secventelor
prezente
In urma cristalografierii cu raze X, la o
rezolutie de 3.8 Å, VC-MsbA are o conformatie de dimer reprezentat
prin fuziunea domeniului transmembranar cu un domeniu NBD, si la fel ca
si
B C A
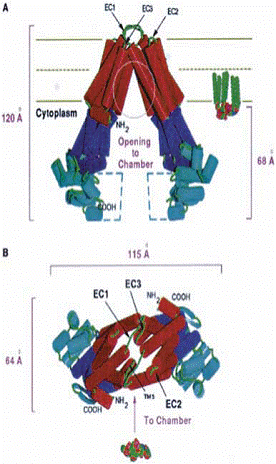 Fig.11. (A) Vizualizarea camerei de deschidere a dimerului
MsbA, cu toate domeniile, (B) vizualizare din mediul extracelular membranar,
buclele implicate in deplasarea lipidului A (E.coli).(C)
imaginea stereo a modelului omolog P-gp
generat in baza structurii VC-MsbA.
Fig.11. (A) Vizualizarea camerei de deschidere a dimerului
MsbA, cu toate domeniile, (B) vizualizare din mediul extracelular membranar,
buclele implicate in deplasarea lipidului A (E.coli).(C)
imaginea stereo a modelului omolog P-gp
generat in baza structurii VC-MsbA.
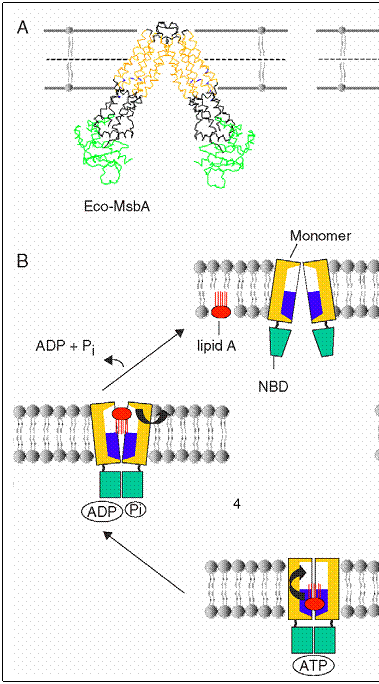
Fig.
Transportorii MDR-ABC sunt unici prin faptul ca extrag lipide sau molecule de medicamente direct din membrana celulara si fie le rasucesc prin flipaza pe celalalt strat, fie le expulzeaza in mediul extracelular.
Pentru indeplinirea acestei functii, MsbA trebuie sa recunoasca in prima faza o molecula de lipid A, urmand extragerea din membrana intr-un micromediu ce favorizeaza mutarea acestuia pe cealalta suprafata. "Camera flipazei " formata la nivelul dimerului Eco-MsbA este regasita inca odata si la nivelul structurii VC-MsbA, ca o confirmare a apartenentei acestui component in arhitectura tipica a MsbA.
In contrast cu structura de "conformatie
deschisa" a Eco-MsbA, NBD-urile de
Un contact analog este observat la importorul vitaminei B12 si poate reprezenta o caracteristica comuna a transportorilor ABC.
Structurile de VC-MsbA si de Eco-MsbA demonstreaza ca NBDurile pot forma un spatiu larg conformational in lipsa nucleotidei, asemanat in studiu cu proteina P-gp umana, arata ca subunitatea TM6, care este practic unita cu NBD, are o miscare de rotire in timpul ciclului catalitic.
Structura VC-MsbA evidentiaza o alta viziune asupra exporterului ABC si mai departe subliniaza ideea ca transportorii MDR-ABC sunt masini moleculare ce scaneaza stratul intern al membranei de substraturi, le accepta lateral intr-o incapere, si le scoate prin flipaza pe suprafata externa a membranei sau pe "mileul" extracelular. Este o noua viziune in starea de inchidere descrisa initial si vine cu o baza structurala pentru mecanismul asociat cu lipid/medicament de "flip-flop".
Impreuna, structurile VC-MsbA si Eco-MsbA pot contribui la elucidarea bazei structural-moleculare a transportului de medicamente de catre transportorii MDR-ABC, ce pot avea un impact foarte important in dezvoltarea unor terapii folosite in tratarea cancerului si a bolilor infectioase.