
|
|
|
METALE NEFEROASE
Aluminiul- metal usor, tt = 658.6 C, tf= 2500 grade C, conductivitate termica si electrica , maleabil ductile, Se obtine pe cale elctrochimica utilizand bauxita.
Cuprul- 63.54=greutate atomica ,tt=1083grade C , tf=2310grade C, rosiatic, are o buna conductabilitate termica si electrica, ductile si maleabil , se foloseste sub forma de conductori aliaje.
Ductil= prop de a fi tras in sarma
Maleabil= prop de a fi usor de modelat
Maleabilizare= se aplica fontelor albe
St- (staniu) A= 118.69 , tt=231.8 grade C , tf = 2362 grade C, maleabil, ductile
Zn-A=65.37, tt=419.4 grade C, tf=906 grade C, se utilizeaza la zincare
Pb- A= 207.19, tt=327grade C tf=1750 grade C, metal moale
Alama- CuZn- maleabil si ductile
Bronz - Cu, St, Al, Pb - prop superioare cuprului
Duraluminiul - (Al, Cu, Mg, Mn, etc) folosit in aeronautica
Proprietati tehnice ale hidrocarburilor
Proprietatile gazelor naturale
Ec. de stare a g. nat
1. Starea normala si starea standard
2. Parametrii critici redusi si legea starilor corespondente
3. Factor de volum
4. Densitatea specifica
5. Vascozitatea
6. Compresibilitate
7. Greutate moleculara
8. Temp. si pres. critica
9. Puterea calorifica
10. Punct de roua
11. Pres de vapori
12. Caldura specifica
13. Umiditate
14. Efectul Joule-Thompson
1) Ec. de stare a gazelor naturale
![]()
Pt gaze reale ![]() ,unde
,unde
p-pres absoluta [Pa]
V-vol unui kilomol de gaz [mc/kmol]
υ-vol specific, =1/ρ
R-constanta de gaz perfect
T-temp absoluta [K]
![]() ,
unde R-constanta univ a gazelor
,
unde R-constanta univ a gazelor
Pt. un kilomol de gaz la conditii normale p=1,01325 bar, avem:
![]()
Pt un gaz oarecare ![]()
Pt un singur gaz avem
ecuatia de stare ![]()
Daca avem de a face cu mai multe gaze avem legea lui Dalton in care p,
![]()
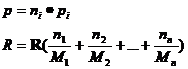
La gazelle reale ![]()
2) Starea normala si starea standard
-starea normala fizica e carcaterizata de t=0 gr C (T=273,15 K) si p=101325 Pa=1,01325 bar
-starea normala tehnica sau standard e caract. de aceiasi presiune p=1,01325 bar si t=15 grC (T=288,15 K)
3) Parametrii critici redusi si legea starilor corespondente
-parametrii p,V,T, caracterizeaza o anumita stare a gazelor si ei pot fi inlocuiti cu rapoartele dintre valorile absolute si cele critice ale acestora
![]()
Daca se exprima
proprietatile gazelor prin parametrii redusi se poate spune ca pt toate gazele
exista una si aceiasi ecuatie de stare ![]() .Acesta
ultima functie se numeste legea starilor corespondente.
.Acesta
ultima functie se numeste legea starilor corespondente.
Potrivit legii
starilor corespondente 2 gaze la care ![]() au
aceleasi valori, trebuie sa aiba acelasi volum redus., cele 2 gaze au aceleasi
propr fizice. Se poate considera ca diagrama lui Z trebuie sa fie identica. Din
lg. st. coresp. Reiese ca izotermele,izocorele, izobarele, si adiabatele
trebuie sa fie aceleasi pt toate gazele. Experimental s-a constatat ca lg st
coresp da erori relative mari. Este considerate o lege aproximativa.
au
aceleasi valori, trebuie sa aiba acelasi volum redus., cele 2 gaze au aceleasi
propr fizice. Se poate considera ca diagrama lui Z trebuie sa fie identica. Din
lg. st. coresp. Reiese ca izotermele,izocorele, izobarele, si adiabatele
trebuie sa fie aceleasi pt toate gazele. Experimental s-a constatat ca lg st
coresp da erori relative mari. Este considerate o lege aproximativa.
Pentru amestecurile de gaze se vor calcula parametrii redusi (p,T) sub forma
![]() ,
n-conc. Molara
,
n-conc. Molara
![]()
Parametrii amestecului de
gaze sunt: ![]() si
si
![]()
Privitor la calculul lui Z avem relatiile
![]() Bertholet
Bertholet
![]() Adamov
Adamov
4) Factorul de volum al gazelor
Reprezinta raportul dintre volumul ocupat de o cantitate de gaze in conditii de temp. si pres. date si volumul ocupat de aceiasi cantitate de gaz in conditii normale, standard sau in alte conditii.
![]() unde
unde
![]() -
corespund starii normale
-
corespund starii normale
5) Densitatea (masa volumica)
Se numeste densitate raportul dintre masa si volumul sistemului. Depinde de compozitia gazului de p si T. In conditii normale de p si T, densitatea se calculeaza astfel:
![]() ,
unde M- masa molara
,
unde M- masa molara
In alte conditii de p si T, densitatea ρ se calc astfel:
![]() ,
daca se stie compozitia gazului si densitatea relativa se poate calcula cu
formula
,
daca se stie compozitia gazului si densitatea relativa se poate calcula cu
formula![]() ,
unde
,
unde ![]() -densitatea
relativa
-densitatea
relativa
![]()
![]() ,
unde X-participatia volumetrica
,
unde X-participatia volumetrica
6) Vascozitatea
Este o proprietate a substantelor ce se manifesta in procesul de miscare.
Este de 2 tipuri: a) dinamica η
b) cinematica υ
a) Vascozitatea dinamica- este raportul dintre efortul tangential care actioneaza intr-un pct al fluidului si gradientul perpendicular pe planul tangential.
![]() ,
[Pa*sec], iar
,
[Pa*sec], iar ![]() ,
semnul "-" arata ca vascozitatea se opune directiei de miscare.
,
semnul "-" arata ca vascozitatea se opune directiei de miscare.
b) Vascozitatea cinematica-
este ![]() [mp/sec]
[mp/sec]
Se mai foloseste in practica si Poisse si Stokes, mai exact c Psi cSt
1cP=10-3 N*s/mp si 1cSt=10-6 mp/sec
Vascozitatea gazelor depinde de compozitia lor, scade cu densitatea si creste cu p si T.
7) Compresibilitatea gazelor
Prin definitie coef de compresibilitate izoterma este dat de relatia:
![]()
Dpdv fizic coef β reprez scaderea volumului unei unitati de volum la cresterea presiunii cu o unitatea cand T-const.
Aceasta relatie se scrie si
astfel ![]()
Pt gaze perfecte Z=1 si ![]()
Pt coordonate pseudoreduse coef de compresibilitate se poate calcula astfel
![]()
8) Greutatea moleculara
Fiecare atom are propria lui greutate. Suma greutatilor tuturor atomilor dintr-o molecula este egala cu greutatea moleculara. Higrogenul are cel mai usor atom din univers.
Molecula de gaz metan are:
CH4=4*1,008+12,011=16,043.
9) Temp si pres critica
Temp critica- este temp deasupra careia un fluid nu poate exista in stare lichida.
Pres critica- este pres de vapori a fluidului la temp critica. Sub aceasta presiune fluidul exista sub o forma de L+G sau G.
Temp si pres critica se interpreteaza pt a afla starea fizica a fluidului si pentru calculul lui Z.
10) Puterea calorifica
Puterea calorifica superioara Hsup-Hinf=Lv, caldura latenta de vaporizare.
Puterea calorifca superioara este energia obtinuta la arderea unui comb, a unit de masa sau de vol a unui combustibil, cand produsii de ardere contin apa sub forma lichida.
CH4+2O2=CO2+2H2O.
Puterea calorifica inferioara= energia termica eliberata la arderea unitatii de volum sau de masa, cand in produsii de ardereapa se afla sub forma de vapori.
11) Punctul de roua
-este o temp si reprez temp la care continutul in vapori este egal cu umiditatea de saturatie la o presiune data.
=temp la care apar primele picaturi de condens la o pres data.
12) Presiunea de vapori
=pres la care exista un echilibru intre faza gazoasa sic ea lichida. Valoarea presiunii variaza cu temperature. Valoarea pres de vapori intereseaza pt determinarea cantitatii de apa.din curentul de hidrocarburi.
13) Caldura specifica
=caldura schimbata de mediul ext cu unit de masa cand aceasta isi modific temp cu un grad.
Caldura masica ![]() [KJ/kg*K]
[KJ/kg*K]
=caldura schimbata cu mediul ext a unui kg de subs cand isi modifica temp cu un grad.
Caldura volumica ![]() [KJ/
mcN*K]
[KJ/
mcN*K]
=caldura schimbata de 1mc de substanta cu mediul ext, cand acesta isi modifica
temp cu 1 grad
Caldura molara ![]() [KJ/ kmol*K]
[KJ/ kmol*K]
=caldura schimbata de 1 kmol de substantza cand aceasta isi modifica temp cu 1 grad.
Pt gazele perfect caldurile specifice sunt normale, la gazele reale cald specif. depinde de pres si de temp.
Se determina la pres const izobare
Se determina la vol. const izocore
Intre aceste calduri specifice exista relatia lui Robert-Mayer:
![]()
![]()
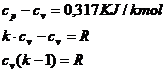
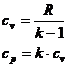
14) Umiditatea
Prez apei in gazele naturale cunoscuta ca umiditate se exprima sub forma de u-[g/mcN] sau U-[kg/1000mcN],
Umid creste la cresterea T la p-const.
Umid creste la scadera p la T-const.
Datorita faptului ca acestea sunt supuse unor transformari termodinamice umiditatea gazelor creaza criohidrati (hidrati ai metanului cu apa.)
Criohidratii=subst solide de culoare alba, similara ghetii. Odata formati ei pot obtura sectiunea de curgere, blocand conductele si diminuand capacitatea de transport.
Umiditatea
In functie de amestecul saturat, umiditatea relative ![]() .;
.;
Starea de saturatie=starea la care lichidul are T=Tsat la o anumita presiune. Daca temp scade condensarea vaporilor de apa. Daca pres creste peste pres de saturatie si temp ramane aceeasi condensarea vaporilor de apa
15) Vaporizarea
=fen de trecere al unui lichid in stare de vapori.
-proc invers vaporizarii condensarea.
Vaporizarea intense din masa lichidului= Fierbere
Vaporizarea lenta, produsa doar la supraf lichidului= Evaporare.
16) Efectul Joule-Thompson
Laminarea gazelor este o destindere la entalpie constanta in urma careia gazelle isi reduc presiunea.. In urma laminarii izentropice, gazele perfecte raman cu aceiasi temp. La gazele reale, in urma laminarii, temp T2 se modifica.