
|
|
|
Conductia protonica - comparativ doua tipuri de alumina
Doua alumine, Al2O3 (Degussa, 106 m2/g) si una cu suprafata specifica mare produsa de Rafinaria Vega (363 m2/g) au fost supuse aceluiasi protocol de ciclare termica succesiva a probei in diverse atmosfere si s-a urmarit "in situ" variatia proprietatilor electrice ca urmare a intercatiei aluminelor cu un amestec propena: aer. In acest caz succesiune ciclurilor a fost: DAr1-3, DO, DAr4, CT1, DAr5, HO, CT2 unde cu DAr s-a abreviat inertul uscat (argon), cu DO si HO oxigenul uscat, respectiv umed si cu CT testul catalitic.
Conductanta pulberii (G) s-a calculat scazand din conductanta efectiva valoarea corespunzatoare pentru celula goala (fara pulbere). Conductibilitatea aparenta s-a calculat din aceste valori a lui G, luand in considerare geometria cilindrica a celulei.
In Figura 9 s-a reprezentat grafic variatia conductibilitatii electrice cu temperatura pentru proba Al2O3-Degussa. Dupa cum se poate vedea, in majoritatea cazurilor pentru proba Al2O3-Degussa si numai in cateva pentru Al2O3-Vega (Figura 10), conductibilitatea are o comportare specifica la incalzire, inregistrand un mic maxim localizat la aproximativ 50-80oC dupa care conductia scade. Aceasta este urmata de o noua crestere a conductiei la temperatura inalta (peste 300 oC pentru Al2O3-Degussa si peste 200 oC pentru Al2O3-Vega).
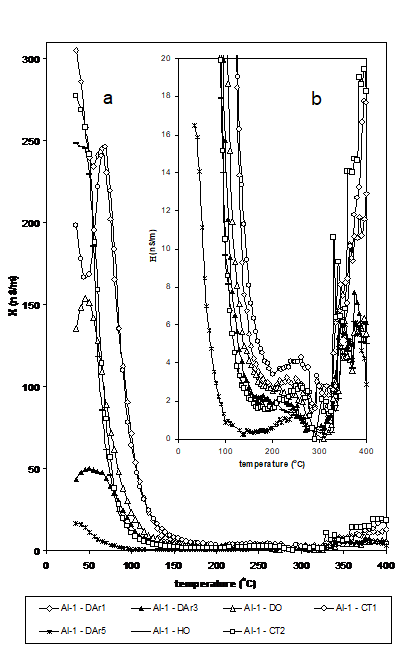
Figura 9
Variatia conductibilitatii electrice cu temperatura pentru proba Al2O3-Degussa
Analiza compozitiei gazelor de iesire a confirmat faptul ca scaderea conductiei la temperatura joasa se datoreaza pierderii moleculelor de apa slab adsorbite pe suprafata. Un alt peak observat doar la proba Al2O3-Degussa in testul catalitic (CT1) poate fi asociat cu desorbtia altor specii produse ca urmare a adsorbtiei propenei pe suprafata aluminei. Acest peak nu a mai fost observat in CT2 probabil datorita saturarii suprafetei cu apa pre-adsorbita dupa ciclul HO. Aceasta sugereaza ca propena si apa concureaza pentru aceiasi centri de adsorbtie.
In ciclul DAr5, conductia la temperatura joasa este mai mica in ambele cazuri, aceasta indicand faptul ca o parte din centri au fost blocati de anumite specii puternic adsorbite (propena).
Conductivitatea a fost mult mai mare pentru Al2O3-Degussa la temperatura scazuta, dar mai mare pentru Al2O3-Vega peste 200 oC
Usoara crestere a la temperatura ridicata indica mobilizarea retelei, care evident este mai mare pentru proba Al2O3-Vega.
Presupunerea legata de mobilizarea retelei este sustinuta deasemenea de activitatea catalitica; mici urme de dioxid de carbon au fost detectate in efluent in testele catalitice pentru proba Al2O3-Degussa la 310 oC, cantitatea de CO2 crescand usor dupa 400 oC.
Pentru proba Al2O3-Vega, CO2 si CO au fost deja detectati la 300oC in cantitate mare, conversia propenei fiind si ea mult mai mare.
Incalzind in HO, regasim CO2 in efluent (pentru Al2O3-Vega, cu suprafata specifica mare, incepand cu 310oC); aceasta confirma existenta pe suprafata a anumitor specii de hidrocarbura puternic adsorbite care nu pot fi indepartate prin simpla incalzire pana la 400 oC in absenta oxigenului, precedat doar de DAr5.
In concluzie putem spune ca proprietatile electrice in cazul Al2O3, au indicat faptul ca pornind de la temperatura camerei si pana la 400oC predomina conductia protonica prin intermediul gruparilor OH superficiale si a apei adsorbite. Pana la 200oC conductia se desfasoara dupa un mecanism "vehicul" facilitat de prezenta moleculelor de apa adsorbite pe suprafata Al2O3; peste aceasta temperatura moleculele de apa adsorbite fizic sunt indepartate, protonii mobili ai gruparilor acide OH se misca cel mai probabil prin salturi intre gruparile OH vecine (mecanism Grotthuss).
In mediu uscat sau umed alumina se comporta ca o sursa respectiv consumator de hidrogen/apa. Prezenta apei pe suprafata / grupari OH controleaza natura si taria altor specii adsorbite. Astfel, interactia propenei cu suprafata aluminei este influentata de prezenta apei pre-adsorbite la temperatura joasa. Competitia apei si propenei pentru aceiasi centri impiedica formarea unor specii puternic adsorbite de hidrocarbura.
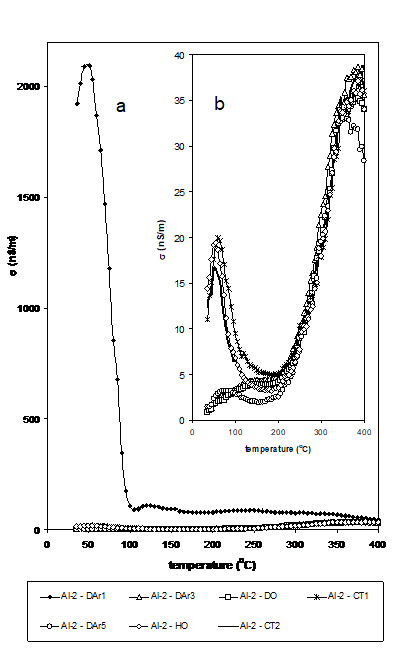
Figura 10.
Variatia conductibilitatii electrice cu temperatura pentru proba Al2O3-Vega