
|
|
|
Studiul catalizatorilor obtinuti prin depunerea SnO2 pe g-Al2O3
S-a folosit ca precursor SnCl4 5H2O (M = 350,58, Aldrich) in apa distilata. Alumina (umectata in prealabil cu apa distilata) si solutia de clorura de staniu au fost amestecate sub agitare la 60sC pana la obtinerea unei paste semifluide. Pentru a grabi procesul de eliminare a apei simultan incalzirii sistemul a fost atasat unei trompe de apa. Uscarea finala a pastei obtinute in acest mod s-a facut apoi intr-o etuva incalzita la 100sC.
Ulterior materialul a fost supus urmatoarei proceduri de calcinare in curent de oxigen ce a constat din incalzire 2h de la temperatura camerei la 150sC, un palier de 6h la 150sC, incalzire in 2h de la 150 la 500sC, un palier de 8h la 500sC urmat de racirea libera a sistemului. Produsul obtinut a fost apoi mojarat pana la obtinerea unei pulberi suficient de fine.
Analiza chimica a fost facuta prin analiza spectrala pentru Sn dupa topirea esantionului in tetraborat de litiu la 1100sC urmata de solubilizare in HCl. Din acest motiv rezultatul este exprimat in cantitate de staniu la gram de material finit. Faptul ca ionul de staniu se gaseste intr-o structura cristalina oxidica SnO2 e dovedit de spectrul de raze X cat si de esecul analizei chimice clasice (prin dozarea prin solubilizare in amestec HCl-HF fierbinte, deoarece este stiuta rezistenta SnO2 la atacul acizilor). Suprafetele specifice prezentate in tabel au fost masurate prin adsorbtie de azot (metoda BET).
Material
Men+(%)
SBET (m2/g)
Abreviere
Observatii
Sn3-Al
3.1
108
A1
Alfa-Sn
20.5
111
A2
Preparata cu acetat de tributil-Sn in solutie alcoolica
Sn20-Al
19.2
89
A3
g - Al2O3 (oxid C, Degussa)
110
g-Al2O3
Calcinata la 500oC, in oxigen
SnO2 (BDH)
100
9
SnO2-500
Proba a fost incalzita liniar intre 30-400oC cu o viteza de incalzire de 2oC/min; temperatura a fost masurata cu un termocuplu pozitionat in centrul celulei. Influenta (i) deshidratarii/decontaminarii ce au loc prin prin incalzire in curent de argon uscat (DAr), (ii) a adsorbtiei/desorbtiei unor gaze ca oxigen uscat sau umed (respectiv DO sau HO ), si (iii) a unor amestecuri de reactie folosite pentru oxidarea propenei (ca de exemplu amestecul standard C3H6/aer 1/10), asupra conductantei electrice G a fost studiata folosind tehnica treptelor diferentiale (TTD) prin aplicarea unui protocol specific al experimentelor. Acesta consta din cicluri successive incalzire-racire efectuate pe aceeasi proba in curent de gaz, dupa fluxarea timp de 30 de minute la temperatura camerei in gazul respectiv. Protocolul de schimbare a gazelor in ciclurile mentionate a fost dupa cum urmeaza :
DAr-1TDAr-2TDAr-3TDOTDAr-4TC3H6-aerTDAr-5THOT C3H6-aer
Ciclurile repetate in inert uscat au avut ca scop stabilizarea/decontaminarea/ deshidratarea suprafetei la presiune atmosferica. Experimentele in argon uscat au fost folosite si drept referinta, pentru a urmari efectul particular al unui anumit ciclu.
Gazele folosite au fost de inalta puritate. Oxigenul "umed" a fost obtinut prin fluxarea gazului printr-un saturator, la 25oC.
Inainte de folosire, g- Al2O3 a fost supusa unui tratament preliminar identic cu cel folosit pentru prepararea catalizatorilor suportati prin metoda impregnarii, si anume imersarea in apa urmata de uscarea la 110oC si calcinarea la 500oC in curent de oxigen. Un program similar de calcinare a fost aplicat si probei comerciale de SnO2 .
Activitatea catalitica pentru oxidarea propenei a fost masurata simultan cu conductibilitatea electrica, prin prelevarea periodica de probe de gaz in timpul incalzirii in regim programat de temperatura in amestec C3H6-aer 1: 10, la t=1.3 s (t fiind timpul de contact, test de referinta, abreviat ca CT)
Rezultate si discutii
Masuratori de conductibilitate electrica prin tehnica treptelor diferentiale (TTD) pe g- Al2O3, SnO2 si SnO2/g- Al2O3 in diferite atmosfere
Scopul acestui studiu a fost acela de a investiga (pe baza raspunsului conductibilitatii electrice in conditii de reactie) influenta reciproca dintre oxidul suportat si suportul de alumina.
O analiza a variatiei G in functie de temperatura ne indica in zona de temperatura joasa o comportare diferentiata intre probe. Astfel, in cazul SnO2 se observa un maxim localizat la aproximativ 50oC, urmat de o crestere continua a conductantei cu temperatura. Pe de alta parte, atat alumina cat si toate probele de SnO2 suportat pe alumina prezinta o curba de variatie a conductibilitatii in functie de temperatura cu o forma caracteristica in U (figura 1) la primul ciclu de incalzire in inert (DAr-1), cu un minim localizat intre 150-200oC; scaderea brusca de conductibilitate in zona de temperatura joasa este intotdeauna insotita de pierdere de apa in efluent (vezi de exemplu figura 2 unde sunt reprezentate evolutia apei in efluent si variatia de conductanta G in functie de temperatura pentru proba A3).
|
|
|
In acelasi timp, in cazul probelor SnO2/g- Al2O3 se remarca, un maxim localizat chiar in zona cu tendinta descendenta; localizarea acestui maxim corespunde aproximativ celui evidentiat pentru SnO2 bulk si care este asociat cu desorbtia apei de pe acest oxid. Intensitatea acestui maxim pare sa nu difere considerabil in functie de gradul de incarcare cu dioxid de staniu al probelor, diferenta aparand insa in localizarea sa, in cazul probei A1 fiind vizibil la temperaturi mult mai joase. Ca o consecinta a uscarii, in ciclurile urmatoare in inert uscat conductibilitatea in domeniul de temperatura joasa este mult mai mica; ea creste rapid la fluxarea cu oxigen umed, ceea ce dovedeste ca scaderea/cresterea conductantei trebuie asociata cu prezenta umiditatii pe suprafata (vezi de exemplu evolutia valorilor G functie de atmosfera pentru probele A1 si respectiv A2 in figurile 3 si respectiv 4 ).
|
|
|
Pe baza datelor de conductibilitate, g-Al2O3 este cea mai sensibila dintre probe la prezenta umiditatii, in timp ce proba de SnO2 este cea mai putin sensibila (acest lucru poate fi insa asociat si cu suprafata specifica mult mai mica a acestei probe). A1, A2 si A3 prezinta o comportare mixta, adica valori generale ale conductantei G mai mici decat ale SnO2 si situate in zona de valori a g-Al2O3 (Figura 1) dar si o sensibilitate mai mica la umiditate, asemanatoare celei a SnO2. Luand in considerare scaderea de conductanta provocata de tratamentul cu oxigen uscat (figura 5 ciclul in DAr-4 ulterior acestui tratament ) se poate afirma ca in general, din punct de vedere al conductiei electronice comportarea generala a probelor de SnO2 suportat pe alumina urmeaza comportarea de tip n a SnO2.
|
|
|
Influenta SnO2 asupra conductibilitatii electrice a aluminei, deci inrudirea dintre probele depuse cu SnO2 este clar ilustrata de asemanarea intre formele curbelor lnG-1/T (vezi de exemplu figura 5, unde este prezentata variatia de conductanta in argon uscat DAr-4, efectuat dupa ciclul de oxidare in oxigen uscat ). Insa, in amestecul propena-aer influenta aluminei este mai evidenta (figura 6). Aceasta pare sa indice si in cazul probelor cu continut mare de SnO2, ca depunerea de SnO2 nu este uniforma si lasa accesibila adsorbtiei si portiuni din suprafata aluminei, fapt confirmat si de masuratori de adsorbtie de CO prin FTIR.
In domeniul de temperatura inalta, toate probele cu exceptia SnO2 au o tendinta similara a variatiei conductibilitatii cu temperatura. Energiile de activare pentru acest domeniu au fost calculate si sunt prezentate in tabelul 2 atat pentru g-Al2O3 si SnO2 cat si pentru oxizii suportati.
Asa cum am aratat, conductibilitatea electrica este o proprietate fizica a catalizatorilor care poate fi folosita in anumite cazuri pentru a studia modificarile structurale induse de adsorbtie daca aceasta implica efecte de transfer de sarcina. Conductibilitatea electrica a unui oxid semiconductor este determinata de proprietatile de volum, de cele de suprafata si de efectele intergranulare. In cazul oxizilor, conductivitatea din bulk este adesea determinata de concentratia vacantelor de oxigen actionand ca donori de electroni. Conductibilitatea de bulk este activata termic in modul tipic pentru semiconductori, adica electronii sunt transferati de pe nivelele de energie ale donorilor catre banda de conductie la cresterea temperaturii. Conductibilitatea de-a lungul zonelor intergranulare in substantele policristaline este de asemenea activata termic. Conductibilitatea de suprafata (in prezenta adsorbatului chemosorbit) poate fi crescuta sau descrescuta prin adsorbtie . In cazul semiconductorilor de tip n conductibilitatea superficiala creste prin transfer de electroni catre solid, si scade prin transfer de electron catre adsorbat ceea ce conduce la incarcarea negativ a speciilor adsorbite, ca de exemplu in cazul adsorbtiei de oxigen (ca O2-si O-). Insa, in multe cazuri, conductibilitatea suprafetei este dificil de interpretat, deoarece efectele sunt complicate de reorientarea dipolilor si de conductia protonica, favorizata de prezenta apei si a gruparilor OH.
Adsorbtia vaporilor de apa pe suprafete oxidice, cel putin la presiuni relative joase, este direct legata de concentratia superficiala a gruparilor hidroxil si a altor grupari polare [32]; dehidroxilarea suprafetelor oxidice ca urmare a tratamentului termic poate nu numai sa influenteze adsorbtia de apa, dar si sa schimbe considerabil forma izotermelor de adsorbtie si evident, aciditatea suprafetei. Asa cum a fost demonstrat de masuratorile noastre simultane conductibilitate electrica- analiza de gaz de iesire, hidratatrea/deshidratatrea suprafetei este de asemenea reflectata in modificari de conductie superficiala. Prezenta apei/gruparilor hidroxil superficiale influenteaza conductibilitatea electrica mai ales in zona de temperatura joasa. Astfel, pe baza datelor de conductibilitate electrica, toate probele de SnO2 suportat pe alumina prezinta o puternica influenta a suportului de alumina, reprezentata prin capacitatea de a adsorbi apa chiar si la temperatura camerei. Aceasta specie de apa (probabil adsorbita molecular) prin legaturi de hidrogen pe gruparile hidroxil ale suprafetei sau pe ioni de aluminiu nesaturati coordinativ se pierd prin incalzire pana la 150-200oC (temperatura minimului in curba dependentei de temperatura a conductiei evidentiata de noi). Peste 300oC, apa preadsorbita inca prezenta pe suprafata este chemisorbita pe alumina, formand noi grupari hidroxil; acest proces este opus deshidratarii prin condensarea gruparilor OH, care decurge in paralel, fiind in mod evident favorizat in atmosfera uscata. Datele noastre indica ca toate probele studiate, cu exceptia SnO2 bulk sunt capabile sa detecteze chiar si urme de apa din atmosfera (prezentand valori crescute ale conductibilitatii electrice la temperatura camerei ceea ce le recomanda drept senzori de umiditate. Activitatea catalitica in reactie de oxidare se remarca numai la temperaturi mai inalte, cand conductibilitatea suprafetei este aparent predominant electronica. Aceasta sugereaza o competitie intre apa si oxigen pentru adsorbtia pe aceeasi centri ai suprafetei, asa cum noi am aratat deja anterior pentru SnO2.
Determinarea energiilor de activare ale conductiei pe diferite domenii de temperatura in diferite gaze
In tabelul 2 sunt prezentate valorile energiilor de activare ale portiunii de joasa temperatura pentru probele de SnO2/g-Al2O3 ca si pentru cei doi oxizi simpli, ca referinta la incalzirea in primul ciclu in inert uscat (DAr-1)
Tabelul 2. Energiile de activare ale conductiei in domeniul de joasa temperatura (Semnul minus semnifica scaderea conductibilitatii, datorata desorbtiei de apa).
Proba
Experiment
Domeniu de
Temperature (0C)
E (eV)
A1
DAr-1
37-60
87-150
-0.37
- 0.76
A2
DAr-1
33-60
94-140
-0.53
-0.60
A3
DAr-1
36-76
100-140
-0.50
-0.75
SnO2-500
DAr-1
30-100
132-165
0.25
-0.43
g-Al2O3
DAr-1
70-140
-0.59
iar in tabelele 3 si 4 energiile de activare pentru domeniul de temperatura inalta pentru oxizii simpli si pentru catalizatorii suportati in diferite cicluri cu diferite gaze.
Tabelul 3. Energia de activare a conductiei in domeniul de temperatura inalta in diferite atmosfere pentru probele de SnO2/Al2O3 A1, A2 si A3
A1
A2
A3
Experiment
Temperatura (oC)
E (eV)
Experiment
Temperatura (oC)
E (eV)
Experiment
Temperatura (oC)
E (eV)
DAr-1
263-356
0.58
DAr-1
230-360
0.46
DAr-1
200-335
0.25
DAr-2
263-356
0.57
DAr-2
230-360
0.39
DAr-2
200-335
0.29
DAr-3
263-356
0.58
DAr-3
230-360
0.39
DAr-3
200-335
0.29
DO
263-356
0.63
DO
230-360
0.42
DO
200-335
0.43
DAr-4
263-356
0.63
DAr-4
230-360
0.40
DAr-4
200-335
0.31
CT
263-356
0.59
CT
230-360
0.37
CT
200-335
0.27
DAr-5
263-356
0.64
DAr-5
230-360
0.37
DAr-5
200-335
0.27
HO
263-356
0.63
HO
230-360
0.27
HO
200-335
0.27
CT
CT
230-360
0.29
CT
200-335
0.29
Tabelul 4. Energia de activare a conductiei in domeniul de temperatura inalta in diferite atmosfere pentru probele de SnO2 si g-Al2O3
SnO2-500(referinta )
Gama-alumina(referinta )
Experiment
Experiment
Temperatura
(oC)
E (eV)
Temperatura
(oC)
E (eV)
DAr-1
DAr-1
200-400
0.43
262-400
0.43
DAr-2
DAr-2
200-400
0.38
220-400
0.38
DAr-3
DAr-3
200-400
0.41
220-400
0.41
DO
DO
330-400
0.20
270-400
0.20
DAr-4
DAr-4
200-400
CT
CT
200-400
0.45
295-400
0.45
DAr-5
DAr-5
200-400
HO
HO
200-400
0.47
285-400
0.47
CT
CT
200-400
0.50
305-400
0.50
CT= C3H6-aer 1:10,timp de contact 1.3 s
Valorile energiilor de activare ale conductiei la temperatura joasa (asociata cu desorbtia apei) sunt mai mari pentru probele suportate pe alumina decat pentru SnO2 indicand inca o data influenta suportului de alumina. In general este dificil sa se formuleze concluzii clare la acest stadiu al cunostiintelor pe baza energiilor de activare masurate. Trebuie insa remarcat ca valorile probei A1, (cu continutul cel mai mic de dioxid de staniu se apropie mai mult de cele ale aluminei in aceleasi conditi.
1.2.4. Concluzii
SnO2 prezinta la incalzire o comportare tipica de semiconductor de tip n; in zona de temperatura joasa se observa un maxim care se datoreaza implicarii conductiei protonice, datorata apei slab adsorbite, actionand ca un vehicul protonic.
g- Al2O3 are o conductie mult mai joasa, preponderent de tip protonic; curbele au o forma specifica de U, datorata scaderii in domeniul de temperatura joasa a conductiei protonice prin mecanism vehicul (prin pierderea de pe suprafata si din zona intergranulara a moleculelor de apa adsorbita fizic)
Conductibilitatea electrica a SnO2/g- Al2O3 imbina caracteristicile ambilor componenti, in functie de atmosfera si domeniul de temperatura
Energiile de activare ale conductiei sunt diferentiate in functie de natura probei si de domeniul de temperatura, indicand fenomene de conductie mixta electronic-protonic in functie de conditiile de lucru.
III.5 Studii IR pe Al2O3, SnO2/Al2O3 si SnO2-Pt/Al2O3
Pentru investigarea proprietatile acide ale suportului de Al2O3 si catalizatorilor SnO2/Al2O3 si SnO2-Pt/Al2O3 s-a folosit adsorbtia CO ca molecula proba [6].
Studiile IR s-au realizat cu un spectrometru Bio-Rad FTS 175 cu detector DTGS. S-au folosit pastile de proba cu masa in jur de 20 mg. Celula de cuart construita pentru temperaturi inalte este atasata la un sistem de vacuum ulta inalt. Pentru studiile de adsorbtie s-a folosit aceeasi cantitate de CO (4kPa). Inaintea adsorbtiei de CO, probele au fost pretratate in O2 in domeniul de temperatura 200-500oC.
Adsorbtia CO pe centri ion metalici
CO este cunoscut ca o baza slaba si poate fi folosit pentru identificarea centrilor acizi ai materialului solid. Aciditatea Lewis a aluminei este reprezentata prin doua tipuri de centri Al3+ nesaturati coordinativ: Al3+ octaedric (Al3+-oct) si Al3+ tetraedric (Al3+-tet). Datorita geometriei, ionul de aluminiu cu coordinare tetraedrica are un caracter Lewis mai pronuntat. Prin urmare, banda formata prin chemosorbtia CO pe centrii Al3+-tet este localizata la un numar de unda mai mare (in jur de 2230 cm-1) in comparatie cu banda aparuta ca urmare a chemosorbtiei CO pe centrii Al3+-oct (2200 cm-1). Figura 1
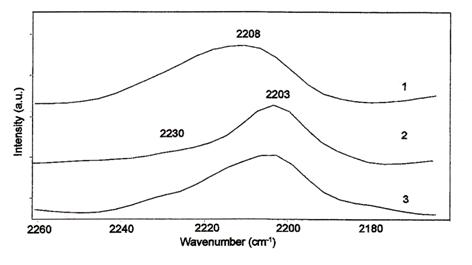
Figura 1. Spectrul IR al adsorbtiei de CO pe centri acizi Lewis ai aluminei dupa pretratamentul probelor in oxigen la 500oC: 1) Al2O3, 2) SnO2/Al2O3 3) SnO2-Pt/Al2O3
Indepartarea protonului si gruparilor OH de pe suprafata in timpul dehidroxilarii conduce la formarea defectelor de suprafata-oxigen si vacante de anion. Oxigenul are o sarcina negativa (centri bazici Lewis) si vacanta de anion o sarcina pozitiva (centri acizi Lewis).
Deoarece depunerea oxizilor metalici pe suport nu formeaza un monostrat, centri acizi Lewis ai aluminei se pot detecta si pe catalizatorul suportat. Cresterea temperaturii de dehidroxilare influenteaza direct distributia centrilor acizi Lewis pe suprafata si prin urmare influenteaza intensitatea benzilor apartinand centrilor Al3+. Banda corespunzatoare adsorbtiei CO pe Al3+-oct (CO-Al oct) se poate observa pentru toate probele dupa dehidroxilarea suprafetei la temperaturi mai mari de 300oC. Adsorbtia CO pe centri acizi mai tari Al3+-tet s-a detectat pe Al2O3, SnO2/Al2O3 si la 500oC.
Depunerea oxidului de staniu pe alumina, diminueaza populatia centrilor acizi Al3+-tet. Prezenta Sn si Pt influenteaza aciditatea suportului, facand taria centrilor acizi mult mai uniforma.
Adsorbtia CO s-a detectat si pe centri Ptn+. Proba oxidata de SnO2-Pt/Al2O3 prezinta o banda de adsorbtie a CO la 2132 cm-1 care a fost atribuita compusului Ptn+O-CO. Intensitatea acestei benzi creste cu cresterea temperaturii de dehidroxilare.
Benzile apartinand centrilor Snn+ nu au fost detectate in acest caz, dar existenta acestor centri a fost raportata in literatura.[7]
Adsorbtia CO pe specii ce contin oxigen

Analiza
datelor colectate in urma studiilor de adsorbtie de CO au aratat ca oxidarea CO
are loc pe suprafata oxidata a probelor suportate. Aceasta a fost confirmata de
prezenta benzilor la frecvente mai joase (sub 1800 cm-1) care au
fost atribuite speciilor de tip carbonat si bicarbonat. Aceste specii s-au
format ca rezultat al adsorbtiei CO cu implicarea gruparilor hidroxil de pe
suprafata probei (speciile bicarbonat), sau oxigenului retelei sau altor tipuri
de specii ce contin oxigen (specii carbonat).
(Me=Al, Sn): bicarbonat
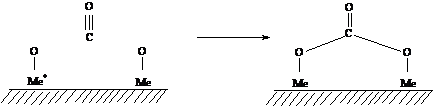
carbonat
Depunerea oxidului de staniu si doparea cu platina cresc gradul de formare al speciilor carbonat si bicarbonat pe suprafata. Benzile datorate speciilor carbonat si bicarbonat au fost observate dupa pretratamentul probelor in oxigen la temperatura mai mare de 300oC.
|
Gruparea bicarbonat 1227-1235 cm-1 -(COH) 1480-1490 cm-1-1(CO3H) 1640-1656 cm-1-4(CO3H) |
Gruparea carbonat 1780-1792 cm-1-(C=O) |
Bibliografie
[1] J.W.Niemantsverdriet, "Spectroscopy in catalysis- An Introduction", VCH- New York, Cambridge, Tokyo, (1993)
[2] P.V.Atkins, Physical Chemistri, Oxford University Press, 1986
[3] E. A. Paukshtis, E.N Yurchenko, Russ. Chem. Rev. 1983, 52, 42
[4] H. Knozinger in Elementary Reaction Steps in Heterogeneous Catalysis (Eds: R. W. Joyner, R.A. van Santen), Kluwer, Dordrecht, 1993, 267
[5]. J.A. Lercher, C. Grundling, G. Eder-Mirth, Catal. Today 1996, 27,353
[6]. T.Yuzhakova, A. Redey, M. Caldararu, A. Auroax, M. Scurtu, G. Postole, H. Nasser, J. Fazakas, 2nd International Conference on Thermal Engines and Environmental Engineering, 2, 165, 2007
[7]. Amalric-Popescu, D., Bozon-Verduraz, F., Catal. Today, 70, 139, 2001
[8]. Daturi, M., Appel, L. G., J. Catal. 209, 427, 2002
[9]. Ertl, G., Knozinger, H., and Weitkamp, J., "Handbook of Heterogeneous Catalysis." Wiley-VCH, New York, 1997
[10]. Hangchun, H., and Wachs, I. E., J. Phys. Chem. 99, 10897 (1995)
[11]. Desikan, A. N., Huang, L., and Oyama, S. T., J. Chem. Soc. Faraday Trans. 88, 22 3357, 1992
[12]. Niwa, M., Sano, M., Yamada, H., and Murakami, Y., J. Catal. 134, 331, 1992
[13]. Kasztelan, S., Payen, E., Toulhoat, H., Grimblot, J., and Bonnelle, J. P., Polyhedron 5, 157 (1986)
[14]. Groff, R. P., J. Catal. 86, 215 (1984)
[15]. Tatibouet, J. M., Appl. Catal. A 148, 213 (1997)
[16]. P. Emiroglu, N. Barsan, U. Weimar, V. Hoffman, Thin Solid Films, 391 (2001) 176
[17] P. Schuster, G.Zundel, C.Sandorfy, The hydrogen bond II, North-Holland Publishing Company, 1976, p.670
[18]. P.Concepcion, B.M.Reddy, H.Knozinger, FTIR study of low-temperature CO adsorption on pure Al2O3-TiO2 and V/Al2O3-TiO2 catalysts, Phys. Chem. Chem. Phys. 1 (1999) 3031