
|
|
|
Cristalizarea
zeolitilor poate avea loc la temperatura ambientala (25-60
In
general, zeolitii aluminosi cu raport Si /Al mic cristalizeaza
hidrotermal prin incalzire pe baie de apa (~95
In timpul cresterii temperaturii la nivelul amestecului de reactie au loc urmatoarele evenimente :
- accelerarea dizolvarii gelului cu formarea speciilor monomerice de silicat, aluminat si silicoaluminat;
- formarea dimerilor, trimerilor si tetramerilor,
- asocierea speciilor cu formarea unor anumite unitati secundare de constructie;
- nucleierea si cristalizarea zeolitului.
Cresterea temperaturii influenteaza viteza de crestere a cristalelor (scurteaza durata cristalizarii) iar pentru unii zeoliti duce si la cresterea dimensiunilor cristalelor (ZSM-5). Cresterea temperaturii de cristalizare are influenta si asupra densitatii produsului, produsul cristalin devenind cu structura inchisa.
Presiunea este un parametru fizic putin relevant deoarece cristalizarea zeolitilor are loc in general sub presiune autogena.
Timpul de cristalizare a unui zeolit variaza de la cateva ore pana la 100 de zile, in functie de compozitia amestecului si de temperatura la care se realizeaza cristalizarea. Pentru fiecare sinteza exista un timp optim pentru care randamentul in produsul cristalin si cristalinitatea zeolitului sunt maxime. Se determina pe baza curbei de cristalizare: % zeolit cristalizat vs. timp de cristalizare.
Agitarea amestecului supus cristalizarii conduce la modificarea concentratiei punctuale a reactantilor, la ruperea structurii gelului si formarea anumitor specii de silicat, aluminat si silico-aluminat precum si la uniformizarea temperaturii in masa de reactie.
Sinteza celor mai multe structuri zeolitice este favorizata de agitarea amestecului (continua sau discontinua) in timpul cristalizarii dar se cunosc cazuri cand agitarea nu permite obtinerea aceleiasi structuri obtinute din sistem fara agitare.
Tinand seama de fenomenele chimice care au loc in timpul genezei zeolitilor, procesul de cristalizare cuprinde 3 etape:
a. realizarea suprasaturarii solutiei in speciile formatoare de retea;
b. nucleierea si formarea germenilor de cristalizare;
c. cresterea cristalelor.
Curbele de cristalizare corespunzatoare au o forma sigmoidala evidentiind perioada de inductie (mai scurta sau mai lunga), perioada de cristalizare accelerata si perioada finala de atingere a cristalinitatii maxime (fig. II.1).
Mecanismul sintezei difera de la zeolitii aluminosi la cei siliciosi si poate fi reprezentat simplificat astfel. (fig. II.2).
In sinteza zeolitilor s-au urmarit doua obiective:
I. Cresterea
raportului Si/Al din reteaua zeolitica de la 1 in zeolitul LTA la
∞ in silicalit-1 (
Acest
lucru a fost posibil prin folosirea bazelor organice (cationi de
tetraalchilamoniu) cu rol de agenti de formare a structurilor zeolitice (template),
idee realizata pentru prima data
de catre R.M.Barrer in 1961 si care a condus la obtinerea
zeolitilor din familia PENTASIL,
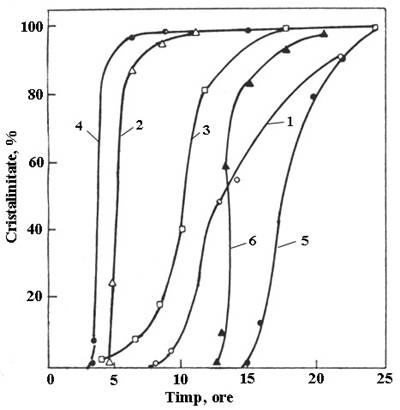
Fig. II.1. Curbe de cristalizare specifice zeolitilor ZSM-5
[203]: temperatura 170
[sursa de Si,
Al (P, Ge, Ga, Ti .)] (alti cationi) Reactantii de baza
![]()
Gelifiere (amestecare)

![]()
![]()
Hidrogel amorf
Incalzire, T = 50-300
Agent de mineralizare
![]()
Dizolvare![]()
-OH -F
![]()
![]()
![]()
![]()
![]()
![]()
Formarea SBU
Nucleiere si crestere a cristalelor Agent de formare sau modelare a structurii
Cristale de
zeolit cu retea rigida ce contine cavitati
si/sau canale -Na+, K+ - -H2O -molecule
organice
Fig. II.2. Mecanismul sintezei zeolitilor.
II. Introducerea altor elemente T in reteaua de silicoaluminat prin substitutie izomorfa partiala sau totala a Si4+ si Al3+. Au fost obtinuti astfel metalosilicatii cu B3+, Ga3+, Fe3+, Cr3+, Be2+, Ge4+, Ti4+, metaloaluminatul cu Ge4+ si apoi aluminofosfatii AlPO4-n, silicoaluminofosfatii SAPO-n si materialele micro-poroase MAPO, MAPSO, ElAPO si ElAPSO [16-20].
Substitutia izomorfa a Si4+ sau Al3+ cu alti atomi T aflati in stari diferite de valenta prezinta deosebit interes teoretic si practic. Se pot intalni patru tipuri de substitutie izomorfa si anume:
1. substitutie izomorfa cu un ion trivalent (B3+, Fe3+, Cr3+ Ga3+) cand reteaua cristalina isi pastreaza sarcinile negative excedentare dar se modifica parametrii celulei elementare, campul electrostatic, numarul si taria centrelor acide, caracterul hidrofil/hidrofob al retelei;
2. substitutia izomorfa a Al3+ cu un ion tetravalent ( Ge4+, Cr4+, Ti4+, Sn4+, Zr4+) cand reteaua cristalina devine electric neutra iar materialele respective nu au proprietatea de schimb cationic;
3. substitutia izomorfa cu un ion pentavalent ( P5+, As5+, V5+.) cand reteaua cristalina este neutra sau devine pozitiva cu proprietatea de schimb anionic. Prin inlocuirea totala a Si4+ cu P5+ s-au obtinut sitele moleculare AlPO, cu retea neutra si fara proprietatea de schimb ionic. Prin inlocuirea partiala a Al3+ si/sau a P5+ cu Si4+ s-au obtinut zeolitii de tip SAPO a caror retea este negativa (in anumite cazuri poate fi pozitiva).
4. substitutia izomorfa cu un ion divalent (Be2+, Mg2+, Mn2+, Co2+, Zn2+..) cand fiecare tetraedru substituit poarta doua sarcini negative ce trebuie compensate sau cand apar defecte de retea la atomii de oxigen.
Substitutia izomorfa cu un ion divalent duce la cresterea numarului de centre acide Brönsted iar substitutia cu un ion tetravalent duce la cresterea tariei centrelor acide.
Pentru a se realiza coordinarea tetraedrica trebuie sa fie indeplinita conditia de raport a razelor dintre atomul Tz+ si O2- :
0,225 < r Tz+ / r O2- < 0,414