
|
|
|
Determinarea numarului si a tariei centrelor acide se realizeaza prin aplicarea mai multor metode si anume:
metode titrimetrice: determinarea aciditatii Hammett (Ho) a zeolitilor folosind ca indicatori o serie de aniline bazice care isi schimba culoarea la o anumita tarie acida; metoda nu poate distinge aciditatea Brönsted de aciditatea Lewis si indica numai aciditatea exterioara a zeolitului intrucat moleculele mari ale indicatorilor Hammett nu pot patrunde in porii zeolitului.
metode bazate pe adsorbtia si desorbtia unor baze: prin masuratori calorimetrice ale caldurii de neutralizare din reactia acid-baza (H-zeolit + NH3), metoda de adsorbtie care necesita mult timp pentru atingerea echilibrului de adsorbtie si prin metoda de desorbtie a unei baze (de ex. NH3) prin desorbtie termoprogramata (TPD).
Desorbtia amoniacului
preadsorbit pe suprafata zeolitica la temperatura
programata furnizeaza date despre concentratia centrelor acide
cat si despre taria acestor centre. Analiza cantitativa a
amoniacului desorbit poate fi realizata prin titrare, cu ajutorul
spectrometriei de masa, prin spectroscopie IR sau prin inregistrare
cromatografica cu o celula de termoconductibilitate. Metoda titrarii amoniacului, data de
catre Kerr, este cea mai sigura. Proba de zeolit dupa activare
termica si purjare cu azot este adusa in contact cu amoniac
gazos care se retine prin adsorbtie fizica si chimica.
Pentru aprecierea centrelor acide si a tariei lor se ia in
consideratie numai amoniacul adsorbit chimic (NH![]() ). Taria
centrelor acide se apreciaza pe baza pierderii de amoniac odata cu
cresterea temperaturii. Temperatura la care se elimina cea mai mare
cantitate de amoniac (TM) este corelata cu taria
acida. Maximul picului de desorbtie (TM) este corelat cu
viteza de incalzire (B) a probei prin relatia:
). Taria
centrelor acide se apreciaza pe baza pierderii de amoniac odata cu
cresterea temperaturii. Temperatura la care se elimina cea mai mare
cantitate de amoniac (TM) este corelata cu taria
acida. Maximul picului de desorbtie (TM) este corelat cu
viteza de incalzire (B) a probei prin relatia:
![]()
in care:
am - cantitatea adsorbita la saturatie
K0 - factorul exponential al vitezei de desorbtie
Ed - energia de activare a desorbtiei
Prin reprezentarea Vdes./timp vs temperatura se obtine curba desorbtiei amoniacului care prezinta unul, doua sau mai multe picuri de desorbtie. In fig. III.1 este prezentat spectrul de desorbtie termoprogramata a amoniacului de pe zeolitul H-ZSM-5 in care raportul Si /Al = 30.
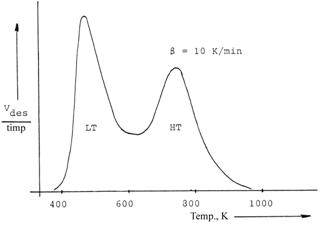
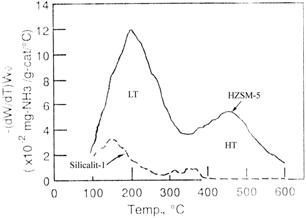
Fig. III.1. Curba desorbtiei termoprogramate a NH3 pe H-ZSM-5 (Si/Al=30) .[11, 15]
Picul de joasa
temperatura (LT) corespunde NH3 desorbit de pe centrele acide
slabe (80-
Drept molecula bazica pentru studiul aciditatii prin metoda TPD este utilizata si piridina.
metoda spectroscopiei IR:
a) determinarea grupelor hidroxilice (OH) (aciditatea Brönsted) si corelarea aciditatii cu frecventa de intindere a grupelor OH; cu cat legatura O-H este mai slaba cu atat frecventa de intindere este mai joasa si cu atat taria acida este mai puternica. Pentru zeolitul ZSM-5 cu raportul Si/Al = 30 picul specific grupelor OH mai acide se gaseste la ~ 3605 cm-1; b) determinarea aciditatii prin adsorbtia unei baze, cel mai adesea piridina, cand, in prezenta centrelor acide Brönsted se formeaza ionul piridiniu iar in prezenta centrelor acide Lewis molecula de piridina este legata coordinativ, fiecare legatura avand benzi de absorbtie IR caracteristice in domeniul vibratiilor de deformare : ~ 1545 cm-1 pentru ionul piridiniu chemosorbit si ~ 1465 cm-1 pentru piridina legata pe centrele acide Lewis.
- metoda
spectroscopiei RMN : spectrul 1H
Suprafata zeolitica, in special cea interna, are o energie ridicata si chiar la temperatura camerei se inregistreaza un proces lent de "relaxare" prin deplasarea ionilor de oxigen in structura cristalina datorita prezentei vacantelor anionice.
Ca urmare a deplasarii ionilor de oxigen in structura cristalina, centrele acide Brönsted si Lewis capata un caracter dinamic, proprietate specifica numai structurii zeolitice. Centrele acide dinamice de pe suprafata zeolitica accelereaza diverse reactii chimice mult mai eficient decat centrele acide de aceeasi natura si tarie de pe suprafata catalizatorilor amorfi.
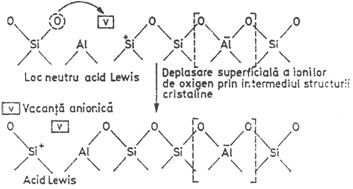
Aciditatea suprafetei zeolitice este puternic dependenta de temperatura. Cresterea temperaturii are ca rezultat scaderea aciditatii protonice si cresterea aciditatii neprotonice.
Desi marea majoritate a rezultatelor experimentale dovedesc ca reactiile accelerate de zeoliti se desfasoara pe centrele active cu caracter acid, totusi sunt mentionate si reactii, cum ar fi cea de rearanjare a tetrahidrofuranului in prezenta de H2S, la tetrahidrotiofen care este accelerata de formele alcaline ale zeolitilor: NaY, LiY, CaY. Piridina, care este otrava pentru catalizatorii cu centre acide, in cazul formelor alcaline favorizeaza unele reactii. Pe baza studiilor prin spectroscopie IR s-a constatat ca centrele acide protonice, responsabile pentru activitatea catalitica in numeroase reactii sunt situate in general in locuri accesibile moleculelor reactante. Independent de natura si localizarea lor, centrele acide sunt influentate de o serie de factori, cum sunt: gradul de schimb al ionilor Na + cu H + sau cu cationi polivalenti, natura cationului de schimb, temperatura si "istoricul" probei. Inlocuirea ionilor de Na + cu H + sau cationi polivalenti duce la cresterea aciditatii suprafetei zeolitului. Taria centrelor acide Brönsted este modificata ca urmare a actiunii polarizante exercitata de campul electrostatic atasat cationului, asupra grupelor hidroxilice.
Aciditatea suprafetei zeolitice este puternic dependenta de temperatura. Cresterea temperaturii are ca rezultat scaderea aciditatii protonice si cresterea aciditatii neprotonice.
Influenta exercitata de temperatura asupra aciditatii la tipuri structurale diferite caracterizate prin rapoarte molare SiO2 /Al2O3 variabile, este mai accentuata fata de tipul structural (H-ZSM-5 < H - MOR < HY) decat de valoarea raportului molar propriu aceluiasi tip structural.
Influenta diferitilor factori asupra tipului si tariei centrelor zeolitice acide este redata in figura III.2.

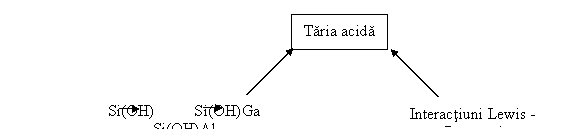
Fig. III 2. Factorii care influenteaza taria centrelor zeolitice acid.
Exista o relatie de legatura
intre unghiul legaturilor T - O -T si protonii asociati din
zeoliti, cresterea valorii unghiului determinand cresterea
aciditatii zeolitilor. Astfel, centrele protonice din HMOR
(unghiul T - O - T = 143 -180 0) si din zeolitii HMFI
(unghiul T - O - T = 133 - 177 0) sunt mai puternice decat cele din
zeolitii HFAU (unghiul T - O - T = 138 - 147 0). Acest lucru poate
explica de ce zeolitii HMOR la 200 - 250
Un pas hotarator in designul
tariei acide a catalizatorilor zeolitici a constituit-o sinteza
metalosilicatilor care contin in structura alte elemente
trivalente (B, Ga, Ge, In) decat Al. Studiile FTIR si TPD-NH3
efectuate pe metalosilicati cu structura
B(OH)Si < In(OH)Si << Fe(OH)Si < Ga(OH)Si < Al(OH)Si
Taria centrelor protonice
depinde de gradul de schimb ionic al cationilor Na+ (cu H+
dar nu numai) din retelele zeolitice, aciditatea creste cu gradul de
schimb ionic (schimbul ionic avansat putand determina o crestere a
tariei centrelor acide deja prezente in structura zeolitilor).
Studiile teoretice si experimentale efectuate asupra influentei
raportului Si /Al asupra aciditatii zeolitilor au condus la
concluzia ca taria centrelor protonice este influentata de
natura atomilor vecini. Fiecare atom de Al din retea este inconjurat de 4
atomi de Si (regula lui Lowenstein) (atomi nereast neighbors -NN), iar in prima
vecinatate de 9-12 atomi de Si sau Al in functie de topologia
retelei (next nereast neighbors-
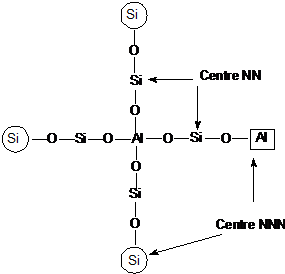
Utilizand
metoda calculelor statistice Wetcher a constatat ca valoarea raportului Si
/Al in care atomii de Al sunt izolati a fost de 7 (pentru zeolitii
avand 9 sau 12 atomi de atomi de Si sau Al in pozitiile
Speciile de Al extraretea rezultate in urma tratamentelor "blande" cu abur, au ca efect cresterea activitatii catalitice a zeolitilor. Cresterea activitatii este atribuita centrelor care prezinta o aciditate marita ca urmare a interactiunilor dintre grupele OH (centrele acide Brönsted) si speciile de Al extraretea (centre acide Lewis).
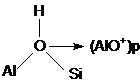
In sprijinul acestei ipoteze vine faptul ca indepartarea speciilor de Al extraretea prin tratamente acide sau cu hexafluorosilicat de amoniu are ca efect scaderea drastica a aciditatii zeolitilor.
Cresterea aciditatii in urma tratamentelor moderate cu abur este rezultatul interactiunilor dintre centrele protonice si speciile de Al extraretea, fapt confirmat in cazul zeolitilor FAU prin aparitia in spectrele IR a doua benzi aditionale la 3600 si 3525 cm-1. Acestea rezulta din deplasarea batocromica a benzilor de inalta si joasa frecventa (caracteristice gruparilor OH localizate in supercavitati si in prismele hexagonale). Aceasta deplasare batocromica este in concordanta cu extragerea unui electron de la gruparile hidroxil legate de speciile extraretea, fapt care conduce la slabirea legaturilor O - H si implicit la cresterea aciditatii.
Un alt factor important pentru activitatea catalizatorilor zeolitici il constituie accesibilitatea centrelor protonice. In mod evident ca, accesibilitatea centrelor acide depinde de localizarea acestora si dimensiunile moleculelor reactante. Astfel, in cazul zeolitilor cu structura tip FAU, centrele protonice situate in supercavitati sunt accesibile pentru majoritatea substantelor organice, comparativ cu centrele situate in prismele hexagonale care nu sunt accesibile moleculelor organice mari. In cazul zeolitilor cu structura tip MOR centrele protonice situate in canalele mai mari vor fi accesibile mai multor molecule organice comparativ cu centrele situate in interiorul "buzunarelor". In cazul zeolitilor HMFI, majoritatea centrelor protonice fiind situate la intersectiile canalelor vor fi egal accesibile sau inaccesibile moleculelor organice in functie de dimensiunile acestora. Acelasi lucru este valabil si in cazul zeolitilor HERI unde desi majoritatea centrelor acide sunt situate in interiorul cavitatilor mari datorita dimensiunilor ferestrelor de acces aceste vor fi disponibile doar moleculelor organice mici.
Molecule situate in interiorul nanocavitatilor zeolitice vor avea proprietatile electronice modificate. Astfel, dipol momentul acetonitrilului creste semnificativ in cazul adsorbtiei acestuia in "buzunarele" mordenitului comparativ cu adsorbtia acestuia in canalele liniare ale aceluiasi zeolit. Moleculele adsorbite in interiorul porilor /cavitatilor zeolitice capata caracter bazic fiind usor de protonat. Se poate spune ca zeolitii actioneaza ca solventi solizi, iar retelele lor anionice actioneaza ca baze conjugate ale protonilor stabilizand intermediarii de reactie pe parcursul mecanismelor concertate de reactie.