
|
|
|
STRUCTURA DE BAZA A POMPEI DE EFLUX AcrB CU MULTIPLE CAPACITATI DE LEGARE A MEDICAMENTELOR
Pompele de eflux implicate in transportul medicamentelor sunt responsabile de cauzarea diverselor probleme aparute in chemoterapia in cancer si in tratamentul infectiilor bacteriene.
Prin tehnica cristalografierii cu raze X, s-a obtinut o structura trimerica a pompei AcrB de la Esherichia coli, cu 4 leganzi structurali diferiti.
Structurile arata ca 3 molecule de liganzi se leaga simultan la o cavitate centrala de aprox. 5000 Ǻ3 , mai intai prin interactiuni hidrofobice, aromatice si prin interactiuni de tip van der Waals. Fiecare ligand foloseste un set diferit de resturi proteice AcrB pentru legare.
Moleculele de liganzi deseori interactioneaza una cu cealalta, stabilizand legatura.
La bacterii, rezistenta la medicamente este deseori asociata cu transportorii de medicamente, functionand in vederea eliberarii celulei de surplusul de medicamente.
AcrB-ul E.coli, este un transportor energizat de forta proton-motoare, acest lucru arata specificitatea stricta fata de subtrat dovedita in randul celor mai cunoscute pompe de eflux al medicamentelor, recunoscand de la cele mai cunoscute si curent folosite tipuri de antibiotice, pana la simpli solventi.
Proprietatile acestei pompe au fost stabilite prin reconstituire, servind ca prototip al transportorilor bacterieni de medicamente, folosite in studiul mecanismelor de transport cu specific medicamentelor.
Structura trimerica de liber-ligand, a fost determinata prin cristalografiere cu raze X in laboratorul lui Yamaguchi, munca sa deschizand o abordare a detaliilor structurale si de captura a transportorilor.
Fiecare ligand se pare ca leaga in situsuri diferite in cavitatea centrala transmembranara a trimerului, aratand si micile schimbari conformationale in proteina transportor la legarea in substrat.
 Structura
liber-ligandului AcrB arata ca este un homotrimer cu o greutate de
aprox. 11kDa/ unitate.
Structura
liber-ligandului AcrB arata ca este un homotrimer cu o greutate de
aprox. 11kDa/ unitate.
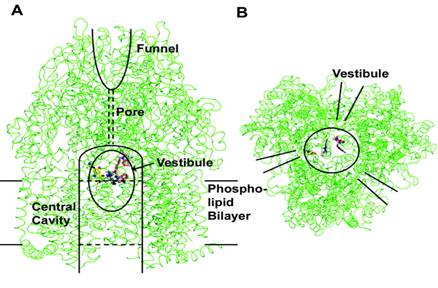
Fiecare subunitate este alcatuita din 12 α-helice transmembranare si 3 domenii largi periplasmice (fiecare de cate 300 de resturi proteice) situate intre helicele α1 si α2, respectiv intre α7 si α8.
Analizele cu raze X au aratat ca cele 3 domenii periplasmice, formeaza in centru o structura de tip "furnal" si un por conector imprejmuit.
Porul este deschis spre periplasma prin 3 vestibuli situati la interfata subunitatilor.
Acesti vestibuli se presupune ca permit accesul direct al medicamentelor prin periplasma, precum si de pe suprafata externa a membranei citoplasmatice.
Cele 3 domenii transmembranare ale promotorilor AcrB, formeaza o cavitate centrala cu un diametru de 30 Ǻ, ce patrunde prin membrana citoplasmatica si se extinde in citoplasma.
In purificarea tipului salbatic de AcrB, acesta a fost supus cristalizarii in prezenta a 4 agenti diferiti structural; rodamina 6G (R6G), ethidium (Et), dequalinium (Dq) si ciproflaxacin (Cip).
La concentratii mai mari de 100 µM, s-a realizat intr-un procent de 50 %, inhibarea reactiei de excludere fosfolipidica, in urma cristalizarii AcrB.
Structura cristalizata arata ca acesti liganzi se leaga in diverse locatii in cavitatea centrala, fiecare folosind un subset diferit de resturi proteice, scazand cu succes rangul de potential al interactiunilor proteina-medicament.
Suprafata interna a partii superioare a cavitatii este inconjurata de resturi hidrofobe, incluzand 12 resturi bine conservate de fenilalanina (Phe386, Phe388, Phe458, Phe459).
Acesti promotori sunt implicati in legarea medicamentelor sugerand ca legarea este determinata de interactiuni atat hidrofobe cat si aromatice π-π.
Un alt lucru important ar fi legarea tuturor liganzilor mai ales in aria care s-ar afla in imediata apropiere a suprafetei externe a substratului lipidic, daca, si asa se pare a fi, aceasta cavitate ar fi de aceeasi origine cu bistratul.
1 STRUCTURA COMPLEXULUI R6G
Acest complex contine o bucla intre helicele α3 si α4, si helicele α5 si α6, formand un domeniu de legare in centrul cavitatii centrale cu orientare citoplasmatica.
Cavitatea de legare este extensiva si ocupa cea mai mare parte a jumatatii superioare a regiunii transmembranare. La R6G, situsul de legare al unei singure subunitati se afla la o distanta de 6Ǻ fata de ligand, si contine resturi de Phe386, Ala385, Leu25, Val382, Lys29 si Phe386' de la subunitatea vecina (marcarea numarului prim reprezinta apartenenta restului la subunitatea vecina).
AcrB este un homotrimer, iar fiecare molecula de R6G se leaga la aria ce corespunde granitei dintre cele 2 subunitati vecine, aceste 3 situsuri identice sunt asezate fata in fata in cavitatea centrala.
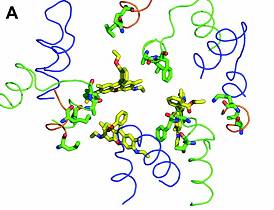
Fig. 18. A.Structura 3D a complexului R6G /legare la substrat.
full/185/19/5657/F3
Se asista reciproc si interactioneaza una cu cealalta, formand un buzunar unic, larg pentru legarea a 3 molecule de medicamente.
Lys29 , localizata in vestibulul fiecarei subunitati, pare sa isi indrepte lantul lateral spre grupul estic al fiecarui substrat.
Este de notat faptul ca toate celelalte resturi aflate la distante de 6Ǻ de ligand, sunt aminoacizi hidrofobi, sugerand astfel importanta interactiunilor hidrofobe si, posibil a celor van der Waals in legarea medicamentelor.
Cele 3 molecule de liganzi par sa interactioneze reciproc in stabilizarea configuratiei finale.
STRUCTURA COMPLEXULUI ET
In complexul AcrB-Et, Et (ethidium), se realizeaza legarea la un situs distinct, dar se pare ca se revarsa peste situsul de legare a R6G.
In comparatie cu legatura R6G, Et se afla legat la 6Ǻ distanta deasupra situsului de legare a R6G, situsul de legare a Et fiind situat mai aproape de vestibul decat cel al R6G.
Resturile de aminoacizi din aria de 6Ǻ ai Et includ Phe386 si Ala385 intr-o subunitate, si Phe386' din subunitatea vecina. Phe388 este usor mai indepartata (7-8Ǻ), Et fiind mai apropiat de Phe386 (~4Ǻ).
Gruparea de fenil a Et este legata deasupra Phe386', interactionand in apropiere cu acest rest. In acest fel, molecula de Et este facuta "sandwich" intre doua subunitati ale transportorului.
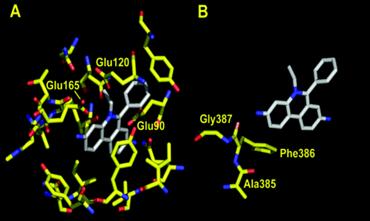
Fig. 18.B (A/B) Structura 3D a legaturii de Et/ http://jb.asm.org/cgi/content/full/185/19/5657/F4
Ca si la R6G, majoritatea acestor legaturi sunt hidrofobe. In buzunarul de legare, carbonilul oxigenului apartinand Phe386 , se afla in apropierea unei grupari amino a Et (la 3,6Ǻ), si poate contribui la neutralizarea incarcaturii formale a substratului. Tripla legatura a moleculelor Et se afla la o distanta de ~3,2Ǻ una fata de cealalta, indicand faptul ca acesti liganzi interactioneaza puternic la nivelul cavitatii centrale.
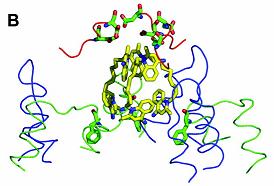
3. STRUCTURA LEGATURII Dq
Moleculele cu tripla legare a Dq (dequalinium), ocupa o regiune extinsa a partii superioare a buzunarului de legare. In cei 6Ǻ ai unei molecule Dq se afla 2 resturi de acizi, Asp99 si Asp101 , si un rest de Ile102 , in apropierea zonei superioare a varfului apartinand gruparii quinolinium.
Asp99 este inalt conservat, acest lucru aratand importanta acestui rest in recunoasterea medicamentelor cationice.
 Acest
grup de quinolinium din varf, formeaza un complex strans cu alte
grupari de quinolinium si in
alte 2 molecule de medicament.
Acest
grup de quinolinium din varf, formeaza un complex strans cu alte
grupari de quinolinium si in
alte 2 molecule de medicament.
C
Fig.18. C. Structura 3D al complexului Dq, legare la substrat/ http://jb.asm.org/cgi/content/full/185/19/5657/F3
In contrast, partea inferioara a ligandului, cu alte doua grupari de quinolinium, nu se afla la distanta normala de 6Ǻ fata de vreun rest din peretele cavitatii, dar se afla la ~6.3Ǻ departare de cele 2 resturi de Phe (Phe386 si Phe386') ale subunitatilor vecine.
Contactele dintre moleculele Dq sunt dominate, ca si cele din complexele R6G si Et, de interactiuni hidrofobe, exceptand portiunea din varf dominata de prezenta gruparii de quinolinium unde se desfasoara interactiuni cu potential electrostatic puternic.
Deasemeni, interactiunile de tip medicament - medicament, se pare ca sunt foarte straanse in cadrul acestui complex.
4. STRUCTURA MOLECULEI CIP
Ca si cu R6g, molecula Cip este legata intre 2 subunitati proteice. Resturile aflate la distanta de 6Ǻ a legaturii ciprofloxacin, includ Phe458 , Phe459 , si Lys29 , Leu25 si Ala385' de la subunitatea vecina. In acest complex, majoritatea interactiunilor de legare sunt hidrofobe. Grupul ciclopropil apartinand moleculei de medicament interactioneaza cu Phe458 si Phe459 . din subunitatea vecina, lanturile laterale de Leu25' si Lys29', se afla in apropierea inelului de nitrogen al grupului de quinolon. Distanta de 5Ǻ dintre grupul ɛ-amino al Lys si inelul de nitrogen sarac in electroni, sugereaza anumite contributii bipolare.
Interactiunile dintre gruparile carbonil-oxigen si resturile proteice ale Cip, interactioneaza cu moleculele de apa ce pot aparea la un moment dat in transport.
D
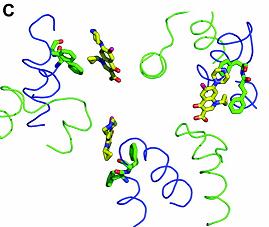
Fig. 18. D. Structura 3D a complexului Cip/ legare la substrat.
Moleculele de medicamente ce sunt legate la cavitatea centrala a transportorului AcrB, sunt probabil impinse afara prin domeniile periplasmice ale pompei, prin tunelul TolC ( proteina dinafara membranei ce impreuna cu proteina AcrA formeaza complexul AcrB), si apoi in mediul extracelular. Cea mai directa cale de extragere poate fi prin porul central, format de helicele porului din domeniul periplasmic cu resturi de la 102 la 115.
Aceste resturi interactioneaza exact in centrul celor 3 subunitati, iar porul se inchide.
Probabil fluxul de protoni ce urmeaza legarii, produce o schimbare conformationala destul de importanta a AcrB-ului, ce conduce la deschiderea porului si pornirea mecanismului de tip-elevator al expulzarii medicamentelor.
Studii genetice recente, la nivelul domeniilor si al resturilor, apar importante in efluxul la nivelul substratului mediat de pompa AcrB, precum si la nivelul altor astfel de pompe.
Domeniul periplasmic este cel care detine un rol major in determinarea specificitatii de substrat a acestor pompe.
Structurile liganzilor arata ca diverse chimicale au abilitatea de a lega grupari polare complementare si hidrofobe la cavitatea centrala a transportorului de eflux.