
|
|
|
Spectrele de fluorescenta si fosforescentam sunt situate in domeniul spectral UV- VIS. Cele doua tipuri de spectre difera prin mecanismul de producere. Prin absorbtie de energie moleculele trec din starea electronica fundamentala, de regula o stare singlet S0, pe un nivel electronic superior S1, S2, (Figura .IV. 14).
In aceste stari moleculele pot suferi procese neradiative rapide (10-15s ) numite conversii interne (C.I) prin care ajung pe primul nivel de vibratie al primului nivel electronic excitat S1. Timpul de viata in aceasta stare este de ordinul 10-9 - 10-8s. Si din aceasta stare moleculele pot suferi procese neradiative insotite in unele cazuri si de procese radiative de emisie de energie, sub forma radiatiei de fluorescenta, in urma carora moleculele trec radiativ pe diferite nivele vibrationale ale starii fundamentale. Deci procesul de emisie radiativa este un proces ce trebuie sa fie competitiv cu procesele neradiative, care de regula sunt mult mai eficiente.
In cazul in care radiatia de
fluorescenta poate fi observata, indiferent de frecventa
radiatiei absorbite (nabs), spectrul de fluorescenta va
consta dintr-o banda de fluorescenta pozitionata la
frecvente mai mici decat cele absorbite (nf) si se datoreaza tranzitiilor
radiative S1![]() S0, intre cele doua stari de
singlet.
S0, intre cele doua stari de
singlet.
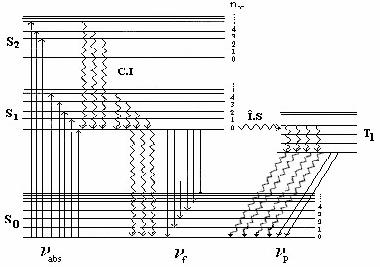
Figura IV.14 Mecanismul emisiei de fluorescenta nfsi fosforescenta np
Din Figura IV.14 se observa ca numai tranzitia 0 - 0 conduce la aceeasi frecventa atat in absorbtie cat si in emisie, iar componentele vibrationale ale benzii de fluorescenta corespund la frecvente mai mici decat cele ale benzii de absorbtie.
Acest fapt explica legea empirica a lui Stokes conform careia lungimile de unda ale radiatiei de fluorescenta sunt mai mari decat cea a radiatiei excitatoare. In unele cazuri se poate observa si radiatia de fluorescenta anti-Stokes, cu frecventa mai mare decat cea absorbita, datorata absorbtiei de catre molecule aflate pe nivele de vibratie superioare ale starii S0 si revenirea pe nivelul de zero. De asemenea se observa ca, dat fiind relativa similitudine a distributiei moleculelor pe nivelele de vibratie ale starilor S0 si S1, componentele vibrationale ale spectrului de fluorescenta se prezinta aproximativ ca imaginea in oglinda a celor din spectrul de absorbtie.
Emisia de fosforescenta a moleculelor,
spre deosebire de emisia de fluorescenta, continua si
dupa indepartarea sursei de excitare. Aceasta emisie este
caracterizata prin implicarea unor stari excitate cu timp de viata
mult mai mari , de ordinul a 10-4 s pana la cateva secunde,
fiind datorata unor tranzitii ![]() , interzise de regula de selectie privind conservarea
spinului. Stare de triplet T1 nu poate fi atinsa prin excitare
directa, tranzitia
, interzise de regula de selectie privind conservarea
spinului. Stare de triplet T1 nu poate fi atinsa prin excitare
directa, tranzitia ![]() fiind de asemenea
interzisa de aceeasi regula, dar poate fi atinsa in urma
unui proces neradiativ de incrucisare de sisteme (intersystem crossing ),
datorat intersectiei suprafetei de energie potentiala a
starii de singlet S0, cu suprafata de energie
potentiala a starii T1, prin contributia nivelelor
vibrationale corespunzatoare acestei stari (I.S in Figura
IV.14).
fiind de asemenea
interzisa de aceeasi regula, dar poate fi atinsa in urma
unui proces neradiativ de incrucisare de sisteme (intersystem crossing ),
datorat intersectiei suprafetei de energie potentiala a
starii de singlet S0, cu suprafata de energie
potentiala a starii T1, prin contributia nivelelor
vibrationale corespunzatoare acestei stari (I.S in Figura
IV.14).
Tranzitia radiativa ![]() fiind interzisa,
moleculele ajung, de regula, in stare fundamentala S0 prin
procese neradiative, astfel ca probabilitatea unui proces radiativ este
foarte mica, fenomenul de fosforescenta fiind un proces mult mai
putin intalnit decat cel de fluorescenta.
fiind interzisa,
moleculele ajung, de regula, in stare fundamentala S0 prin
procese neradiative, astfel ca probabilitatea unui proces radiativ este
foarte mica, fenomenul de fosforescenta fiind un proces mult mai
putin intalnit decat cel de fluorescenta.
Datorita faptului ca stare de triplet este inferioara energetic starii de singlet, radiatia de fosforescenta va fi deplasata spre frecvente mai mici decat cele corespunzatoare radiatiei de fluorescenta.
Prin randament de emisie (de fosforescenta sau fluorescenta) F se intelege raportul intre numarul de fotoni emisi si numarul de fotoni absorbiti de substanta:
F = ![]() (IV.18)
(IV.18)
Datorita proceselor de dezactivare (stingere ) neradiative acest randa-ment este intotdeauna subunitar.
![]() (IV.19)
(IV.19)
unde: [Q] este concentratia stingatorului, τ este timpul de viata a speciei fluorescente, iar k este constanta de viteza a reactiei de stingere.
Reprezentarea grafica a raportului I / IQ functie de [Q] , permite ca din panta dreptei obtinute (tg a = k t sa se determine timpul de viata t al speciei excitate.
Se poate inregistra eficacitate procesului de excitare, prin inregistrarea variatiei intensitatii emisiei de fluorescenta, in functie de lungimea de unda a radiatiei de excitare. Se obtine in felul acesta spectrul de excitare, care este similar cu cel de absorbtie.
Emisia de fluorescenta poate fi folosita si in determinarile analitice, fiind o metoda mult mai sensibila decat absorbtia, coborand limita inferioara a determinarilor de concentratie in domeniul 10-5 mol/l.
Emisiei de fluorescenta este de un real folos in punerea in evidenta si studierea interactiilor intermoleculare, dar si in determinarea unor proprietati a starilor excitate, precum ar fi variatia aciditatii si a momentului de dipol.
Bibliografie
1. I.G. Murgulescu, Introducere in Chimie Fizica, vol I.1, Atomi. Molecule.Legatura chimica, Ed. Academiei RSR, Bucuresti, 1976.
2. I.G. Murgulescu, V. Em. Sahini, Introducere in Chimie Fizica, vol I.2, Structura si proprietatile moleculelor, Ed. Academiei RSR, Bucuresti, 1978
3. I. Cadariu, Chimie Fizica, vol. 1, Structura atomului si a moleculei, Ed. Tehnica, Bucuresti, 1967.
4. I.Zsako, Chimie Fizica, Structura atomilor si a moleculelor, Ed. Didactica si Pedagogica, Bucuresti,1973.
5. V. Em. Sahini, Mihaela Hillebrand, Chimie cuantica in exemple si aplicatii, Ed. Academiei RSR, Bucuresti,1985.
6. H.Eyring, Quantum Chemistry, John Wiley & Sons, Inc., New York, 1967.
7. T. Schlick, Molecular Modeling and Simulations, Springer-Verlag, New York, Inc., 2002.
8. HyperChem Computational Chemistry, Hzpercube, Inc., 2002.
9. F. Ercolessi, A molecular dznamics primer, http://www.sissa.it/furio/
10. Mariana Ciureanu, Spectroscopia de rezonanta magnetica nucleara, Ed. Stiintifica si Enciclopedica, Bucuresti, 1989.
11. S. Mager, Analiza structurala organica, Ed. Stiintifica si Enciclopedica, Bucuresti, 1979.
12. Margareta Avram, Gh. D. Mateescu, Spectroscopia in Infarosu, Aplicatii in Chimia Organica, Ed. Tenica, Bucuresti, 1966.