|
|
|
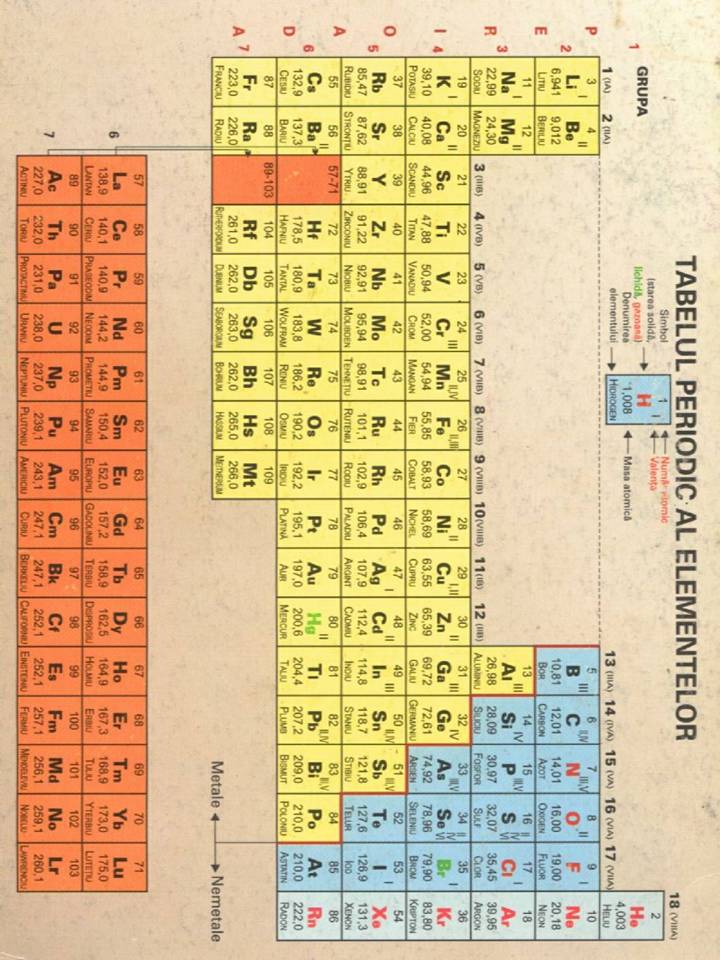
Legatura chimica este forta de atractie care se manifesta intre atomi legandu-i in molecule, ioni, radicali.
In general, legaturile chimice au caracter ionic si covalent, exceptie facand legaturile dintre atomi identici (acestea sunt covalente 100%). Legaturile ionice si covalente separate sunt intalnite destul de rar. Disponibilitatea pentru o anumita legatura imparte compusii in: ionici si covalenti.
Legatura ionica este formata prin atragerea electrostatica cu sarcini opuse si are loc intre metalele tipice si nemetalele tipice. Pentru a forma o configuratie electronica exterioara de echilibru (8 electroni), atomii se pot asocia prin cedarea si respectiv primirea de unul sau doi electroni. Se formeza astfel o molecula a carei legatura ionica (polara, heteropolara, electrovalenta) se bazeaza pe atractia electrostatica exercitata intre atomii ionizati pozitiv sau negativ. Atomii astfel construiti in stare solida se organizeaza sub forma de cristale, care datorita tipului de legatura se numesc cristale ionice. Cristalele ionice tipice se formeaza ca rezultat al reactiei dintre un element metalic puternic electropozitiv (grupele I,II) cu un element puternic electronegativ (grupele VI, VII). Metalele de tranzitie pot forma si ele cristale atunci cand diferenta de electronegativitate este indeajuns de mare. ex tipic:clorura de sodiu (NaCl) Teoria clasica a lui Born si Madelung da o imagine clara asupra naturii legaturii ionice. Intre doi atomi apropiati, unul ionizat pozitiv si altul negativ, apar forte electrostatice centrale de atractie care variaza cu patratul distantei si forte de respingere care variaza rapid cu inversul distantei la o putere n>2.
Legatura covalenta este legatura chimica in care atomii sunt legati intre ei prin perechi de electroni puse in comun, atomii avand pozitii fixe unii fata de altii. Aceasta apare doar intre atomii nemetalelor, iar rezultatul legarii se numeste molecula.
Legatura covalenta poate fi de trei feluri, dupa modalitatea de punere in comun a electronilor. Astfel, ea este:
Legatura metalica. Mineralogul si chimistul norvegian V.M.Goldschmidt considera ca intre atomii unui metal ar exista covalente. L.Pauling considera ca in reteaua metalica legaturile dintre atomi sunt in rezonanta, electronii de valenta fiind repartizati statistic in mod egal intre toti atomii alaturati ai retelei cristaline. De exemplu, in reteaua cristalina a sodiului fiecare atom, avand un electron de valenta in orbitalul 3s, poate forma o covalenta cu un atom vecin. Prin urmare, dupa L.Pauling, intre atomii unui metal se stabilesc legaturi dielectronice, labile, care se desfac si se refac necontenit, intre diferitele perechi de atomi vecini din retea. La formarea legaturilor metalice in sodiul cristalizat ia parte numai electronul de valenta al fiecarui atom in parte. Pentru explicarea intensitatii legaturii metalice, L.Pauling considera ca prin transfer de electroni de la un atom la altul se formeaza si structuri ionice. Prin urmare, la metale unii atomi primesc mai multi electroni decat pot include in stratul de valenta.
Coeziunea mare a metalelor este explicata de catre L.Pauling prin existenta valentei metalice, care este cuprinsa intre 1 si 6. Valenta metalica este reprezentata de numarul electronilor care participa la formarea legaturii metalice. Pentru elementele cu Z=19-31 valenta metalica este reprezentata de cifra scrisa deasupra fiecarui element. Prin urmare, numarul maxim de legaturi metalice este format de metalele tranzitionale cu coeziune maxima din grupele VI b, VII b si VIII b.
Metalele al caror numar de legaturi metalice este mare, au raze atomice mici, densitati si duritati mari, temperaturi de topire si de fierbere ridicate, precum si o rezistenta remarcabila la solicitarile mecanice exterioare.
Spre deosebire de covalente, legaturile metalice sunt nesaturate, nelocalizate si nedirijate in spatiu, ceea ce ar explica plasticitatea metalelor.
Neon - Sodiu - Magneziu
Li
Na
K
Proprietati generale
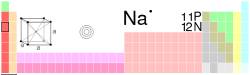
Nume, Simbol, Numar atomic
Sodiu, Na, 11
Serie chimica
Metal alcalin
Grupa, Perioada, Bloc
I A (1), 3 , s
Densitate,
968 kg/m3
Duritate Mohs
0,5
Infatisare
alb, argintiu

Proprietati atomice
Masa atomica
22,989770 uam
Raza atomica (calc.)
180 (190) pm
Raza covalenta
154 pm
Raza van der Waals
227 pm
Configuratie electronica
[Ne]3s1
e- pe nivel de energie
2, 8, 1
Numar de oxidare (Oxid)
1 (baza puternica)
Structura cristalina
Cubica, centrata in corp
Proprietati fizice
Stare de agregare
solida (nemagnetica)
Punct de topire
370,87 K (97,72°C)
Punct de fierbere
1156 K (883°C)
Volum molar
23,78 ×10-6 m3/mol
Energie de vaporizare
96,96 kJ/mol
Energie de combinare
2,598 kJ/mol
Presiunea vaporilor
1,43 × 10-5 Pa la 1234 K
Viteza sunetului
3200 m/s la 293.15 K
Sodiul este cel mai raspandit metal alcalin din scoarta Pamantului, dar si unul dintre cele mai raspandite din Univers. In natura se gaseste sub forma depozitelor masive de sare gema (clorura de sodiu, NaCl), in mineralul halit, in combinatie cu clorura de potasiu), in silvina, impreuna cu aluminiul in criolit (Na3AlF6), sau sub forma de azotat in salpetrul de Chile (NaNO3 azotat de sodiu), reprezentand 2,6% din masa scoartei terestre. In apa marina, ionii de Na+ ii insotesc pe cei de Cl-.
Liniile spectrale D ale sodiului se gasesc in majoritatea stelelor, precum si in Soare.
Sodiul metalic se obtine prin electroliza uscata a clorurii de sodiu (NaCl), metoda mai ieftina decat electroliza hidroxidului de sodiu (NaOH).
O multime de compusi ai sodiului au aplicatii. Sodiul metalic se foloseste pentru a obtine compusi organici. NaCl are un rol foarte important in procesele fiziologice din organism.
Dintre utilizarile sodiului, amintim:
Pentru industrie, compusii cei mai
importanti sunt: clorura de sodiu (NaCl),
carbonatul de sodiu (Na2CO3),
bicarbonatul de sodiu (NaHCO3),
salpetrul de
Ionii de sodiu au o mare importanta in procesele fiziologice din organism, in depolarizarea membranelor, si in transmiterea stimulilor. Contrar tendintei de difuzie, pompa de sodiu-potasiu scoate ioni Na+ din celula si introduce ioni K+, polarizand membranele (datorita diferentelor de concentratie de Na si K fata de fetele membranei), pozitiv la interior si negativ la exterior. In timpul depolarizarii, sodiul patrunde masiv in celula si potasiul iese, schimband polarizarea membranei.
De asemenea, ionii de Na+ si ionii de Ca+2 sunt importanti in crearea lucrului mecanic in muschi.
Serul fiziologic perfuzabil este o solutie de 0,9% NaCl, izotonica.
Sulf - Clor - Argon
F
Cl
Br

Tabelul intreg
Proprietati generale
Nume, Simbol, Numar atomic
Clor, Cl, 17
Serie chimica
Halogen
Grupa, Perioada, Bloc
VIIA (17), 3 , p
Densitate, Duritate
3.214 kg/m3
Infatisare
gaz verde-galbui
Fisier:Cl,11-thumb.jpg
Propietati atomice
Masa atomica
35,453 uam
Raza atomica (calc.)
100 (79) pm
Raza covalenta
99 pm
Raza van der Waals
175 pm
Configuratie electronica
[Ne]3s2p5
e- pe nivel de energie
2, 8, 7
Numar de oxidare (Oxid)
-1,0,1,3,5,7 (acid puternic)
Structura cristalina
Cristal ortorombic
Propietati fizice
Stare de agregare
gazoasa (nemagnetica)
Punct de topire
171,6 K
Punct de fierbere
239,11 K
Energie de vaporizare
10,2 kJ/mol
Energie de combinare
3,203 kJ/mol
Presiunea vaporilor
1,43 × 1300 Pa
Viteza sunetului
Nu exista rezultate
CLORUL ~Cl~
Clorul este atomul cu numarul de ordine 17, cu simbolul Cl. Se afla in grupa 17, sau VII principala(grupa halogenilor, si perioada a 3-a. Configuratia sa electronica este [Ne]3s23p5. Combinatia sa simpla cu sodiul, [NaCl] se regaseste in viata de zi cu zi, sub numele de sare de bucatarie. Molecula diatomica se prezinta, in conditii normale, sub forma de gaz verde-galbui , si este foarte toxica, fiind primul gaz de lupta folosit.
Clorul se gaseste in natura sub forma de cloruri. Clorurile alcatuiesc cea mai mare parte a sarurilor din apa oceanica - ionii clorura reprezinta aproximativ 1,9% din masa oceanica - dar se intalnesc si sub forma depozitelor solide in scoarta terestra.
In natura se gasesc doar izotopii 35 si 37, intr-o proportie de aproximativ 3:1, ceea ce da atomilor de clor o masa generala de 35,5.
Molecula diatomica de clor se poate obtine din clorurile sale prin oxidare cu agenti oxidanti puternici sau electroliza, sau din compusii cu numere de oxidare superioare lui 0 prin reducere.
Industrial, se obtine prin electroliza unei solutii de NaCl, dupa ecuatia:
2NaCl + 2 H2O → Cl2 + H2 + 2 NaOH] Stari de oxidare
Clorul poate avea urmatoarele stari de oxidare:
Clorul este folosit in purificarea apei, dezinfectanti, inalbitori fiind un gaz asfixiant este folosit si la producerea gazului de lupta gazul de mustar.
Clorul se regaseste si in utilizarile de zi cu zi:
In chimia organica se folosesc proprietatile oxidante ale clorului pentru a substitui atomi de hidrogen din componenta moleculelor, conferindu-le diferite proprietati superioare(de exemplu in copolimerii din cauciucurile sintetice)
Solutiile perfuzabile, denumite ser fiziologic sunt solutii de 0,9% NaCl.
Alte utilizari includ: producerea de clorati, cloroform, tetraclorura de carbon si extragerea bromului.