
|
|
|
STRUCTURA CRISTALULUI FORMAT DE TRANSPORTORUL CorA CE FACILITEAZA TRANSPORTUL DE Mg2+
Ionul de magneziu, Mg2+ , este esențial in nenumarate procese biochimice și ramane singurul ion major de mare importanța biologica, ale carui mecanisme de transport raman neelucidate.
Familia CorA a transportorilor de magneziu este primul sistem de preluare a Mg2+ la majoritatea procariotelor și funcționeaza ca omolog al transportorului mitocondrial de magneziu prezent la eucariote.
In studiul structurii cristalografiate a transportorului, s-a folosit intreaga familie a CorA de la Thermotoga maritima.
Transportorul are forma unui "furnal", format dintr-un homopentamer cu cate 2 helice transmembranare per monomer. Canalul este format de un grup de 5 helice interne avand ca "portari" resturi hidrofobe. Domeniul citoplasmatic vast, formeaza "furnalul", a carui gura larg deschisa asigura conducția spre interiorul celulei, și ai caror pereți sunt formați din cele 5 helice, care sunt de fapt prelungiri ale celor 2 helice transmembranare.
Gatul citoplasmatic al porului este inconjurat, inafara "furnalului", de un inel format de resturi cu sarcini inalt conservate.
2 helice incarcate negativ, din domeniul citoplasmatic, se extind inspre spate orientate spre membrana, inafara "furnalului" și pe deasupra inelului incarcat pozitiv.
Transportorul homopentameric, la nivelul porului central, poate fi divizat in 3 zone.
Un domeniu transmembranar C-terminal, cuprinzand cate 2 helice transmembranare de unitate monomerica, ce prezinta porul central cu o deschidere de aprox. 5Ǻ la intrare și 20Ǻ la gura de ieșire, se formeaza in lungul extinderii α-helixului intern transmembranar.
Domeniul extern citoplasmatic al CorA, este un β-pliat, format de 7 unitați pliate paralel/ antiparalel, facut "sandwich" de 2 seturi α - helice; α1, α2, α3 și α4, α5, α6.
Cele 5 helice transmembranare ce alcatuiesc porul, formeaza 7 bucle proteice extracelulare scurte, intorcandu-se in citoplasma capatul C-terminal incarcat cu un motiv KKKKWL.
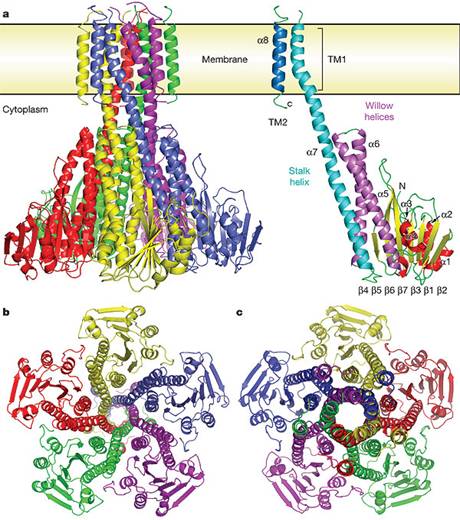
Fig.21. Structura 3D canalului de CorA de Mg2+ . A. diagrama complexului pentameric CorA, in dreapta, o singura unitate a canalului CorA. B. vedere din regiunea intracelulara. C. vedere dinspre periplasma. /
Un ion de Mg2+ , intrand in celula prin CorA, trebuie sa traverseze o distanța de 40Ǻ, extinzandu-se prin filtrul selectiv periplasmic, prin domeniul transmembranar și prin o parte a domeniului citoplasmatic.
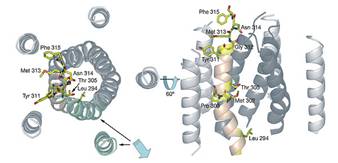
Diametrul caii variaza considerabil in lungime, producand 2 cavitați mici cu diametre de 6Ǻ și 5.6Ǻ; formand 3 constricții interspațiale; prima, formata de lanțurile laterale Asn314, a doua, formata de Thr305 și Met302, și a treia, formata de 2 resturi de Leu294 și Met291.
Canalele de potasiu au o singura cavitate larga, localizata in centrul bistratului, care ajuta la stabilizarea ionului13. Cele 2 cavitați, posibil, au un rol analog pentru CorA.
Sfincterul bazal se afla la același nivel in proteina, cu ultima constricție hidrofoba.
Acest lucru sugereaza ideea ca incarcatura de concentrație pozitiva ar juca un rol important in controlul diametrului porului la acest nivel transmembranar.
Datorita variabilitatii diametrului porului, se pare ca transportorul se afla in conformație inchisa.
Deși CorA are cateva teme structurale comune cu canalele ionice, transportul ionilor se face mult mai incet. Problema ar fi la nivelul ionului de Mg2+ , prefera sa fie hexacoordonat și probabil ramane așa pe tot parcursul procesului de conducere a transportului.
La intrarea ionilor hidratați de Mg2+ prin calea de conducere, numarul situsurilor de coordonare disponibile nu se vor potrivi simetriei pentamerice a filtrului selectiv al CorA.
 La
nivelul porului de conducere ionica al CorA, ionul de Mg2+ se deshidrateaza, acest lucru
reprezentand o cheie de baza in selectivitate.
La
nivelul porului de conducere ionica al CorA, ionul de Mg2+ se deshidrateaza, acest lucru
reprezentand o cheie de baza in selectivitate.
Fig.22. Analiza porului CorA
Inițial, CorA, poate transporta și Co2+ și Ni2+ , 2 ioni asemanatori atomic cu ionul de Mg2+, dar nu și cu ionul de Mn2+ , a carui raza atomica este semnificativ mai mare decat a ionului de Mg2+ .
Gruparile polare de la nivelul porului servesc la compensarea costului de energie consumata in procesul deshidratarii.
CorA poseda un mecanism de reglare a deschiderii porului ca raspuns al schimbarilor de concentrație ionica intracelulara.