
|
|
|
Clasificarea moderna a elementelor - Chimie anorganica
Forma completa a Tabelului Periodic este reprezentarea legii periodicitatii:
(a) proprietatile elementelor sunt functie periodica dependenta de numerele atomice
(b) proprietatile elementelor depind de configuratia lor electronica
(c) elementele care au aceeasi configuratie electronica exterioara au proprietati similare.

Forma completa a Tabelului Periodic - clasificarea in blocuri de elemente
1. Gaze rare (grupa 0 sau grupa 18) - este formata din elemente ale caror atomiprexinta in configuratia lor electronica subnivelele s si p exterioare complet ocupate cu electroni, ns2np2 ; reactivitatea elementelor mai grele din aceasta grupa este explicata prin participarea nivelelor d.
2. Elemente tipice sau reprezentative, elementele grupelor principale (grupele IA, IIA, IIIA, IVA, VA, VIA, VIIA) sau elementele blocurilor s- si p- ale caror atomi au subnivelele s si p exterioare partial ocupate; pentru a forma legaturi cu alti atomi, aceste elemente folosesc numai electronii din stratul exterior
3. Metale tranzitionale sau elementele din blocul d (groupele IIIB, IVB, VB, VIB, VIIB, VB,IB) ale caror atomi au doua nivele partial ocupate, ns si (n-1)d; electronii din ambele subnivele pot fi folositi pentru a forma legaturi; relatia de periodicitate pentru aceste elemente difera de aceea a elementelor grupelor principale; proprietatile sunt similare pe orizontala, iar pe verticala se aplica relatia obisnuita de periodicitate.
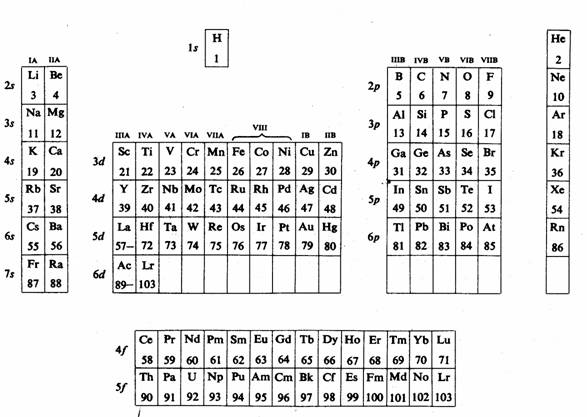
4. Lantanoidele, sau pamanturile rare si actinoidele sau elementele de tranzitie interna ( elementele blocului f ) - ale caror atomi au trei subnivele partial ocupate. Proprietatile similare pe orizontala ale lantanoidelor fac foarte dificila separarea acestora.